
アジ化ナトリウム
| アジ化ナトリウム | |
|---|---|
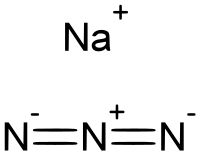
| |
|
アジ化ナトリウム | |
| 識別情報 | |
| CAS登録番号 | 26628-22-8 |
| 特性 | |
| 化学式 | NaN3 |
| モル質量 | 65.0099 g mol−1 |
| 外観 | 無色結晶 |
| 密度 | 1.846 g cm−3, 固体 |
| 融点 |
275 °C, 548 K, 527 °F |
| 沸点 |
300 °C, 573 K, 572 °F (分解) |
| 水への溶解度 | 41.7 g / 100 cm3 水 (17 ℃) |
| 構造 | |
| 結晶構造 | 六方晶系 |
| 熱化学 | |
|
標準生成熱 ΔfH |
21.71 kJ mol−1 |
|
標準モルエントロピー S |
96.86 J mol−1K−1 |
|
標準定圧モル比熱, Cp |
76.61 J mol−1K−1 |
| 危険性 | |
| 安全データシート(外部リンク) | External MSDS |
| EU分類 | 猛毒 (T+) 環境への危険性 (N) |
| NFPA 704 | |
| Rフレーズ | R28 R32 R50/53 |
| Sフレーズ | S1/2 S28 S45 S60 S61 |
| 関連する物質 | |
| 関連物質 |
シアン酸ナトリウム アジ化水素 アジ化メチル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
アジ化ナトリウム (アジかナトリウム、sodium azide) は、組成式 NaN3 で表される白色無臭の結晶である。ナトリウムアジドともいう。式量 65.01、融点 275 ℃、沸騰する前に分解するので沸点は無い。室温では六方晶系の結晶である。窒化ナトリウム Na3N(式量 82.976)と混同されやすいが、これとは全く別の化合物である。
製法
- 具体的にはナトリウムアミド粉末と亜酸化窒素を150-250 ℃で加熱して得る方法(高温法)や流動パラフィンにナトリウムアミドを懸濁させ150-180 ℃で加熱して得る方法(中温法)、ナトリウムアミドを液体アンモニアに溶いて10-30 ℃で亜酸化窒素を吹き込む方法(低温法)などがある。
- 上記に類似した反応で、水加ヒドラジンに水酸化ナトリウムまたはナトリウムメトキシド等のナトリウムアルコキシドのアルコール溶液を加え、亜硝酸エチル等の液状亜硝酸アルキルを加える方法がある。
-
- これらのヒドラジン法は、前者のナトリウムアミド法に比べれば工程が簡単で爆発等の危険性は少ないが、経済性、及び生成するアジ化ナトリウム結晶の純度に問題が残っている。当該方法では副生物の生成率が高く、高純度の製品を得るためには再結晶等の精製操作を必要とする。
性質
生成エンタルピーが正であり、熱力学的に不安定な物質で、融点付近で
の反応が起こり、窒素とナトリウムに分解する。特に、急に加熱すると爆発の危険性もある。しかしながら、重金属元素のアジ化物が衝撃に敏感に反応して爆発することと比較して、アジ化ナトリウムは衝撃による爆発性を有しない。これはナトリウムが非常に電気陽性の強い元素であるためである。
水に非常によく溶け (17 ℃で 42 g/100 ml)、弱塩基性を示す。反応性が高く、二硫化炭素や多くの金属と反応し、爆発性の高いアジ化物を形成する。それに加え、酸とも反応し、爆発性をもち刺激臭のある有毒ガスであるアジ化水素を発生する。
アジ化物イオン N3− の構造は直線形であり共鳴しており、N−N結合距離は1.15 Åである。
用途
アジ化ナトリウムには防腐剤・園芸用殺菌剤・医薬品原料・農薬原料・起爆剤など、さまざまな用途がある。かつては、その爆発・分解性を利用して自動車のエアバッグを窒素ガスで膨らませることに用いていたが、日本では人体・環境に配慮して、2000年より使用が撤廃された。
有機合成において、ハロゲン化アルキルから有機アジ化物を調製する際に求核剤として用いられる。
-
(X = Cl, Br, I)
他の金属アジ化物を合成するための原料としても用いられる。また、加熱によってナトリウムと窒素に分解することから、純粋なナトリウムおよび窒素を得るための原料としても利用される。
水質分析において、ウインクラー・アジ化ナトリウム変法によって溶存酸素量 (DO) を測定する際に亜硝酸による妨害をマスキングするために用られる。また、二酸化硫黄や亜硫酸の分析においても同様に、亜硝酸による妨害をマスキングするために用いられる。
エイズ治療薬であるアジドチミジンの原料となるほか、アジ化水素、アジ化水素酸エステル、アジ化物の原料となる。
測定実験
物理化学的な測定において試料セル (sample cell) と参照セル (reference cell) がある測定装置 (ITC・DSC) は参照セルにアジ化ナトリウムを使用しており、上記に示されるように防腐剤の役割を果たしている。
毒性
酸と反応して生成するアジ化水素を吸引することや、アジ化ナトリウムそのものを経口摂取することは非常に危険である。また、アジ化物イオンは細胞の呼吸を阻害する働きがある。一酸化炭素がそうであるのと同様に、ヘモグロビンに対して不可逆的な結合を形成し、これにより細胞が死(アポトーシス)にいたる。アジ化ナトリウムによって最も深刻な被害を受けるのは、多量の酸素を必要とする、心臓と大脳である。
アジ化ナトリウムの最低影響量は5mg以下と考えられる。アジ化ナトリウム摂取後の症状として、頭痛・吐き気・発汗・筋弛緩・血圧降下・頻脈・過呼吸・徐脈・眼への作用が見られ、部検所見では必ず脳と肺の浮腫が認められる。大量に摂取すると、痙攣・血圧降下・意識不明・呼吸不全などを引き起こし死に至る。現在、中毒症状に対する根本的な治療方法は確立されておらず、対症療法のみの治療となる。アジ化ナトリウム中毒から回復したとしても、脳などに深刻な後遺症が残る場合もある。
なお、アジ化ナトリウムは胃酸と反応し、アジ化水素を発生させ、治療者に二次被害を与える危険性がある。日本でも、医療スタッフに「眩暈」「頭痛」「目の痛み」などの二次被害が発生した事例がある。
法規制
日本
食物に砒素を混入した和歌山毒物カレー事件が起きた1998年夏から秋にかけて、新潟・三重・愛知・京都でポットの湯などにアジ化ナトリウムが混入される事件が相次いだ。薬品のずさんな管理体制が明らかになった一連の事件を受けて、厚生労働省は1999年に毒物及び劇物取締法により、アジ化ナトリウムを毒物に指定した。
消防法において、第5類危険物(自己反応性物質)に属する。因みに、アジ化ナトリウムは、加熱すると分解し第3類危険物(自然発火性物質・禁水性物質)である金属ナトリウム(Na)を生じる。







