
アフリカ睡眠病
| アフリカ睡眠病 | |
|---|---|
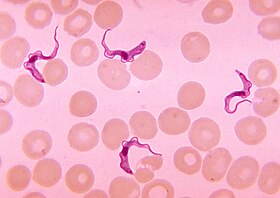 アフリカ睡眠病を引き起こすトリパノソーマ(紫色をした4つ)
| |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 |
感染症内科学 |
| ICD-10 | B56 |
| ICD-9-CM | 086.5 |
| DiseasesDB | 29277 13400 |
| MedlinePlus | 001362 |
| eMedicine | med/2140 |
| Patient UK | アフリカ睡眠病 |
| MeSH | D014353 |
| GeneReviews | |
アフリカ睡眠病(アフリカすいみんびょう、African sleeping sickness)は、ツェツェバエが媒介する寄生性原虫トリパノソーマによって引き起こされる人獣共通感染症である 。病状が進行すると睡眠周期が乱れ朦朧とした状態になり、さらには昏睡して死に至る疾患であり、これが名前の由来となっている。催眠病、眠り病、アフリカトリパノソーマ症(African trypanosomiasis)とも呼ばれる。
アフリカのサハラ以南36か国6千万人の居住する領域における風土病で、感染者は5万人から7万人と推計されている。症例の80%以上はコンゴ民主共和国で発生している。顧みられない熱帯病のひとつである。
疫学
サハラ以南36か国で見られており、ウガンダ南西部とケニア西部では風土病となっており、年間4万人が死亡している。6000万人が感染のリスクにさらされており、毎年30万人が新たに感染していると考えられていたが、新規患者数は減りつつあり2007年には1万人ほどになった。アフリカ睡眠病によってのべ200万年におよぶ障害調整生命年 (DALY) が失われていると推定されている。
ツェツェバエが媒介するため、ツェツェバエの生息地が流行地となりやすい。しかしツェツェバエが生息していても流行の見られない土地もあり、その理由はよくわかっていない。農業・漁業・牧畜・狩猟などをして田舎で暮らす人々はツェツェバエに刺されやすく、したがって罹患しやすい。流行地は往々にして遠隔地であり、医療体制が脆弱である。流行は集落に留まる場合から地域全体に広がる場合まであり、また地域のなかでも集落ごとに流行の程度に差があるのが常である。集団移住、戦争、貧困などが伝染を増やす主な要因である。
症状
第1期は発熱・頭痛・関節痛といった症状が認められ、原虫が循環系に広がるにつれリンパ節が大きく腫れ上がる。首筋の背中側のリンパ節が腫脹するWinterbottom徴候が認められる場合がある。これを放置すると、次第に感染者の生体防御機構をくぐりぬけ、貧血や内分泌系・心臓・腎臓の疾患を示すようになる。病原体がガンビアトリパノソーマである場合には症状に気付かぬまま過ごしてしまう場合も多い。
第2期では、原虫は血液脳関門を通過して神経疾患を引き起こす。まず神経痛が認められ、錯乱や躁鬱のような単純な精神障害が現れる。次いで睡眠周期が乱れて昼夜が逆転し、昼間の居眠りや夜間の不眠となる。そのうち常に朦朧とした状態になり、さらには昏睡して死に至る。この時期の症状がこの疾患の名前の由来となっている。原虫により放出されるトリプトフォールが睡眠を引き起こすと考えられている。
治療しなければ致命的であり、第2期には治療したとしても不可逆的な神経傷害を受けることがある。
病原体
アフリカ睡眠病の病原体はツェツェバエが媒介するトリパノソーマという原虫である。分類学的にはブルーストリパノソーマ (Trypanosoma brucei) という種であるが、このうち2つの亜種がヒトにアフリカ睡眠病を引き起こす。亜種の違いにより病状に差が出るほか、媒介するツェツェバエにも差があるため地理的分布に差がある。
- ガンビアトリパノソーマ (T. b. gambiense)
- 主にアフリカの中央部・西部(ヴィクトリア湖より西)に分布しており、主な保虫宿主はヒトであるがブタやその他の動物からも見出される。水辺に多いGlossina palpalisグループが媒介する。発症するまでに数か月から数年にわたる慢性的な経過をたどり、その時点ですでに中枢神経が冒されている事が多い。報告される症例の9割方はこの原虫によるものである。
- ローデシアトリパノソーマ (T. b. rhodesiense)
- アフリカ南部・東部(ビクトリア湖より東)に分布しており、狩猟動物や家畜が主な保虫宿主である。サバンナに多いGlossina morsitansグループが媒介する。数週間で発症し急性的な経過をたどる。
なお中南米でシャーガス病を引き起こすのはクルーズトリパノソーマ (Trypanosoma cruzi) という別種であり、同じトリパノソーマ属の原虫であるが性状にかなりの差がある。
生活環
- 感染しているツェツェバエが哺乳類から吸血する際に、メタサイクリック型の原虫が皮膚に注入される。
- 原虫は宿主体内で血流型へ変態し、リンパ系から血流へと流れ込み体中へ運ばれる。
- 常に細胞外(血液・リンパ液・髄液などの体液中)で二分裂により増殖する。
- 血流型原虫
- ツェツェバエは、吸血する際に血液中の血流型原虫を取り込むことにより感染する。
- ツェツェバエの中腸でプロサイクリック型へと変態し、二分裂により増殖する。
- 中腸から脱出すると上鞭毛型へと変態し、
- 唾液腺に到達して増殖を続け、一部がメタサイクリック型へと変態する。
ツェツェバエでの発育には3週間ほどを要する。
感染経路
ツェツェバエに吸血されることによりトリパノソーマに感染する。それ以外にも、まれに以下のような原因で感染する場合がある。
- 母子感染: 胎盤経由で胎児に感染することがある
- 実験室: 感染者の血液や移植臓器を取り扱う際に、偶発的に感染することがある
- 輸血
- 性接触
診断
診断は下疳液・リンパ節吸引液・血液・骨髄・髄液などを検鏡してトリパノソーマの存在を示すことによる。生鮮のまま、あるいは固定しギムザ染色した後に検鏡する。検鏡する前に遠心などの方法で濃縮することもできる。ラットやマウスに接種して原虫を単離するのは感度の良い方法だが、ローデシアトリパノソーマに限られる。
予防と治療
予防
今のところワクチンはない。感染予防に関しては、該当地域に渡航の際、ハエに刺されないような工夫をすることが重要である。
治療
原虫が中枢神経に達する前後で取るべき治療法が変わるため、感染者を見出した場合には腰椎穿刺による髄液の検査を行い、病状の進行段階を見極める必要がある。原虫が中枢に達する前(第1期)であれば予後は比較的良好であるが、中枢に達した後(第2期)は治療はより困難になり、治癒したとしても後遺症が残る場合が多くなる。また治療後は再発を捉えるために、2年間にわたって6か月ごとに腰椎穿刺による検査をすべきである。 (以下の記述は英語版ウィキペディアによる。厚生労働省研究班による寄生虫症薬物治療の手引きも参照のこと。)
- 第1期
- 第1期における標準的な第一選択療法は、ガンビアトリパノソーマに対してはペンタミジン (pentamidine) 静注または筋注、ローデシアトリパノソーマに対してはスラミン (suramin) 静注である。これらの薬剤は血液脳関門を越えないため、第2期には効果がない。
- 第2期
- ガンビアトリパノソーマに対してはエフロルニチン (eflornithine) 50 mg/kg 静注6時間おきに14日間を用いる。オルニチン脱炭酸酵素の阻害剤であるエフロルニチンは、ガンビアトリパノソーマにしか効かないが、メラルソプロールよりも副作用が少なく、第一選択薬となり得る。またエフロルニチンとニフルチモックスを併用すればエフロルニチン単剤よりも安全・簡単で効果的であるという結果がある。
- エフロルニチンが効果ない場合およびローデシアトリパノソーマに対しては、メラルソプロール・ニフルチモックス併用療法(1日目メラルソプロール 0.6 mg/kg 静注・2日目おなじく1.2 mg/kg 静注・以後10日目まで1日おきに1.2 mg/kg 静注およびニフルチモックス (nifurtimox) 7.5 mg/kg 経口投与)を行う。メラルソプロールは3価の砒素を含む有機砒素化合物で、投与された患者の3 - 10%が副作用により砒素性脳症(痙攣・進行性昏睡・精神病性応答)を起こし、その10 - 70%が死亡するため注意が必要。またメラルソプロールへの耐性が拡大している。
新薬の開発
トリパノソーマのゲノムが解読され、治療薬の標的となり得るタンパク質がいくつか発見された。またゲノム情報によりなぜこの病気に対するワクチンを作ることが難しいのかの理由も明らかになった。組み合わせることで免疫系からの検知を逃れるための800を超える遺伝子が存在している。
初の経口薬としてpafuramidine (DB289) が開発されていたが、治験が第III相に入った後の2008年に安全性への懸念から開発中止となった。
疫学的対策
アフリカ睡眠病の制圧に向けた戦略には以下の2通りの方法がある。医学・獣医学的にこの疾病を監視・予防・治療・調査することにより感染している患者・患畜数を減らすことおよび、衛生動物学的に媒介昆虫の数を減らして伝播サイクルを絶つことである。これまで媒介者であるツェツェバエを根絶することに重点が置かれ、ツェツェバエの不妊虫放飼が効果を上げてきた。
同時に重要なのが、定期的に診断と治療を行う能動的検査活動である。高度蔓延地域では症例ごとに検査を行うのは現実的ではないので、拠点を設けてその地域共同体で系統立てて検査を行うのが最善の策である。例えば拠点から1日で移動できるところに移動診療所や検査センターを出すことになる。ガンビアトリパノソーマの場合、症状がほとんどでていないかそうでなければ深刻すぎるという状態になるため、侵淫地が一般に遠隔地であることもあり、患者は病態が十分早い時期に治療を受けることができない。また診断が難しいため地元の保健従事者では患者を発見できない。そこで系統立てた検査をすることで初期の疾患を発見できて、病状が進行する前に治療して蔓延の原因となる感染者数を減らすことができる。
歴史
かつてアフリカ大陸は現在よりも湿潤で、ツェツェバエの分布もナイル川下流域まで広がっていたと考えられている。当然この地域の羊飼いたちもトリパノソーマ症にかかっていたと想像される。実際に紀元前1800年頃のカフン・パピルス(en:Kahun Papyrus)には現在のナガナ病とよく似た家畜の病気の記述がある。しかしヒトのアフリカ睡眠病に関する文献はほとんどなく、ようやく12世紀シリアの地理学者ヤクト (1179 - 1229) の著作に現在のアフリカ睡眠病に良く似た記述があるくらいである。14世紀にはアラブの歴史家イブン=ハルドゥーンが、マリ帝国の王Mari Djata 2世が今日で言うアフリカ睡眠病で死んだという話を記録している。
広大なイスラム帝国を作り上げたアラブ人がなぜサハラ砂漠以南を征服できなかったかについては、本疾病が大きな理由と言われている。また、カメルーンなどサヘル地帯に位置する国では、歴史的に南部の海岸沿いよりも北部のサハラ砂漠の周辺部で発展してきたと言われる。これも、本疾病のために家畜を中南部に連れてくることができなかったためとされている。
アフリカ睡眠病は奴隷貿易との関係で近代ヨーロッパ世界に知られるようになる。つまり、奴隷貿易会社の船医たちから最初の報告が上げられたのである。1734年イギリス海軍軍医のジョン・アトキンス (1685 - 1757) がはじめて詳細な症例報告を行っている。この時は第2期の神経症状の報告に留まっていたが、1803年にはイギリスの医師Thomas Winterbottom (1766 - 1859) が第1期の徴候である首周りのリンパ節腫脹を報告し、古くからアラブの奴隷商人がこの徴候を示す奴隷を避けていたことに触れている。
当初ヨーロッパ人はアフリカの植民地にウマを持ち込んだが、アフリカ睡眠病になり使い物にならなかった。しかしツェツェバエと生息域が重複するシマウマは体毛が極端に短く吸血が容易であるにもかかわらず、病気に罹りにくいため家畜化が試みられた。理由は長らく不明であったが、2014年にカリフォルニア大学デービス校のティム・カロ(Tim Caro)博士らの研究チームにより、ツェツェバエは色彩が均一な面を好んで着地し、シマウマの体表のような模様のある面は避ける傾向があることが確認された。
1901年イギリス植民地の外科医Robert Michael Forde (1861 - 1948) がガンビアの船長の血液から「虫」を発見し、それを数か月後に内科医Joseph Everett Dutton (1874 - 1905) がTrypanosoma属の原虫と同定してTrypanosoma gambienseと命名した。1902年イタリアの病理学者アルド・カステラーニ (1878 - 1971) がアフリカ睡眠病の患者の髄液からトリパノソーマを見出し、これが病原体であると考えた。すでに1895年にはスコットランドの病理学者デヴィッド・ブルース (1855 - 1931) がトリパノソーマをウシのナガナ病の病原体として発見していたが、彼は1903年にトリパノソーマがツェツェバエによって媒介されるという証拠を得る。1910年にはアフリカ睡眠病の2番目の病原体としてTrypanosoma rhodesienseが発見される。
一方1902年フランスの医師シャルル・ルイ・アルフォンス・ラヴランと生物学者フェリックス・メニル (1868 – 1938) が亜ヒ酸ナトリウムが実験動物の治療に有効であることを示してから、様々な薬剤が治療薬として試みられてきた。
| 導入年 | 薬剤 | 開発者 | 第2期への適用 | 備考 |
|---|---|---|---|---|
| 1905年 | アトキシル (atoxyl) | Thomas and Breinl | 不可 | 有機砒素 |
| 1915年 | トリパルサマイド (tryparsamide) | Jacobs and Heidelberger | 可 | 有機砒素 |
| 1916年 | スラミン (suramin) | バイエル | 不可 | |
| 1937年 | ペンタミジン (pentamidine) | メイ・アンド・ベーカー(現サノフィ・アベンティス) | 不可 | |
| 1949年 | メラルソプロール (melarsoprol) | Friedheim | 可 | 有機砒素 |
| 1990年 | エフロールニチン (eflornithine) | メレル・ダウ(現サノフィ・アベンティス) | 可 | オルニチン脱炭酸酵素の阻害剤 |
近代以降のアフリカ睡眠病の流行にはいくつかの波が認められる。1896年から1906年にかけてウガンダやコンゴ盆地で流行があり、計80万人が死亡したとされているのが最初の波である。次いで1920年ごろから流行が始まったが、これは移動検診班が系統的にスクリーニングすることで次第に抑え込むことができた。フランス軍医のEugène Jamot (1879 – 1937) は、1926年に上役の許可を取り付けてカメルーンでスクリーニングを実行に移したところ、1919年には60%だった有病率が1930年に0.2 - 4.1%まで減少する成果を上げた。この手法は他の宗主国にも導入され、1960年代中頃にはこの疾患はほとんど消滅するまでに至った。しかしそれと前後するようにアフリカ諸国が独立を果たし、その多くは政情不安定になり経済が荒廃して保健体制が崩壊した。アフリカ睡眠病の制圧プログラムは中断され、組織的スクリーニングもごく小規模なものに後退してしまった。その結果1970年代後半から再び患者数が増え始め、この流行は現在まで継続している。なお1990年代後半から組織的なスクリーニングが再開され、症例数は1998年をピークに減少に転じている。
エフロールニチンは1999年に製造者であるアベンティスが製造中止にしてしまった。しかし2001年、国境なき医師団と世界保健機関 (WHO) との協力のもと、アベンティスが製造・寄贈する契約が成立した。
2001年アフリカ統一機構(現アフリカ連合)がPan African Tsetse and Trypanosomiasis Eradication Campaign (PATTEC; 汎アフリカ・ツェツェバエ・トリパノソーマ症撲滅キャンペーン)を立ち上げた。これは誘引トラップや超微量殺虫剤散布などによりツェツェバエの生息数を減らした上で、不妊虫放飼により特定種のツェツェバエの絶滅を目指すものである。不妊虫放飼は1997年ザンジバルでのツェツェバエそしてトリパノソーマ症の撲滅に用いられ成功した方法である。しかしザンジバルでは1651平方キロメートルの隔離された島でただ1種を絶滅させたに過ぎず、サハラ以南全域という広大な連続した土地で少なくとも7種を絶滅させようというPATTECの計画は野心的である。過去の類似の撲滅キャンペーンがツェツェバエの生息地域を分断できずに失敗したことから、PATTECに懐疑的な研究者も多い。また関係国の多くは最貧国であり、必要となる莫大なコストをどうするのかも問題である。
脚注
参考文献
- “Immtech focusing on new infectious disease programs following discontinuation of development of pafuramidine” (PDF). Immtech Pharmaceuticals, Inc. (2008年2月22日). 2009年8月15日閲覧。
- WHO Expert Committee on Control and Surveillance of African trypanosomiasis (Geneva) (1998). WHO Technical Report Series,No.881. http://www.who.int/tdr/diseases/tryp/direction.htm#Refs.
- World Health Organization (Geneva) (2000). World Health Report 2000: Health Systems Improving Performance. http://www.who.int/tdr/diseases/tryp/direction.htm#Refs.
- WHO mortality and health data and statistics, accessed Feb 10, 2009.
- WHO Media centre (2006). Fact sheet N°259: African trypanosomiasis or sleeping sickness. http://www.who.int/mediacentre/factsheets/fs259/en/.
- “Strategic Direction for African Trypanosomiasis Research”. Special Programme for Research and Training in Tropical Diseases. 2006年3月1日閲覧。
- Berriman M, Ghedin E, Hertz-Fowler C, et al. (2005). “The genome of the African trypanosome Trypanosoma brucei”. Science 309 (5733): 416–22. doi:10.1126/science.1112642. PMID 16020726. http://www.sciencemag.org/cgi/content/full/309/5733/416.
- Bisser S, N'Siesi FX, Lejon V, et al. (2007). “Equivalence trial of melarsoprol and nifurtimox monotherapy and combination therapy for the treatment of second-stage Trypanosoma brucei gambiense sleeping sickness”. J. Infect. Dis. 195 (3): 322–9. doi:10.1086/510534\ref=Bisser. PMID 17205469.
- Burri, C (2000). “Efficacy of new, concise schedule for melarsoprol in treatment of sleeping sickness caused by Trypanosoma brucei gambiense: a randomised trial”. Lancet 355 (9213): 1419–25. doi:10.1016/S0140-6736(00)02141-3. PMID 10791526.
- Chappuis F, Udayraj N, Stietenroth K, Meussen A, Bovier PA (2005). “Eflornithine is safer than melarsoprol for the treatment of second-stage Trypanosoma brucei gambiense human African trypanosomiasis”. Clin. Infect. Dis. 41 (5): 748–51. doi:10.1086/432576. PMID 16080099.
- van Nieuwenhove S, Schechter PJ, Declercq J, et al. (1985). “Treatment of gambiense sleeping sickness in the Sudan with oral DFMO (DL-alfa-difluoromethyl ornithine) an inhibitor of ornithine decarboxylase: first field trial”. Trans R Soc Trop Med Hyg 79 (5): 692–8. doi:10.1016/0035-9203(85)90195-6.
- Olowe SA (1975). “A case of congenital trypanosomiasis in Lagos”. Trans. R. Soc. Trop. Med. Hyg. 69 (1): 57–9. PMID 1170654.
- Priotto, G., et al. (2008). “Safety and effectiveness of first line eflornithine for Trypanosoma brucei gambiense sleeping sickness in Sudan: cohort study”. BMJ 336 (7646): 705-708. doi:10.1136/bmj.39485.592674.BE. PMID 18321960.
- Priotto G, Kasparian S, Mutombo W, et al. (July 2009). “Nifurtimox-eflornithine combination therapy for second-stage African Trypanosoma brucei gambiense trypanosomiasis: a multicentre, randomised, phase III, non-inferiority trial”. Lancet 374 (9683): 56–64. doi:10.1016/S0140-6736(09)61117-X. PMID 19559476.
- Rocha G, Martins A, Gama G, Brandão F, Atouguia J (January 2004). “Possible cases of sexual and congenital transmission of sleeping sickness”. Lancet 363 (9404): 247. doi:10.1016/S0140-6736(03)15345-7. PMID 14738812.
- Dietmar Steverding (2008). “The history of African trypanosomiasis”. Parasites and Vectors 1: 3. doi:10.1186/1756-3305-1-3.
- 嶋田義仁 (1995). 牧畜イスラーム国家の人類学. 世界思想社. ISBN 978-4790705727
関連項目
外部リンク
- WHO Trypanosomiasis, African(WHOによる情報のポータル)
- Sleeping Sickness Overview (国境なき医師団による概説およびニュース)
- Human African Trypanosomiasis(Drugs for Neglected Diseases Initiativeによる創薬プログラム)
|
貧困の病
| |
|---|---|
| 貧困の病 | |
| 顧みられない病気 | |
| その他 | |


