サイクリン依存性キナーゼ2
サイクリン依存性キナーゼ2(サイクリンいぞんせいキナーゼ2、英: cyclin-dependent kinase 2、略称: CDK2)は、サイクリン依存性キナーゼ(CDK)ファミリーに属するセリン/スレオニンキナーゼである。ヒトではCDK2遺伝子にコードされる。CDK2は、ヒトのCDK1や、出芽酵母Saccharomyces cerevisiaeのcdc28、分裂酵母Schizosaccharomyces pombeのcdc2の遺伝子産物ときわめて類似している。CDK2はサイクリン/CDK複合体の触媒サブユニットとして機能し、その活性は細胞周期のG1/S期に限定される。この期間に細胞は有糸分裂とDNA複製に必要なタンパク質の合成を行う。CDK2はサイクリンEやサイクリンAなどの調節サブユニットと結合し、それらによる調節を受ける。サイクリンEとの結合は、G1期からS期への進行に必要とされる。一方、サイクリンAとの結合はS期を通じて細胞周期の進行に必要とされる。CDK2の活性はリン酸化によっても調節される。複数のスプライスバリアントや複数の遺伝子転写開始部位が存在することも報告されている。近年、CDK2を欠失した細胞でもG1期からS期への移行が起こることが報告され、この過程におけるCDK2の必要性には疑問が呈されている。
正常に機能している組織における必要性
培養細胞に基づいた実験では、CDK2の阻害によってG1/S期の移行の時点で細胞周期が停止することが示されていた。後のマウス胚線維芽細胞を用いた実験では、CDK2の欠失によってG1期が延長することが示された。しかし、この期間の後にはS期への進行が起こり、細胞周期の残りの期間を完了することも可能であった。マウスでCDK2を欠失させたときには、生存は可能であるが体のサイズは小さくなる。一方、オスとメスの双方で減数分裂が阻害された。このことは、CDK2は健康な細胞の細胞周期には必須ではないものの、減数分裂や生殖には必須であることを示唆している。CDK2のノックアウトマウスの細胞は分裂回数が少なく、そのため体のサイズが小さくなると考えられる。また、生殖細胞は減数分裂の前期で分裂を停止するため、不妊となる。現在では、減数分裂の機能を除いた多くの面で、CDK2の欠失の影響はCDK1によって補償されていると考えられている。
活性化機構
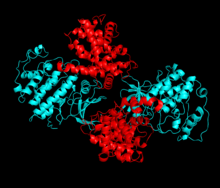
CDK2は2つのローブからなる構造をしている。N末端側のローブ(Nローブ)は多くのβシートを含む一方、C末端側のローブ(Cローブ)はαヘリックスに富む。CDK2は多種のサイクリンと結合することができ、サイクリンA、B、E、そしておそらくサイクリンCとも結合する。近年の研究では、CDK2はサイクリンA、Eに、CDK1はサイクリンA、Bに対し優先的に結合することが示唆されている。
CDK2は、NローブとCローブの間に位置する活性部位にサイクリンが結合したときに活性化状態となる。この活性部位の配置のため、パートナーとなるサイクリンはCDK2の双方のローブと相互作用する。CDK2のNローブには重要なαヘリックスが存在し、CヘリックスまたはPSTAIREヘリックスと呼ばれている。Cヘリックスとサイクリンは疎水的相互作用を行う。活性化に伴ってコンフォメーションの変化が起こり、Cヘリックスは回転してNローブのコアの近くへ移動する。これによってCヘリックスのグルタミン酸残基と近接するリジン残基との間でイオン対が形成される。また、このコンフォメーション変化によって活性化ループ(Tループ)と呼ばれる領域がCローブ側へ再配置され、ATP結合部位が露出して新たな相互作用が可能な状態となる。活性化ループが触媒部位から移動すると、活性化ループのスレオニン残基のリン酸化が行われる。リン酸化されたスレオニン残基は、酵素の最終的なコンフォメーションを安定化する。この活性化過程を通じて、CDK2に結合したサイクリン側にはコンフォメーション変化は起こらない。
DNA複製における役割
細胞分裂過程が成功するかどうかは、細胞と組織の双方のレベルでの正確な調節に依存している。細胞内のタンパク質とDNAの複雑な相互作用によって、ゲノムDNAは娘細胞へ伝達される。そして細胞と細胞外マトリックスタンパク質との相互作用によって、新たな細胞は既存の組織中へ組み込まれる。細胞レベルでは、細胞分裂過程はCDKとサイクリンによって制御されている。DNA損傷などの欠陥が修復されるまで細胞周期の進行を遅らせる手段として、細胞はさまざまな細胞周期チェックポイントを利用する。
CDK2は細胞周期のG1期とS期を通じて活性があり、G1/S期のチェックポイントの制御を行う。G1期に先立って、CDK4とCDK6のレベルがサイクリンDとともに上昇する。これによってG1期の初期にはRbタンパク質の部分的なリン酸化が行われ、転写因子のE2Fの抑制が部分的に解除される。その結果サイクリンEの合成が促進されてCDK2の活性が上昇する。G1期の終わりにはサイクリンE-CDK2複合体の活性は最大レベルに達し、S期の開始に大きな役割を果たす。G1/S期の移行時にはRbタンパク質とp27タンパク質がサイクリンA/E-CDK2複合体によってリン酸化され、完全に不活性化される。それに伴い、E2FによってS期への進入を促進する遺伝子の発現が行われる。さらに、サイクリンE-CDK2複合体の基質であるNPATがリン酸化され、ヒストン遺伝子の転写を活性化する。これによってクロマチンの主要なタンパク質構成要素であるヒストンの合成が増大し、S期に行われるDNA複製をサポートする。S期の終わりに、サイクリンEはユビキチン-プロテアソームシステムによって分解される。
がん細胞の増殖
CDK2は正常に機能している細胞での細胞周期の進行に必要不可欠な要素ではないが、がん細胞の異常な成長過程には重要である。CCNE1遺伝子は、CDK2の主要な2つの結合パートナーのうちの1つであるサイクリンEを産生する。CCNE1の過剰発現は多くの腫瘍細胞で見られ、これらの細胞の生存はCDK2とサイクリンEに依存している。サイクリンEの異常な活性は、乳がん、肺がん、大腸がん、胃がん、骨のがん、白血病やリンパ腫でも見られる。同様に、サイクリンA2の異常な発現は染色体不安定性や腫瘍増殖と関係しており、その阻害によって腫瘍の成長は低下する。そのため、CDK2とそのパートナーとなるサイクリンは新たながん治療法の治療標的となる可能性がある。前臨床モデルでは腫瘍成長の抑制に予備的な成功がみられており、現行の化学療法薬の副作用を減少させることも観察されている。
CDK2に対する選択的阻害薬の同定は、CDK2と他のCDKの活性部位の類似性、特にCDK1との極度の類似性のため困難である。CDK1は細胞周期に必須な唯一のCDKであり、その阻害によって意図しない副作用が生じる可能性がある。CDK2阻害薬候補の大部分はATP結合部位を標的としており、タイプIとタイプIIの2つの主要なクラスに分類される。タイプIの阻害薬は活性部位のATP結合部位に対して競合的に機能する。タイプIIの阻害薬はサイクリン非結合状態のCDK2を標的とし、ATP結合部位やキナーゼ内の疎水的ポケットのどちらかを占有する。タイプIIの阻害薬の方が選択性が高いと考えられている。近年、CDKの新たな結晶構造が発表され、Cヘリックスの近傍にアロステリック結合部位が存在する可能性が示された。このアロステリック部位を標的とした阻害薬はタイプIIIに分類される。他に標的として可能性があるのはCDK2のTループである。サイクリンAがCDK2に結合するとNローブが回転し、ATP結合部位は活性化され、Tループと呼ばれる活性化ループの位置が切り替えられる。
阻害因子
既知のCDK阻害因子としては、p21Cip1(CDKN1A)やp27Kip1(CDKN1B)がある。
ロスマリン酸メチル(rosmarinic acid methyl ester)は植物由来のCDK2阻害剤で、マウス再狭窄モデルにおいて血管平滑筋細胞の増殖を抑制し、内膜新生を低下させることが示されている。
遺伝子調節
メラニン細胞では、CDK2遺伝子の発現は小眼球症関連転写因子(MITF)によって調節されている。
相互作用
CDK2は次に挙げる因子と相互作用することが示されている。
関連文献
- “Cell cycle sibling rivalry: Cdc2 vs. Cdk2”. Cell Cycle 4 (11): 1491–4. (November 2005). doi:10.4161/cc.4.11.2124. PMID 16258277.
- “Cyclin dependent kinase 2 and the regulation of human progesterone receptor activity”. Steroids 72 (2): 202–9. (February 2007). doi:10.1016/j.steroids.2006.11.025. PMC 1950255. PMID 17207508. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1950255/.
外部リンク
- Cyclin-Dependent Kinase 2 - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)