セルピン
| セルピン(セリンプロテアーゼインヒビター) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|

| |||||||||||
| 識別子 | |||||||||||
| 略号 | Serpin, SERPIN (root symbol of family) | ||||||||||
| Pfam | PF00079 | ||||||||||
| InterPro | IPR000215 | ||||||||||
| PROSITE | PDOC00256 | ||||||||||
| SCOP | 1hle | ||||||||||
| SUPERFAMILY | 1hle | ||||||||||
| CDD | cd00172 | ||||||||||
| |||||||||||
セルピン(セリンプロテアーゼインヒビター、セリンプロテアーゼ阻害剤、英: Serpin)は、最初にプロテアーゼ阻害効果を持つ事で同定された類似構造を持つタンパク質のスーパーファミリーで、全ての界の生物で発見される。セルピン (serpin) の略名は元々最初に同定されたセルピンがキモトリプシン様セリンプロテアーゼに対して働く (serine protease inhibitors) ために名付けられた造語である。特筆すべきはセルピンの珍しい活性機構であり、セルピンは立体構造の大きな変化を受ける事でプロテアーゼの活性中心を破壊し、標的を不可逆的に阻害する。この阻害機構は他の一般的なプロテアーゼ阻害剤が競合的阻害剤で、酵素と結合して活性中心を塞ぐ事で働くのと対照的である。
セルピンによるプロテアーゼ阻害は血液凝固反応や炎症といった数々の生化学行程を制御するため、セルピンに含まれるタンパク質は医学研究の対象となる。セルピンの構造変化はユニークであり、それゆえに構造生物学やタンパク質の折りたたみの解析においてもセルピンは興味深い研究対象とされる。構造変化による阻害機構はいくつかの利点を持つが、同時に欠点も抱えており、タンパク質の折りたたみ異常や不活性の長鎖重合体の形成のようなセルピン病 (serpinopathy) を起因する変異に対し脆弱である。セルピンの重合反応は活性を有する阻害剤の減少につながるのみならず、細胞死や臓器不全をも起こしうる。
ほとんどのセルピンはタンパク質の分解反応を制御するが、中にはセルピンの構造を持ちながら酵素阻害剤として働かず、貯蔵(卵白中のオボアルブミンのように)や、ホルモンの輸送タンパク質(チロキシン結合グロブリンやトランスコルチン)のように運搬に関わったり、分子シャペロン(ヒートショックプロテイン47)として働くものもある。以上のようなタンパク質は阻害剤として働かないにも関わらず、進化学的に近縁なため、セルピンという語句はセリンプロテアーゼの阻害剤以外にも使われる。
歴史
血漿のプロテアーゼ阻害効果は1800年代の終わりには既に報告されていたが、1950年代以降までアンチトロンビンやα1-アンチトリプシンをはじめとしたセルピンは分離されていなかった。セルピンに関する初期の研究はヒトの病気に焦点を当てていた。肺気腫を引き起こすアルファ1アンチトリプシン欠損症はもっとも一般的な遺伝性疾患の一つであり、また、アンチトロンビンの欠損は血栓症の原因となる。
1980年代にはこれらの阻害剤が、プロテアーゼ阻害剤(例: α1-アンチトリプシン)と非阻害剤(例: オボアルブミン)両者を含む、相同なタンパク質スーパーファミリーの一部である事が明らかになった。"Serpin"の名は一般的なセルピンの効果であるセリンプロテアーゼ阻害剤 (serine protease inhibitors) に基づいた造語である。同じ頃に、セルピンタンパク質は初めて立体構造が解かれ、まず弛緩型の、そして後に緊張型の構造が明らかにされた。セルピンの構造解析はセルピンの阻害作用が立体構造の珍しい変化を伴う事を示し、その後のセルピンの研究は構造に焦点を当てたものになる。
これまでに同定された1000種類以上のセルピンには、36種のヒトのタンパク質の他、動物、植物、菌類、細菌、古細菌といった全ての界のものが含まれ、ウイルスから同定されたものもある。2000年代にはセルピンスーパーファミリーを進化学的な関係から分類するための命名体系が導入された。このようにセルピンはプロテアーゼ阻害剤ではもっとも巨大でもっとも多様なスーパーファミリーを形成している。
活性
ほとんどのセルピンはプロテアーゼの阻害剤で、細胞外のキモトリプシン様セリンプロテアーゼを標的とする。これらのプロテアーゼは触媒三残基の内、求核的なセリン残基を活性部位に持っている。例としてトロンビンやトリプシン、ヒト好中球エラスターゼなどが挙げられよう。セルピンはプロテアーゼの分解機構における中間体を捕らえることで、不可逆的に自殺型阻害剤として働く。
セルピンの中にはセリンプロテアーゼ以外のプロテアーゼのクラスを(典型的にはシステインプロテアーゼ)阻害するものもあり、「クラス横断型阻害剤 (cross-class inhibitors) 」と呼ばれる。セリンプロテアーゼと違うのは活性部位にセリンではなく、求核的なシステイン残基を用いる点にある。標的の違いにも関わらず、酵素化学的に両者は似ており、両クラスのプロテアーゼに対するセルピンの阻害機構は同一である。クラス横断型阻害剤の例として扁平上皮癌抗原1 (SCCA-1) としても知られるセルピンB4やトリのセルピンであるMENTなどがあり、この2つはいずれもパパイン様システインプロテアーゼを阻害する。
生物学的機能と局在
プロテアーゼの阻害
ヒトのセルピンのおおよそ3分の2は細胞外で働き、血中においてプロテアーゼの機能を阻害してプロテアーゼの活性を穏やかにする。例えば細胞外セルピンは血液凝固(アンチトロンビン)、炎症・免疫反応(アンチトリプシン、アンチキモトリプシン、C1阻害因子)、組織修復(PAI-1)におけるタンパク質分解カスケードを制御する。シグナルカスケードプロテアーゼを阻害することで、セルピンは発生にも影響を与える。ヒトのセルピンの表(下記)はヒトのセルピンの広範な役割や、セルピンの欠損に起因する疾患を示す。
細胞内で阻害効果をもつセルピンは多くの場合、複数の役割を持っているようであり、標的を同定するのは困難であった。さらに、ヒトのセルピンの多くはマウスのような実験動物において適切で機能的な相同分子が存在しない。それでも、細胞内セルピンの重要な役割は細胞内におけるプロテアーゼの不適切な活性を防止することかもしれない。例えば研究が進んでいるヒトの細胞内セルピンの一つがセルピンB9であり、これは細胞毒性を持つ顆粒プロテアーゼ、グランザイムBを阻害する。そうすることでセルピンB9は不慮のグランザイムB9の放出や、時期尚早もしくは望まれない細胞死の経路の活性化を防いでいる可能性がある。
ウイルスの中にはセルピンを用いて宿主のプロテアーゼの機能を妨害するものもある。牛痘ウイルスのセルピン、CrmA(cytokine response modifier A)は感染した宿主細胞が炎症反応やアポトーシスを起こすのを避けるために用いられる。CrmAはシステインプロテアーゼであるカスパーゼ1によるIL-1やIL-18の切断を阻害する事で宿主の炎症反応を抑制し、感染性を増大する。真核生物では植物性のある種のセルピンがメタカスパーゼとパパイン様システインプロテアーゼの両者を阻害する。
非阻害的効果
非阻害的な細胞外セルピンもまた広範かつ重要な役割を持つ。チロキシン結合グロブリンとトランスコルチンはそれぞれチロキシン、コルチゾールを運搬する。非阻害性セルピンであるオボアルブミンは卵白で最も豊富なタンパク質である。オボアルブミンの詳細な機能は知られていないが、胚発生における貯蔵タンパク質と考えられている。ヒートショックタンパク質47はシャペロンでコラーゲンの適切な折りたたみに必須である。このヒートショックタンパク質はコラーゲン折りたたみが行われる小胞体において、コラーゲンの三重らせんを安定化させる働きを持つ。
一部のセルピンはプロテアーゼ阻害機能とそれ以外の機能の両方を持つ。例えば核内システインプロテアーゼ阻害剤であるMENTは、鳥類において赤血球内のクロマチン再構成分子としても働く。
構造
機能が多様であるにもかかわらず、全てのセルピンは構造(あるいは折りたたみ)を共有する。典型的には3つのβシート(それぞれA、B、Cと呼ばれる)と8か9個のαヘリックス(hAからhIまで)を持つ。セルピンの機能においてもっとも重要なのはAシートと反応中心ループ (reactive centre loop, RCL) である。Aシートは'shutter'と呼ばれる領域とその上部にある'breach'と呼ばれる領域を持つ、平行な2つのβストランドを含む。RCLは標的となるプロテアーゼとの初期相互作用を形成する。セルピンの構造が解かれた事で、RCLは完全に露出しているか部分的にAシートに取り込まれていると示され、また、セルピンはこの2つの構造の間で動的平衡をとっていると考えられている。また、RCLはセルピンの他の部位とは一過性の相互作用しか形成しないため、柔軟性が高く、溶媒に露出している。
これまでに決定されてきたセルピンの構造はいくつかの異なった立体構造を含み、このことはセルピンの多段階反応をによる活性を理解するために必要である。そのため、構造生物学はセルピンの機能と性状を理解する上で中心的な役割を担ってきている。
立体構造の変化と阻害機構
阻害型のセルピンは多くの小分子型の阻害剤(例: Kunitz型阻害剤)と違い、鍵と鍵穴の関係に例えられる典型的な競合作用によって標的となるプロテアーゼを阻害する訳ではない。セルピンは競合作用の代わりに珍しい立体構造変化を用い、それによりプロテアーゼの構造を破壊して触媒作用を停止する。立体構造の変化によってRCLはタンパク質分子の反対側へ移動し、シートAへ組み込まれ、追加の逆平行βストランドを形成する。この構造変化によりセルピンは緊張状態 (S) から、熱力学的に安定な弛緩状態 (R) へと転換する(S-R遷移)。
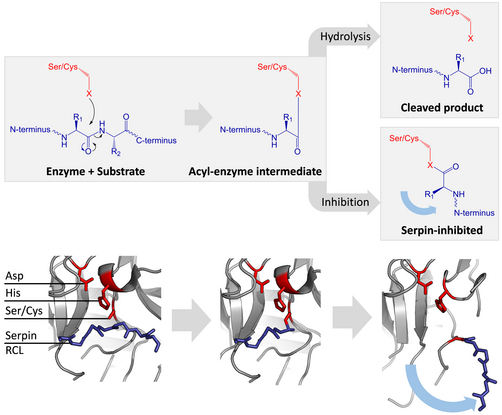
セリンプロテアーゼやシステインプロテアーゼは二段階の行程を踏んでペプチド結合の切断を触媒する。最初に活性部位の三残基の触媒残基が基質のペプチド結合に対して求核攻撃を行う。これにより新たにN末端が露出し、酵素と基質の間に共有結合性のエステル結合が形成される。この共有結合性の酵素基質複合体をアシル-酵素中間体(acyl-enzyme intermediate、アシル酵素複合体とも)と呼ぶ。通常の基質の場合、このエステル結合は加水分解され、新たにC末端が露出して触媒反応が終了する。しかし、セルピンがプロテアーゼによって切断された場合、セルピンはアシル-酵素中間体が加水分解される前に急速にS-R遷移を受ける。立体構造変化の相対的反応速度がプロテアーゼによる加水分解に比べ10の数乗速いという事実によって阻害の効率が決定される。
この段階においてもRCLはプロテアーゼとエステル結合を通して共有結合性にくっついているため、S-R遷移はプロテアーゼをセルピン分子の上から下へ(下図参照)と移動させ、触媒三残基をねじ曲げる。ねじ曲げられたプロテアーゼはアシル酵素中間体を極めて低速にしか加水分解できず、そのためプロテアーゼは数日から数週間に渡りセルピン分子に共有結合性にくっついたままになる。セルピンはこのように一分子のセルピンが一分子のプロテアーゼを永続的に不活化し、一度しか機能しないため、非可逆的阻害剤かつ自殺型阻害剤に分類される。
アロステリック活性化
セルピンの立体構造変化は静的な"鍵と鍵穴"型(競合阻害型)のプロテアーゼ阻害剤に対する重要な利点を与える。さらに、阻害剤型のセルピンの機能は、特異的な補因子とのアロステリックな相互作用によって制御されることがある。アンチトロンビン、ヘパリン補因子II、MENT、およびマウスアンチキモトリプシンのX線結晶構造により、これらのセルピンではRCLの最初の2つのアミノ酸がAシートの頂上部に取り込まれるような立体構造が採用されることが明らかになった。このような、RCLが部分的に本体に取り込まれた立体構造は機能的に重要であり、以上の様なセルピンは補因子と結合すると取り込まれた部位を露出させる様な、プロテアーゼと反応しやすい立体構造への構造の再構成を行う。この立体構造の再構成によりセルピンはより効率的な阻害剤となっている。
補因子による活性化を受けるセルピンの典型的な例はアンチトロンビンであり、この分子は部分的に取り込まれた、相対的に不活性な状態で血漿中を循環している。主要特異性決定基(P1アルギニン)はセルピン分子の本体へ向いているため、プロテアーゼが利用できない。高分子であるヘパリンの内部にある高い親和性を持つペンタサッカライド(五糖)の配列がセルピンに結合すると、アンチトロンビンの立体構造が変化、RCLが反転、P1アルギニンの露出する。こうしてヘパリンのペンタサッカライドと結合したアンチトロンビンはトロンビンと第Xa因子のより効果的な阻害剤となる。さらに、この2つの凝固因子系プロテアーゼ、トロンビンと第Xa因子もまたヘパリンとの結合部位(エキソサイトと呼ばれる)を持つ。そのためヘパリンはプロテアーゼともセルピンとも結合し、両分子の相互作用を劇的に加速する。初期の相互作用の後、セルピンの最終的な複合体の形成が完了し、ヘパリンの部分は放出される。この相互作用は生理的に重要な役割を持つ。例えば、血管壁が損傷を受けると、ヘパリンが露出し、アンチトロンビンが活性化して凝固反応を制御する。この相互作用の分子的原理の理解により、抗凝固薬として使われる合成ヘパリンペンタサッカライドであるフォンダパリヌクスが開発された。
潜在型の立体構造
あるセルピンはプロテアーゼによる切断なしに自然とS-R遷移を行い、潜在型と呼ばれる立体構造をとる。潜在型のセルピンはプロテアーゼと相互作用できず、それ故もはやプロテアーゼ阻害剤として働かない。潜在型への立体構造の変化は、セルピンの切断によって起きるS-R遷移とは異なる。RCLは無傷なため、RCLが完全に組み込まれるためにはCシートの最初のストランドが剥がれなければならない。
潜在型への遷移の調節はPAI-1のようなある種のセルピンの制御機構として働く。PAI-1は阻害剤として働くS型構造として産生されるが、PAI-1は補因子であるビトロネクチンと結合しない限り、潜在型へ移行する事で自動的に不活化される。同様に、アンチトロンビンもまた、ヘパリンによるアロステリック調節以外の予備の調節機構として自然と潜在型へ移行する事がある。また、サーモアナエロバクター属の細菌が持つセルピンであるテングピンのN末端は、テングピンの活性型構造を維持するために必要である。N末端領域による相互作用を遮断することで、このセルピンは自然と潜在型構造へ立体構造を変化させる。
非阻害的機能における立体構造の変化
ある種の非阻害剤型セルピンも立体構造を変化させることでその機能を果たす。例えば、チロキシン結合グロブリンの天然状態であるS型はチロキシンに対し高い親和性を持つが、切断を受けたR型は親和性が低い。同様にトランスコルチンも切断後のR型より天然状態のS型の方がコンチゾールに対する親和性が高い。このようにして、上記のセルピンにおいてはRCLの切断とS-R遷移がプロテアーゼの阻害ではなくリガンドの放出に利用される。
セルピンの中にはS-R遷移が細胞のシグナル伝達を活性化するものもある。この場合、標的プロテアーゼと複合体を形成したセルピン分子が受容体によって認識される。そしてこのセルピン-プロテアーゼ複合体と受容体の結合が、受容体による下流シグナルへと繋がるのである。そのためS-R遷移は細胞にプロテアーゼ活性の存在を警告するために使われる。この事はセルピンが単純にシグナルカスケードに関与するプロテアーゼに影響を与える通常の方法と異なる。
分解
セルピンが標的プロテアーゼを阻害すると、セルピンは永続的に複合体を形成するが、この複合体は後始末を受ける必要がある。細胞外セルピンの場合、最終産物であるセルピン-酵素複合体は循環系から迅速に廃棄される。哺乳類においてこの迅速な除去を行う機構の一つは低密度リポタンパク質受容体関連タンパク質 (LPR) を介したもので、このタンパク質はアンチトロンビン、PAI-1、ニューロセルピン等のセルピンによって形成される複合体と結合し、食作用を誘導する。同様にショウジョウバエのセルピン、ネクロティック (Necrotic) はリポホリン受容体1(哺乳類のLDL受容体ファミリーの相同分子)によって細胞内に運ばれた後、ライソゾーム内で分解される。
疾患とセルピン病
セルピンは広範な生理機能に関与しているため、セルピン分子をコードする遺伝子における変異は様々な疾患の原因となる。セルピンの活性や特異性、凝集特性を変化させるような変異は必ずセルピンの働きに影響する。最も多く認められるセルピン関連疾患はセルピンが多量体を形成して凝集することによるものだが、他にも疾患に結びつく変異がいくつかある。αアンチトリプシン欠損症は特に多い遺伝性疾患である。
不活性や欠損
堅く折りたたまれたセルピンは高エネルギー状態にあるため、変異はセルピンが正しく阻害作用を示す前に、セルピンの立体構造を容易に低エネルギーの立体構造(弛緩型構造や潜在型構造)へと変化させてしまう。
RCLのAシートへの取り込み頻度や範囲に影響する変異は、セルピンがプロテアーゼと接触する前に立体構造のS-R遷移を起こす原因となる。セルピン分子はこの立体構造の変化を一度しか行えないため、結果として生じる不発のセルピン分子は不活性となり、標的プロテアーゼを適切に制御することができなくなる。同様に、単量体の潜在型構造への不適切な遷移を促進する変異も、活性化セルピンの量を減らすため疾患の原因となり得る。例えばアンチトロンビンの疾患関連多型であるwibble型やwobble型は両者とも潜在型構造の形成を促進する。
アンチトリプシンの疾患関連変異 (L55P) は上記以外の不活性構造、「δ型立体構造」の存在を明らかにした。δ型立体構造においてはRCLの4つのアミノ酸が、シートAの頂上部へ取り込まれる。シートAの下部はαヘリックスの一つ、Fヘリックスが部分的にβストランドへ構造変化を起こすことで埋められ、βシートの水素結合を補完する。アンチトリプシン以外のセルピンがこの異性体型をとることができるか、またδ型構造が機能的役割をもつかどうかは明らかでないが、チロキシン結合グロブリンはチロキシンの放出時にδ型構造をとる可能性があると推測されている。非阻害剤型セルピンが変異を起こした場合も疾患の原因となりうる。例えばSERPINF1の変異はヒトのIV型骨形成不全症の原因となる。
本来必要なセルピンが無い場合、通常抑制されているプロテアーゼが過剰に活性化し、セルピン病(セルピノパシー)へと移行する。従ってセルピンの単純な欠損(例:欠損変異)は疾患を生じる。マウスにおいては、セルピンが無い場合の影響からセルピンの通常の機能を実験的に決定するために、遺伝子ノックアウトが用いられる。
特異性の変化
稀にセルピンのRCL内部における1アミノ酸の変化により、セルピンの特異性が変化して、間違ったプロテアーゼを標的としてしまう事がある。例えばアンチトリプシン-ピッツバーグ変異 (M358R) はα1アンチトリプシンの標的をトリプシンからトロンビンに変えてしまい、出血性疾患の原因となる。
多量体化と凝集
ほとんどのセルピン疾患はタンパク質の凝集によるもので、「セルピン病」と呼ばれる。本質的に不安的な構造のため、セルピンは折りたたみ異常を促進する疾患起因変異に対し脆弱である。よく研究されているセルピン病に、家族性の肺気腫や時に肝硬変を引き起こすα1アンチトリプシン欠損症、アンチトロンビン欠損症関連の家族性血栓症、C1阻害剤欠損症による1型および2型の遺伝性血管性浮腫 (HAE)、およびニューロセルピンの封入対形成を伴う家族性脳症(FENIB; ニューロセルピンの多量体形成に起因する稀な認知症)などが含まれる。
セルピン単量体の凝集は不活性の弛緩型立体構造(RCLがAシートに取り込まれた状態)をとる。それゆえ多量体は温度に対し極めて安定で、プロテアーゼを阻害できない。そのためセルピン病は2つの主要原理によって他のタンパク質病(プロテオパチー、例:プリオン病)と似た病理を示す。まず、活性化セルピンの欠失はプロテアーゼの暴走と組織破壊を起こす。次に、超安定多量体自身もセルピンを代謝する小胞体を妨害し、結果的に細胞死と組織損傷を起こす。アンチトリプシン欠損症ではアンチトリプシンの多量体が肝細胞の細胞死を引き起こし、肝臓の破壊と肝硬変の原因となる。細胞内でセルピン多量体は小胞体における分解を受けて徐々に除去される。しかし、セルピン多量体が細胞死を起こす詳細な機構はいまだ完全には理解されていない。
セルピン多量体は、生理的にはドメイン交換現象によって生じると考えられている。この現象においてはセルピン分子の一部分が他のセルピン分子に取り込まれる。ドメイン交換は変異や環境因子がセルピンが天然状態の構造へと折りたたまれる行程における最終段階を妨害し、高エネルギー中間体の折りたたみ異常を起こす事で発生する。これまでに二量体と三量体の両者についてドメイン交換構造が解かれてきた。まず、(アンチトロンビンの)二量体においてはRCLとAシートの一部が他方のセルピン分子に組み込まれる。一方、(アンチトリプシンの)ドメイン交換型三量体は二量体とは全く異なり、Bシートの交換によって多量体が形成され、各分子中のRCLは自身のAシートに取り込まれる。また、セルピンがRCLを他方のAシートに挿入することでドメイン交換構造を形成する可能性(Aシート多量体化)も提案されている。以上のようなドメイン交換により生じる二量体構造や三量体構造は疾患関連多量体凝集の塊を作ると考えられているが、正確な原理は未だ明らかでない。
治療戦略
最も普遍的なセルピン病、アンチトリプシン欠損症の治療のために、いくつかの治療方針が実用、あるいは研究されている。アンチトリプシン増強療法は重度のアンチトリプシン欠損症関連肺気腫に適用される。最初にProlastinとして市販されたこの治療薬は、アンチトリプシンをドナーの血漿から精製したもので、経静脈投与により使用される。また、重度のアンチトリプシン関連疾患においては肺と肝臓の移植が効果的であると証明されている。動物実験ではiPS細胞に対する遺伝子療法がアンチトリプシン多量体形成による欠乏を改善し、肝臓による活性アンチトリプシンの産生能を回復する事に成功している。他にin vitroでアンチトリプシン多量体形成を遮断する小分子の開発が行われている。
進化
セルピンはプロテアーゼ阻害剤の中で最も普遍的でかつ最大のスーパーファミリーである。最初は真核生物のみが持つものと信じられていたが、後に細菌、古細菌、さらにある種のウイルスからも発見されている。ただし、原核生物のセルピン遺伝子が祖先から受け継がれたものか、それとも真核生物から水平伝播によって獲得されたものなのかは明らかでない。植物性のものも動物性のものも、ほとんどの細胞内セルピンは系統学的に単一クレードに属することから、細胞内セルピンと細胞外セルピンは植物と動物の分岐の後に分化した可能性がある。例外の一つに細胞内ヒートショックタンパク質であるHSP47があり、この分子はコラーゲンの適切な折りたたみに必須のシャペロンで、シス-ゴルジ体と小胞体間を循環する。
プロテアーゼ阻害作用は古来から伝わる機能で、非阻害型のセルピンは進化学的な新機能獲得の結果と考えられている。S-R立体構造遷移は結合型セルピンの標的に対する親和性を調節するように適合した。
分布
動物のセルピン
哺乳類
ヒト
ヒトのゲノムは16のセルピン分子のクレードをコードし、それぞれserpinAからserpinPまでの命名がされている16のクレードは29個の阻害型セルピンと7個の非阻害型セルピンを含む。ヒトのセルピンは2001年から500個のセルピンの系統解析に基づいた命名系を持ち、例えばserpinXYというタンパク質はXクレードでY番目に命名されたタンパク質である事を意味する。ヒトのセルピンの機能は生化学的研究、ヒトの遺伝性疾患、およびノックアウトマウスの実験系の知見を統合することで決定された。
| 遺伝子名 | 一般名 | 局在 | 機能 / 活性 | 欠損動物の表現型 | ヒトの関連疾患 | 染色体上の位置 | タンパク質構造 |
|---|---|---|---|---|---|---|---|
| SERPINA1 | α1アンチトリプシン | 細胞外 | ヒト好中球エラスターゼの阻害剤。切断を受けたSERPINA1のC末端断片はHIV-1の感染を防ぐかもしれない。 | 欠損は肺気腫を、多量体形成は肝硬変を引き起こす(セルピン病)。 | 14q32.1 | 1QLP, 7API, 1D5S | |
| SERPINA2 | アンチトリプシン関連タンパク質 | 細胞外 | 偽遺伝子の可能性あり。 | 14q32.1 | |||
| SERPINA3 | α1アンチキモトリプシン | 細胞外 | カテプシンGの阻害剤。肝細胞においては染色体凝縮の役割も。 | 調節異常はアルツハイマー病の原因(セルピン病)。 | 14q32.1 | 1YXA, 2ACH | |
| SERPINA4 | キリスタチン | 細胞外 | カリクレイン阻害剤で血管の機能を調節。 | 高血圧ラットにおける欠損は腎臓や心血管系の損傷を悪化させる。 | 14q32.1 | ||
| SERPINA5 | プロテインC阻害剤 | 細胞外 | 活性化プロテインCの阻害剤。細胞内で細菌の食作用を防止する役割。 | オスのマウスでのノックアウトは不妊を起因する。多発性硬化症においては慢性活動性脱髄巣内に集積。 | 14q32.1 | 2OL2, 3B9F | |
| SERPINA6 | トランスコルチン | 細胞外 | 非阻害剤。コルチゾールと結合。 | 欠損は慢性疲労と関連。 | 14q32.1 | 2V6D, 2VDX, 2VDY | |
| SERPINA7 | チロキシン結合グロブリン | 細胞外 | 非阻害剤。チロキシンと結合。 | 欠損は低チロキシン症の原因。 | Xq22.2 | 2CEO, 2RIV, 2RIW | |
| SERPINA8 | アンギオテンシノーゲン | 細胞外 | 非阻害剤で、レニンよって切断される事でアンギオテンシンIを生じる。 | マウスのノックアウトは低血圧を生じる。 | 変異は低血圧と関連。 | 1q42-q43 | 2X0B, 2WXW, 2WXX, 2WXY, 2WXZ, 2WY0, 2WY1 |
| SERPINA9 | センテリン / GCET1 | 細胞外 | 阻害剤でナイーブB細胞を管理。 | 多くのB細胞性リンパ腫で発現量増加。 | 14q32.1 | ||
| SERPINA10 | プロテインZ関連プロテイナーゼ阻害剤 | 細胞外 | プロテインZと結合して第Xa因子と第XI因子を不活化。 | 14q32.1 | 3F1S, 3H5C | ||
| SERPINA11 | – | おそらく細胞外 | 不明 | 14q32.13 | |||
| SERPINA12 | バスピン | 細胞外 | カリクレイン7の阻害剤。インシュリン感作性アディポサイトカイン。 | 血漿中の高濃度バスピンは2型糖尿病と関連。 | 14q32.1 | 4IF8 | |
| SERPINA13 | – | おそらく細胞外 | 不明 | 14q32 | |||
| SERPINB1 | 単球好中球エラスターゼ阻害剤 | 細胞内 | 好中球エラスターゼの阻害剤。 | マウスでのノックアウトは好中球の生存率低下と免疫不全を起因する。 | 6p25 | 1HLE | |
| SERPINB2 | プラスミノーゲン活性化因子阻害剤 | 細胞内 / 細胞外 | 細胞外uPA の阻害剤。細胞内の機能は不明だがウイルス感染を防ぐ可能性がある。 | マウスでの欠損により線虫に体する免疫応答が低下。マウスでのノックアウトは何の表現型も示さない。 | 18q21.3 | 1BY7 | |
| SERPINB3 | SCCA-1 | 細胞内 | パパイン様システインプロテアーゼとカテプシンK、L、Sの阻害剤。 | マウスにおけるSerpinb3a(ヒトのSERPINB3およびSERPINB4両者のホモログ)の欠損は、気管支喘息の実験モデルで粘液産生を減少させる | 18q21.3 | 2ZV6 | |
| SERPINB4 | SCCA-2 | 細胞内 | キモトリプシン様セリンプロテアーゼであるカテプシンGおよびキマーゼの阻害剤。 | マウスにおけるSerpinb3a(ヒトのSERPINB3およびSERPINB4両者のホモログ)の欠損は、気管支喘息の実験モデルで粘液産生を減少させる | 18q21.3 | ||
| SERPINB5 | マスピン | 細胞内 | 非阻害剤、機能不明 (マスピンも参照)。 | 当初マウスでのノックアウトは致死性と報告されたが、その後何の表現型も示さない事が示された。マスピンの発現は近傍のがん抑制遺伝子(脱リン酸化酵素PHLPP1)の発現を反映する予後指標になるかもしれない。 | 18q21.3 | 1WZ9 | |
| SERPINB6 | PI-6 | 細胞内 | カテプシンGの阻害剤。 | マウスでのノックアウトは聴覚喪失および軽度の好中球減少症を起因。 | 欠損は聴覚欠損と関連。 | 6p25 | |
| SERPINB7 | メグシン | 細胞内 | 巨核球の成熟に関与。 | マウスでの過剰発現は腎臓病を起因。マウスでのノックアウトは組織学的な異常を来さない。 | 変異は長島型掌蹠角皮症と関連。 | 18q21.3 | |
| SERPINB8 | PI-8 | 細胞内 | フーリンの阻害剤かもしれない。 | 18q21.3 | |||
| SERPINB9 | PI-9 | 細胞内 | 細胞毒性顆粒プロテアーゼであるグランザイムBの阻害剤。 | マウスでのノックアウトは免疫不全を起因。 | 6p25 | ||
| SERPINB10 | ボマピン | 細胞内 | 不明 | マウスでのノックアウトは何の表現型も示さない(C57/BL6; 実験動物 BC069938)。 | 18q21.3 | ||
| SERPINB11 | 細胞内 | 不明 | ネズミのSerpinb11は活性を持つ阻害剤だがヒトの相同分子は不活性である。ポニーでの欠損は蹄壁分離病と関連。 | 18q21.3 | |||
| SERPINB12 | ユコピン | 細胞内 | 不明 | 18q21.3 | |||
| SERPINB13 | フルピン/ ヘッドピン | 細胞内 | パパイン様システインプロテアーゼの阻害剤。 | 18q21.3 | |||
| SERPINC1 | アンチトロンビン | 細胞外 | 凝固因子の阻害剤で、特に第X因子、第IX因子、およびトロンピンに対して働く。 | マウスでのノックアウトは致死性。 | 欠損により血栓症や他の凝固異常に(セルピン病)。 | 1q23-q21 | 2ANT, 2ZNH, 1AZX, 1TB6, 2GD4, 1T1F |
| SERPIND1 | ヘパリン補因子II | 細胞外 | トロンビンの阻害剤。 | マウスでのノックアウトは致死性。 | 22q11 | 1JMJ, 1JMO | |
| SERPINE1 | プラスミノーゲン活性化因子阻害剤1 | 細胞外 | トロンビン、uPA、TPaの阻害剤。 | 7q21.3-q22 | 1DVN, 1OC0 | ||
| SERPINE2 | グリア由来ネキシン / プロテアーゼネキシンI | 細胞外 | uPA、TPaの阻害剤。 | 異常発現によりオスの不妊に繋がる。ノックアウトはてんかんを起因 | 2q33-q35 | 4DY0 | |
| SERPINF1 | PEDF | 細胞外 | 非阻害剤、血管新生阻害分子の可能性あり。PEDFはグリコサミノグリカンであるヒアルロナンと結合する事が報告されている。 | マウスでのノックアウトは血管系や、膵臓と前立腺の質量に影響。成体におけるNotch依存的脳室神経幹細胞による神経新生を促進。ヒトでの変異はVI型骨形成不全症を起こす。 | 17p13.3 | 1IMV | |
| SERPINF2 | α2アンチプラスミン | 細胞外 | プラスミン阻害剤で線維素溶解を阻害。 | マウスでのノックアウトは線維素溶解を増強するが、繁殖障害は示さない。 | 欠損により稀な出血異常を起こす。 | 17pter-p12 | 2R9Y |
| SERPING1 | C1阻害剤 | 細胞外 | C1エラスターゼの阻害剤。 | 特定の変異が加齢黄斑変性や遺伝性血管性浮腫と関連。 | 11q11-q13.1 | 2OAY | |
| SERPINH1 | HSP47 | 細胞内 | 非阻害剤、コラーゲンの折りたたみにおける分子シャペロン。 | マウスでのノックアウトは致死性。 | ヒトでの変異は重度の骨形成不全症を起因。 | 11p15 | 4AXY |
| SERPINI1 | ニューロセルピン | 細胞外 | tPA、uPA、およびプラスミンの阻害剤。 | 変異はFENIB認知症を起因(セルピン病)。 | 3q26 | 1JJO, 3FGQ, 3F5N, 3F02 | |
| SERPINI2 | パンクピン | 細胞外 | 不明 | マウスでの欠損は腺房中心細胞の減少を通じた膵臓の機能不全を起因。 | 3q26 |
特定の哺乳類のセルピン
哺乳類のセルピンの多くは、ヒトのセルピンと何の相同性も持たない事が明らかにされてきた。多数の齧歯類のセルピン(特にネズミが持つ細胞内セルピン一部)や子宮セルピンが例として挙げられよう。子宮セルピンはSERPINA14遺伝子によってコードされるAクレードに属するセルピンである。子宮セルピンはローラシアテリアの哺乳類の内、一部の動物種の子宮内膜がプロゲステロンないしエストロゲンの影響下で産生する。おそらく、子宮セルピンは機能的なプロテアーゼ阻害剤ではなく、妊娠期の胚、胎児に対する母体の免疫応答を阻害したり、胎盤を介した輸送に関与したりする機能を持っているのだろう。
昆虫
キイロショウジョウバエのゲノムは29のセルピン遺伝子を持つ。アミノ酸配列の解析から14のセルピンがクレードQに、3つがクレードKに分類されているが、残りの12は孤立しており、特定のクレードに分類されていない。クレード分類体系をショウジョウバエのセルピンに対して用いるのは難しく、代わりにショウジョウバエの染色体上の位置に基づく、専門的な命名体系が適用されている。ショウジョウバエのセルピン遺伝子のうち13はゲノム上に孤立して存在している(Serpin-27Aを含む。下記参照。)。一方で残りの16は5つのクラスターを形成し、それぞれ染色体28D(2個)、42D(5個)、43A(4個)、77B(3個)、88E(2個)上に位置する。
ショウジョウバエセルピンの研究によりSerpin-27AがEasterプロテアーゼ(タンパク質分解カスケードの最終段階を担う)を阻害し、背腹軸形成を制御する事が明らかになった。EasterプロテアーゼはSpätzle(ケモカイン型リガンド)を切断する機能を持ち、Spätzleの切断はtoll依存性のシグナル伝達に繋がる。パターン形成における中心的な役割と共に、tollのシグナル伝達系は昆虫の自然免疫応答においても重要である。よってserpin-A27は昆虫の免疫応答を制御する機能も持つ。巨大な甲虫であるTenebrio molitorにおいてはあるタンパク質 (SPN93) が、セルピン全体をドメインとする構造を二重に持ち、tollのタンパク質分解カスケードを調節している。
線虫
線虫の一種、C. elegansのゲノムはセルピンを9つ持ち、全てがシグナル配列を欠くため細胞内タンパク質のようである。しかし、9つの内、プロテアーゼ阻害剤として働くのはわずか5つのであろう。プロテアーゼ阻害機能を持つセルピンの一つ、SPR-6は防御機能を持ち、ストレス性のカルパイン関連リソソーム崩壊から虫体を守る。さらにSRP-6は破裂したリソソームから放出されるシステインプロテアーゼを阻害する。そのため、SRP-6欠損線虫はストレスに対して感受性である。SRP-6の欠損線虫が水中で死んでしまう(低浸透圧ストレス致死性表現型)点は特に重要である。そのためリソソームが細胞の運命を決定する上で一般的で制御可能な役割を持つと言われてきている。
植物のセルピン
植物のセルピンは哺乳類のキモトリプシン様セリンプロテアーゼをin vitroで阻害できる事があり、大麦セルピンZx (BSZx) がその代表例である。このタンパク質はヒトのトリプシン、キモトリプシン、そして数種の凝固因子を阻害する事ができる。しかしながらキモトリプシン様セリンプロテアーゼに近縁なタンパク質は植物に存在しない。小麦やライ麦のセルピンのRCLは胚乳のプロラミン貯蔵タンパク質で見られるようなポリQの繰り返し配列を含む。そのため植物のセルピンは、貯蔵タンパク質を消化してしまう、昆虫や微生物のプロテアーゼを阻害する働きを持つ可能性が指摘されている。この仮説を支持する知見として、独特な植物セルピンがカボチャ (CmPS-1) とキュウリの師管液から同定された。CmPS-1の発現量増加とアブラムシの生存率の間には負の相関が観察されるが、試験管内で給餌する実験系においては組換えCmPS-1は昆虫の生存に影響しないようである。
植物セルピンの他の役割と標的プロテアーゼも提案されてきた。シロイヌナズナ属のセルピン、AtSerpin1 (At1g47710; 3LE2) はパパイン様システインプロテアーゼである'Responsive to Desiccation-21' (RD21) を標的とすることでプログラム細胞死における設定値の調節を行っている。AtSerpin1はまたin vitroでメタカスパーゼ様プロテアーゼに対しても阻害効果を持つ。他にもAtSRP2 (At2g14540) とAtSRP3 (At1g64030) がDNA損傷への応答に関わるようである。
真菌のセルピン
これまでに機能が明らかにされた真菌のセルピンは一つのみである。ネオカリマスティクス科Piromyces spp. E2株から発見されたセルピン (celpin) である。Piromycesは反芻動物の腸に生息する、植物の代謝に重要な嫌気性真菌の属名である。セルピン (celpin) は阻害機能を持ち、セルピンの構造の他にさらにN末端にドックリンドメインを2つを持つと予想される。ドックリンは、セルロースを分解する巨大細胞外タンパク質複合体である、真菌のセルロソームに内在するタンパク質が普遍的に持つ構造である。そのためセルピン (celpin) はセルロソームを植物のプロテアーゼから保護していると考えられている。ある種の細菌のセルピンも同様にセルロソームに内在している。
原核生物のセルピン
予想セルピン遺伝子は原核生物の種の間で散発的に分布している。In vitroの研究は原核生物のセルピンがプロテアーゼを阻害できる事を明らかにしており、これらの分子がin vivoでも同様の機能を持つことを示唆している。原核生物のセルピンは極限環境微生物からも発見されている。哺乳類のセルピンと対照的に、極限環境微生物から同定されるセルピンは熱分解に高い抵抗性を示す。細菌のセルピンの正確な役割は未だ不明だが、Clostridium thermocellumのセルピンはセルロソーム内に存在する。セルロソーム関連セルピンに関してはセルロソームを対象とした不適切なプロテアーゼの働きを防止している可能性が指摘されている。
ウイルスのセルピン
ウイルスもまた、宿主の免疫系による防御を回避するためにセルピンを発現する。特に、牛痘ウイルス(ワクシニアウイルス)や兎粘液腫ウイルス(ミクソーマウイルス)を含むポックスウイルスが発現するセルピンは、自己免疫疾患や炎症性疾患、さらに移植療法における新規治療戦略となる可能性があるために興味深いものとなっている。Serp1はTLR依存的自然免疫反応を抑制し、ラットの実験において同種心臓移植後の無期限の生存期間を可能にする。CrmaとSerp2はクラス横断型阻害剤で、いずれもセリンプロテアーゼ(グランザイムB;効果は微弱)とシステインプロテアーゼ(カスパーゼ1とカスパーゼ8)の両者を標的とする。哺乳類の相同分子と比較するとウイルスのセルピンは二次構造を明らかに欠損している。特にcrmAはAヘリックスおよびEヘリックスの大半とDヘリックスを欠いている。
外部リンク
- 蛋白質構造データバンク 今月の分子53:セルピン(Serpins)
- Merops protease inhibitor claudication (Family I4)
- Serpins - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- James Whisstock laboratory モナシュ大学
- Jim Huntington laboratory ケンブリッジ大学
- Frank Church laboratory ノースカロライナ大学チャペルヒル校
- Paul Declerck laboratory ルーヴェン・カトリック大学
- Tom Roberts laboratory シドニー大学
- Robert Fluhr laboratory ワイツマン科学研究所
- Peter Gettins laboratory イリノイ大学シカゴ校
- 血液中のセリンプロテイナーゼインヒビター・スーパファミリー