
タゼメトスタット
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Tazverik |
| Drugs.com | monograph |
| MedlinePlus | a620018 |
| ライセンス | US Daily Med:リンク |
| 法的規制 |
|
| 識別 | |
|
CAS番号 |
1403254-99-8 |
| ATCコード | None |
| PubChem | CID: 66558664 |
| DrugBank | DB12887 |
| ChemSpider | 30208713 |
| UNII | Q40W93WPE1 |
| KEGG | D11485 |
| ChEMBL | CHEMBL3414621 |
| 別名 | EPZ-6438 |
| 化学的データ | |
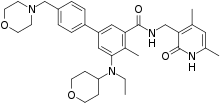
| 化学式 | C34H44N4O4 |
| 分子量 | 572.75 g·mol−1 |
| |
| |
タゼメトスタット(Tazemetostat)は、完全切除の対象とならない、転移性または局所進行性の上皮性肉腫を持つ16歳以上の成人および青年の治療に使用される抗がん剤である。
最も一般的な副作用は、痛み、疲労、吐き気、食欲不振、嘔吐、便秘である。
タゼメトスタットを服用している患者は、以下の様な二次悪性腫瘍を発症するリスクが高くなる。
効能・効果
- 再発または難治性のEZH2 遺伝子変異陽性の濾胞性リンパ腫(標準的な治療が困難な場合に限る)
副作用
添付文書に記載されている重大な副作用は、
- 骨髄抑制
- 感染症(30.6%)
- 肺炎、ニューモシスチス肺炎、異型肺炎、肺感染(各1.6%)等
である。
15%以上に、悪心(16.1%)、味覚異常(24.2%)、脱毛症(19.4%)が発生する。
相互作用
タゼメトスタットは主に肝臓のCYP3A4で代謝され、CYP3A4を誘導する。また、CYP2C8を阻害する。
作用機序
タゼメトスタットは、強力な選択的EZH2阻害剤として作用する抗がん剤である。タゼメトスタットは、EZH2(メチル基転移酵素の一種)の活性を阻害する事で、がん細胞の増殖を抑える事が出来る。上皮性肉腫の殆どの症例は、四肢の皮下の軟部組織から始まるが、身体の他の部位で始まる事もあり得る。がんが身体の一部分に限局している場合は、外科的な除去が主な治療法と考えられる。また、化学療法や放射線療法が行われる事もある。しかし、治療を行っても局所進行または転移する可能性が高く、診断時には約50%の患者が転移性疾患を有している。転移性疾患は、患者の生命を脅かすものと考えられる。
NCI Drug Dictionaryによると、タゼメトスタットは、経口投与可能な低分子の選択的S-アデノシルメチオニン(SAM)競合的EZH2阻害剤であり、抗腫瘍活性が期待される。EZH2は、ヒストンメチル基転移酵素(HMT)の一種であり、様々ながん細胞で過剰発現または変異しており、腫瘍細胞の増殖に重要な役割を果たしている。タゼメトスタットは、経口投与で、野生型および変異型のEZH2の活性を選択的に阻害する。EZH2を阻害すると、ヒストンH3のリジン27(H3K27)のメチル化が特異的に阻害され、EZH2変異型のがん細胞では、がん経路に関連する遺伝子の発現パターンが変化し、腫瘍細胞の増殖が抑制される。
米国食品医薬品局(FDA)では、画期的医薬品と位置付けられている。
臨床試験
FDAは、転移性または局所進行性の上皮性肉腫の被験者62名を対象とした臨床試験(NCT02601950)の結果に基づき、2020年1月にタゼメトスタットを承認した。本臨床試験では、被験者は、病状が進行するか、許容出来ないレベルの毒性を示す迄、タゼメトスタット800mgを1日2回投与された。本試験では、8週間毎に腫瘍の反応が評価され、治療中に腫瘍が完全または部分的に縮小した被験者の数(全奏効率)が計算された。全奏効率は15%で、完全奏功は1.6%、部分奏功は13%であった。奏効した9名のうち、6名(67%)の被験者が6ヵ月以上の奏効を示した。
本試験は、フランス、英国、台湾、イタリア、カナダ、ベルギー、米国の22施設で実施された。
FDAは、タゼメトスタットの迅速承認および希少疾病用医薬品指定の申請を認可し、2020年1月に販売承認した。
日本では第I相臨床試験が2017年1月に開始され、国内第II相臨床試験でEZH2 遺伝子変異陽性濾胞性リンパ腫での有効性と安全性が確認され、2020年7月に承認申請され、2021年6月に承認された。
注釈
参考資料
外部リンク
- “Tazemetostat”. Drug Information Portal. U.S. National Library of Medicine. 2021年10月8日閲覧。