ニコチン作動薬

ニコチン作動薬(Nicotinic agonist)とは、ニコチン性アセチルコリン受容体(nAChR)におけるアセチルコリン(ACh)の作用を模倣した薬剤である。nAChRは、ニコチンに親和性があることから名付けられた。例として、ニコチンの他、アセチルコリン(内因性作動物質)、コリン、エピバチジン、ロベリン、バレニクリン、シチシンなどがある。
歴史
ニコチンは何世紀にもわたってその中毒性が知られている。1828年に初めてタバコから単離された。
ニコチンが動物の記憶に良い影響を与えることが発見されたのは、1980年代半ばに行われたin vivo の研究によるものであった。これらの研究は、ニコチン性アセチルコリン受容体(nAChR)とその刺激に関する研究に新たな時代をもたらしたが、それまでは主にニコチン中毒に焦点が当てられていた。nAChR作動薬の開発は、ニコチンのポジティブな作用が発見された後、1990年代初頭に始まった。前臨床研究では、治療法の可能性を示す研究もあった。ABT-418は、合成nAChR作動薬の最初の1つであり、異なる種および性別の成熟したマカクサルにおいて、遅延見本合わせ(delayed matching-to-sample;DMTS)の成績を有意に向上させた。またABT-418は、アルツハイマー病、パーキンソン病、注意欠陥多動性障害の治療薬としても検討されており、これらの実験では良好な結果が得られている。
ガランタミンは、植物性アルカロイドで、弱いコリンエステラーゼ阻害薬(IC50=5μM)とnAChRのアロステリック増感剤(EC50=50nM)の働きをする化合物である。
ニコチン受容体と信号伝達

信号伝達系
ヒトの神経系では、ニコチン性コリン作動性シグナルが全身に張り巡らされており、神経伝達物質であるアセチルコリン(ACh)がリガンド依存性イオンチャネルの活性化に重要な役割を果たしている。コリン作動性システムは重要な神経経路であり、コリン作動性ニューロンが神経伝達物質AChを合成、貯蔵、放出する。AChのメッセージを変換する主な受容体は、コリン性のムスカリン性アセチルコリン受容体(mAChR)と、神経性および筋肉性のnAChRである。進化の歴史を振り返ると、AChは最も古い伝達分子と考えられており、神経細胞のシナプス前に存在するようになった。神経系では、nAChRを介したコリン性刺激が伝達物質の放出や細胞の感受性などの経路を制御し、睡眠、不安、痛みの処理、認知機能などの生理的活動に影響を与えている。
ニコチン受容体
nAChRは、中枢神経系(CNS)、末梢神経系(PNS)、骨格筋などに存在するコリン作動性受容体で、アセチルコリンなどの分子が結合するリガンド依存性イオンチャネルである。AChなどの作動薬が受容体に結合すると、イオンチャネルの開状態が安定し、カリウムイオン、カルシウムイオン、ナトリウムイオンなどの陽イオンが流入する。nAChRは、αサブユニット(α1~α10)、βサブユニット(β1~β4)、1つのδサブユニット、1つのγサブユニット、1つのεサブユニットなど、受容体の四次構造を決定するさまざまなサブユニットによって構成されている。nAChRには、ヘテロマーであるものとホモマーであるものがある。中枢神経系で見られるヘテロマー受容体は、2つのαサブユニットと3つのβサブユニットで構成され、結合部位はαと隣接するサブユニットの界面にある。これらの受容体には1つの受容体につき2つの結合部位があり、サブユニットの構成に応じて化学物質に対する親和性が異なる。両方の結合部位は一緒に働くので、チャネルの活性化が起こるためには、両方の部位がnAChR作動薬によって占有される必要がある。α2~α6サブユニットとβ2~β4サブユニットを含むnAChRは、他の受容体に比べてAChに対する高い親和性を持つことが示されている。同一のサブユニットを5つ持つホモマー受容体は、隣接する2つのサブユニットの界面に5つの結合部位を持つ。2000年には、α7受容体とα8受容体という2つのホモマー受容体がヒトで同定されている。
結合部位
ヘテロマーnAChRには2つの結合部位があり、nAChRの開放型を安定させるためには、ニコチンやAChなどの作動薬によって両方の結合部位が占有される必要がある。nAChRのACh結合部位は、A~Fと呼ばれる6つのループで構成されている。結合部位のA、B、Cループは、αサブユニットの一部であり、結合部位の主要な構成要素である。αサブユニットに隣接するサブユニット(γ、δ、ε、β)には、D、E、Fのループが存在する。
受容体の構造
α4β2受容体
中枢神経系に存在するα4β2受容体は、2つのα4サブユニットと3つのβ2サブユニットから構成されており((α4)2(β2)3)、AChなどの作動薬に対して2つの結合部位を持つ。α4β2受容体は、ヒトの脳内nAChRの約90%を占めており、ニコチンや他のニコチン作動薬に慢性的に暴露されると、他の受容体が作動薬に慢性的に暴露される場合とは逆に、α4β2受容体の密度が増加する。α4β2受容体は、アルツハイマー病やニコチン依存症について広く研究されており、2009年にはα4β2受容体を特異的に標的とする幾つかの薬剤が発売されている。
α7受容体
中枢神経系には他にα7受容体が存在する。α7受容体は、5つのα7サブユニットからなる((α7)5)ホモマー神経性アセチルコリン受容体で、5つのACh結合部位を持つ。α7受容体の発現異常は、アルツハイマー病や統合失調症などの疾患の進行に影響を及ぼすことが報告されている。α7受容体は、ヘテロマー受容体ほどニコチンに親和性がないと考えられているが、代わりに、一部のヘビ毒に含まれるニコチン拮抗薬であるα-ブンガロトキシンに親和性があることが知られている。そのため、α7受容体を標的とした治療は、アルツハイマー病や統合失調症の治療に有効であると考えられている。
筋肉型受容体
nAChRは、骨格筋の神経筋接合部にも存在する。筋肉型nAChRには2つの異なる受容体が存在し、1つは主に成人で発見されたもので、2つのα1サブユニット、1つのβ1サブユニット、1つのεサブユニット、1つのδサブユニットを含み((α1)2β1δε)、もう1つは胎児で発見されたもので、εサブユニットの代わりにγサブユニットを含む((α1)2β1δγ)。nAChRは、陽イオンの透過性を高めることで筋終板の脱分極に関与し、骨格筋の収縮をもたらす。骨格筋に存在するnAChRには2つのACh結合部位があり、1つはα1サブユニットとδサブユニットの界面に、もう1つはα1サブユニットとγサブユニットまたはεサブユニットの界面に存在している。神経筋系に特化して設計されたnAChR遮断薬の中には、人間や他の動物・昆虫を素早く殺すために設計された神経ガスやその他の毒物がある。
自律神経節受容体
自律神経節や副腎髄質には、α3β4受容体((α3)2(β4)3)が存在する。活性化されると、主にNa+やK+の透過性が高まることで、シナプス前・シナプス後の興奮をもたらす。
アセチルコリンの結合による受容体の構造変化
AChがnAChRに結合するのは、分子と受容体表面の間の電荷差によるものである。AChはnAChRに結合すると、αサブユニットとその隣のサブユニットに属するループA、B、Cで形成される結合ポケットに収まる。AChが結合ポケットに収まると、nAChRのループが移動し、ACh分子がポケット内で配位して、分子と受容体の間の化学結合が強化される。αサブユニットに属するループが移動した後、ACh分子が隣接するサブユニットと塩橋などの結合を形成することで、受容体とAChの結合がさらに強化される。
医薬品設計
nAChRに影響を与える薬物には、作動薬、部分作動薬、遮断薬がある。ニコチンなどの作動薬は、nAChRに暫くの間(濃度やnAChRサブタイプによって数秒から数分)接触すると脱分極剤として作用するが、作動薬に慢性的に接触すると、急速かつ持続的な脱感作が起こり、長期的な機能停止に陥ることもある。部分的nAChR作動薬は、禁煙に役立つと思われるので研究されている。部分作動薬は、nAChRに結合し、作動薬よりも少量のドーパミンの放出を刺激することで、ニコチンの不在を補うと考えられている。ニコチン作動薬の中には、特異性がないものがあることはよく知られており、nAChRの特定のサブタイプを標的とする必要がある病気の治療に使用する際に問題となる可能性がある。これらの非特異的な作動薬には、例えばアセチルコリン、ニコチン、エピバチジンなどがあり、いずれも複数のサブタイプのnAChRを標的としている。
医薬品分子の特徴
nAChR作動薬の構造的特徴の研究は1970年に始まり、作動薬の受容体への結合は、アセチルコリンの場合は正に帯電した窒素原子とカルボニル酸素原子から形成される水素結合、(S)-ニコチンの場合は窒素原子から形成される水素結合に依存することが提案された。その後、(S)-ニコチンのピリジン環の中心と同様に、陽イオン性の中心、電気陰性で水素結合を形成できる原子が好ましいことが判ってきた。立体化学は構造的特徴の一部であり、(S)-ニコチンと(R)-ニコチンでは、(S)-エナンチオマーの方が10~100倍強力であることが明らかになっている。エピバチジンのアザビシクロ環は、受容体に対する有利な立体的相互作用のもう一つの例である。作動薬の親和性には、特定の窒素間距離(N+-N)が重要であることが示唆されているが、その影響については議論がある。新しい説では、プロトン付化した窒素原子と水素結合受容部位を補完する点の間の距離が0.7~0.8nmであれば、効力が高まるとされている。ピリジン環を持つプロトン化されたニコチンリガンドでは、プロトン付化した窒素に近い所では電荷密度が低く、ピリジン環に近い所では電子密度が高いことが好ましいとされている。その後、ニコチン依存症やアルツハイマー病などの認知機能障害の治療薬開発において、α7サブタイプやα4β2サブタイプの受容体に注目が集まっている。
構造活性相関
筋肉型受容体作動薬の場合
nAChR作動薬の受容体サブタイプに対する親和性を検証するために、さまざまなモデルを用いて、親和性を高めるのに不可欠な分子、置換基、立体構造を特定することができる。nAChR筋受容体サブタイプ (α1)2β1δγ モデルを用いて、以下の結果が得られた。
アナトキシンが最も高い活性効果を示し、ロベリンが最も低い活性効果を示した。一方、アセチルコリンは、アナトキシンより活性が弱いにも拘わらず、遥かに長い受容体の開口時間を誘導した。この結果は、アナトキシン誘導体が筋肉のnAChRの構造活性相関(structure-activity relationship;SAR)の理解に役立つことを示唆している。
既に発売されている医薬品である塩化スキサメトニウムは、ビスコリンエステルであり、短時間作用型の筋弛緩剤である。ビスコリンエステルは、筋肉型nAChRに対して競合的な作動薬として作用する化合物で、SAR研究にも用いられてる。シビレエイ (α1)2β1δγ nAChRモデルでは、ビスコリンエステルの作動薬の効力は鎖の長さに依存し、鎖が長いほど効力が増すことが示された。有効性は、CH2単位が4〜7個のビスコリンエステルで最も高くなり、CH2単位が少なくても多くても低くなる。
α4β2受容体作動薬の場合
AChとニコチンの構造要素を組み合わせると共に、シクロプロパン環を用いて立体配座の柔軟性を低下させることにより、強力かつ選択的なα4β2 nAChRリガンドが発見された。連結基(linker)、アミノ基への置換、ピリジン環という3つの構造要素を調節することで、リガンドの効力や選択性に与える影響を調べることができる。結合力を低下させる要因は、アミノ基の立体障害と、飽和/不飽和の炭素鎖リンカーである。短鎖のエーテルリンカーが好ましい。ピリジン環をハロゲンなどで一置換、二置換すると、結合力が向上する。アミノ基を3つの異なるアミドで置換すると、結合親和性が高まり、メチルアミドが最も高い結合力を示す。他の置換アミドの結合力が低いのは、立体障害やメチル基の欠如により疎水性相互作用が失われたためと説明された。ピリジン窒素やピリジン環の立体効果は、α4β2 nAChRへの結合に微妙に有益な影響を与える。その結果、ピリジンにブロモ基を付加し、アミノ基をメチル化アミドで置換したピリジルエーテルリガンドが最も高い効力を持つことが示された。
α7受容体作動薬の場合
選択的で強力なα7 nAChR作動薬の探索により,医薬品候補として有望な一連の化合物が得られている。SEN12333/WAY-317538は、α1、α3、α4β2 nAChRよりもα7 nAChRに選択性があり、望ましい薬物動態特性を持つ化合物であることが判明した。これらの化合物の構造活性相関が提案されている。α7 nAChR作動薬の最適な構造的特徴は3つの部分から成り立っている。アミド基によって芳香族部分に連結された炭素鎖に連結された塩基性部分がある。アミド基は、作動薬の効力に影響を与えることなく反転させることができる。芳香族部分はモノアリール基よりビアリール基の方が高い効力を示し、後段のアリール基の2位で置換すると、さらに効力が増す。ビアリール基の後半のアリール基にH+供与/受容部位を持つ作動薬の方が効力が高い。水素結合受容部位の数が多いと、極性表面積のために血液脳関門(blood–brain barrier;BBB)を通過する際の透過性が低下する可能性があり、α7 nAChRを標的とする作動薬を設計する際には、その点を考慮する必要がある。
例えば、アリールピペラジン、ピペリジン、モルホリンなどのさまざまな環状アミンが塩基部分として作用し、効力は比較的変わらない。非環状第三級アミンは塩基性部位として許容されるが、立体的に大きな置換基は許容されない。
キヌクリジンアミドのようなキヌクリジンの多くの誘導体は、α7 nAChR作動薬として知られている。キヌクリジンアミドのSAR研究では、これらの作動薬の効力と親和性に影響を与える要因が特定されている。キヌクリジン環上のパラ置換と、立体化学上の3-(R)配置が好ましい。芳香族部分に五員環が縮合している場合、活性の増強が見られる。縮合した環がアミドのカルボニル基と電子共鳴することができる場合にはさらに活性が高まるが、縮合した環に水素結合供与性の原子が含まれている場合には活性が低下する。キヌクリジンの剛性と、アミドカルボニル基に対する窒素ブリッジの直交配向は、最適な結合に重要であると推定される。ラットのin vitroモデルでは、幾つかの強力なキヌクリジンアミド誘導体の安定性は低かったが、キヌクリジン環の2位にメチル基を付加することで安定性が大幅に向上した。
医薬品開発
ニコチン型アセチルコリン受容体作動薬の開発は、1990年代初頭にニコチンが動物の記憶に良い影響を与えることが発見された処から始まった。それ以来、ニコチン受容体作動薬の開発は大きく前進した。ニコチン受容体作動薬は、アルツハイマー病、統合失調症、注意欠陥多動性障害(ADHD)、ニコチン依存症など、複数の中枢神経系疾患の治療薬候補として注目を集めている。ニコチン受容体は、中枢神経系、末梢神経系、骨格筋などに存在する受容体である。受容体はアセチルコリンや他の作動薬と結合するリガンド依存性イオンチャネルである。作動薬が受容体に結合すると、イオンチャネルの開状態が安定し、陽イオンの流入が可能になる。
2009年には、ニコチン性アセチルコリン受容体に作用する薬剤が少なくとも5種類発売されている。
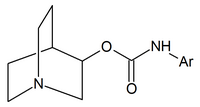
|

|
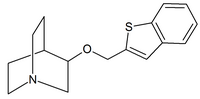
|
| カルバミン酸キヌクリジン | キヌクリジンアミド | キヌクリジンエーテル |
ニコチン作動薬の例
| 有効成分 | 薬理学的特性 | 治療目的 | 構造式 |
|---|---|---|---|
| バレニクリン | α4β2型ニコチン受容体の部分作動薬 | タバコ依存症治療 |

|
| ガランタミン | コリンエステラーゼ阻害剤およびニコチン受容体非競合作動薬 | アルツハイマー病による認知症治療 |
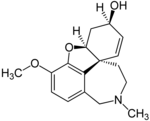
|
| ニコチン | 自律神経節型とα4β2型の両方のニコチン受容体作動薬 | タバコ依存症治療 |
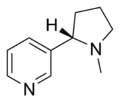
|
| カルバコール | コリン作動薬 | 緑内障治療薬 |
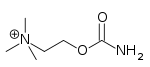
|
| スキサメトニウム | 脱分極性神経筋遮断薬 | 短時間型筋弛緩薬 |
|
| エピバチジン | ニコチン受容体作動薬 | 非臨床使用 |

|
その他のニコチン作動薬には、一般的に臨床使用が限られているものの、以下のようなものがある。
- ロベリン:自律神経節ニコチン受容体の作動薬であり、感覚神経終末にも作用する。
- エピバチジン:ガングリオン型、α4β2、α7受容体の作動薬である。
- デカメトニウム:スキサメトニウムと同様に、骨格筋型受容体で脱分極性遮断を引き起こす。
ムスカリン性とニコチン性の比較
| コリン作動薬の比較 | ||||
|---|---|---|---|---|
| 化合物 | 受容体選択性 | アセチルコリンエステラーゼによる分解 | 備考 | |
| ムスカリン | ニコチン | |||
| アセチルコリン | +++ | +++ | +++ | 内因性リガンド |
| カルバコール | ++ | +++ | - | 緑内障治療薬 |
| メタコリン | +++ | + | ++ | 喘息やCOPDに関する気管支過敏症の診断薬 |
| ベタネコール | +++ | - | - | 膀胱や胃腸の機能障害治療薬 |
| ムスカリン | +++ | - | - | 特定のキノコ類に含まれる天然アルカロイド
キノコ中毒の原因の一つ |
| ニコチン | - | +++ | - | タバコに含まれる天然のアルカロイド |
| ピロカルピン | ++ | - | - | 緑内障治療薬 |
| オキソトレモリン | ++ | + | - | パーキンソン病の症状を誘発する研究用試薬 |
関連項目
参考資料
外部リンク
![]() ウィキメディア・コモンズには、ニコチン作動薬に関するカテゴリがあります。
ウィキメディア・コモンズには、ニコチン作動薬に関するカテゴリがあります。
- nicotinic agonists - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- MeSH list of agents 82018722




