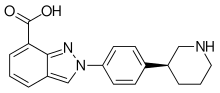
ニラパリブ

| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 発音 | nih-RA-puh-rib |
| 販売名 | Zejula |
| Drugs.com | monograph |
| MedlinePlus | a617007 |
| ライセンス | EMA:リンク、US Daily Med:リンク |
| 法的規制 | |
| 投与方法 | By mouth |
| 薬物動態データ | |
| 生物学的利用能 | 73% |
| 血漿タンパク結合 | 83% |
| 代謝 | Carboxylesterases |
| 代謝物質 | M1 (carboxylic acid) |
| 半減期 | 36 hours |
| 排泄 | 48% urine, 29% feces |
| 識別 | |
|
CAS番号 |
1038915-60-4 |
| ATCコード | L01XK02 (WHO) |
| PubChem | CID: 24958200 |
| DrugBank | DB11793 |
| ChemSpider |
24531930 |
| UNII |
HMC2H89N35 |
| KEGG | D10140 |
| ChEMBL |
CHEMBL1094636 |
| 別名 | MK-4827 |
| 化学的データ | |
| 化学式 | C19H20N4O |
| 分子量 | 320.40 g·mol−1 |
| |
| 物理的データ | |
| 水への溶解量 | 0.7–1.1 mg/mL (20 °C) |
ニラパリブ(Niraparib、開発コード:MK-4827)は、上皮性卵巣癌、卵管癌、原発性腹膜癌の治療に用いられる経口抗癌剤である。日本では卵巣癌の治療・維持療法で用いられる。類薬のオラパリブはBRCA遺伝子変異陽性の患者に使用されるが、ニラパリブはBRCA遺伝子変異の有無に拘らず使用可能である。
米国と欧州で2017年に、日本で2020年に承認された。
効能・効果
日本で承認されている効能・効果:
- 卵巣癌における初回化学療法後の維持療法
- 白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法
- 白金系抗悪性腫瘍剤感受性の相同組換え修復欠損を有する再発卵巣癌
米国での効能・効果:
- 白金系化学療法で完全奏効または部分奏効となった、再発上皮性卵巣癌、卵管癌、原発性腹膜癌の成人患者の維持療法
欧州での効能・効果:
- 進行卵巣癌、卵管癌、腹膜癌の女性の内、下記に該当する患者の維持療法
- 新たに進行卵巣癌と診断され、白金系抗癌剤で腫瘍が縮小または消失した女性
- 過去に白金系抗癌剤で腫瘍が縮小または消失した後に再発した女性
適応症の詳細
ニラパリブは米国で、2017年3月に白金製剤を用いた化学療法で完全奏効または部分奏効した成人の再発上皮性卵巣がん、卵管がん、または原発性腹膜がんの維持療法に適応となった。
2019年10月、適応症が拡大され、3回以上の化学療法の前治療を受けた進行性の卵巣癌、卵管癌、原発性腹膜癌で、相同組換え欠損症(HRD)陽性の状態を伴う患者が対象となった。HRDとは、白金製剤を使用した最後の化学療法に反応してから6カ月以上経過して病勢が進行した患者において、BRCA遺伝子の欠失または欠失が疑われる変異、あるいはゲノム不安定性のいずれかによって定義される。
2020年4月には、再度適応症が拡大され、白金製剤を用いた一次化学療法で完全奏効または部分奏効した進行性上皮性卵巣癌、卵管癌、原発性腹膜癌の成人患者の維持療法にも適用されるようになった。
欧州連合(EU)では、ニラパリブは、白金製剤を用いた一次化学療法終了後に奏効(完全奏効または部分奏効)した成人の進行上皮性(FIGOステージIIIおよびIV)高悪性度卵巣癌、卵管癌、原発性腹膜癌の維持療法としての単剤療法、および白金製剤を用いた化学療法に奏効(完全奏効または部分奏効)した成人の白金製剤感受性再発高悪性度漿液性上皮性卵巣癌、卵管癌、原発性腹膜癌の維持療法としての単剤療法が適応となっている。承認されたのは2017年11月である。
副作用
重大な副作用として、
- 骨髄抑制(78.8%)
- 血小板減少(62.0%)、貧血(55.1%)、白血球減少(8.5%)、好中球減少(21.2%)、発熱性好中球減少症(0.4%)、好中球減少性敗血症(0.1%)、好中球減少性感染(頻度不明)、汎血球減少症(0.3%)など
- 高血圧(9.8%)
- 内、高血圧クリーゼ(0.2%)
- 可逆性後白質脳症症候群(頻度不明)
- 間質性肺疾患(0.6%)
- 肺臓炎(0.5%)、間質性肺疾患(0.1%)など
が挙げられている。
欧米の臨床試験で骨髄抑制が重篤となった確率は、血小板減少:29%、貧血:25%、好中球減少:20% であった。
その他、頭痛、不眠症、悪心(59.1%)、便秘(24.2%)、嘔吐(20.0%)、食欲減退、下痢、疲労(33.2%)、無力症が10%以上の患者で報告された。
長期投与試験(投与日数中央値:250日)の試験では、15%の患者で副作用のためにニラパリブの投与継続が不可能となった。
薬理
作用機序
PARP1は、一本鎖の切断(DNAの傷)を修復するのに重要なタンパク質である。このような傷がDNAの複製(細胞分裂の直前に実施される)まで修復されずに続くと、複製自体が二本鎖切断を引き起こす可能性がある。
BRCA1、BRCA2、PALB2は、エラーのない相同組換え修復(HRR)経路による二本鎖DNA切断の修復に重要な役割を果たすタンパク質である。これらのタンパク質の遺伝子が変異すると、DNA修復にエラーが生じ、最終的には癌の原因となる可能性がある。一度に十分なダメージを受けた場合、変化した遺伝子は細胞の死を引き起こすことがある。
PARP1を阻害する薬剤は、このように複数の二重鎖切断を形成し、BRCA1、BRCA2、PALB2のいずれかに変異がある腫瘍では、これらの二重鎖切断が効率的に修復されず、細胞死に至る。癌細胞ほど頻繁にDNAを複製しておらず、変異したBRCA1やBRCA2を持たない正常細胞は、相同性のある修復機能が作動しているため、PARPの阻害を受けても生き残ることができる。
PARP阻害剤は、PARPタンパク質の触媒作用を阻害するだけでなく、PARPタンパク質をDNA上に捕捉する。 これによりDNA複製が阻害され、非癌細胞よりも成長速度の速い癌細胞で優先的に細胞死が引き起こされる。
薬物動態
投与されたニラパリブの73%が腸で吸収され、約3時間後に最高血中濃度に達する。これは食事の影響を受けない。血中では、ニラパリブの83%が血漿タンパク質に結合している。ニラパリブはカルボキシルエステラーゼによって不活性化され、主な代謝物であるカルボン酸誘導体M1となり、その後、グルクロン酸抱合される。
血中半減期は平均36時間である。尿中に47.5%、糞中に38.8%が検出される。未代謝のニラパリブは、尿中に11%、糞中に19%含まれる。
相互作用
臨床的な相互作用の研究は行われていない。ニラパリブおよびその主要代謝物であるM1は、in vitro において重要なシトクロムP450(肝酵素)のいずれとも有意な相互作用を示さないことから、他の薬剤との相互作用の可能性は低いと考えられる。ニラパリブはP糖タンパク質とBCRPによって輸送されるが、それらを有意に阻害しない。ニラパリブおよびM1は、他の重要なトランスポータータンパク質とは有意な相互作用を示さなかった。
発見と臨床試験
2012年に行われた細胞株を用いた研究では、PARP阻害剤は、PARPを酵素的に阻害するだけではなく、損傷したDNA上にPARPを捕捉することで細胞毒性を発揮し、この捕捉作用の強さは、ニラパリブ>>オラパリブ>>ベリパリブの順であることが明らかになった。
553人の患者を対象とした試験では、生殖細胞系統に有害なまたは有害と疑われるBRCA変異がある患者の無増悪生存期間(PFS)は、ニラパリブ療法で21.0ヶ月、プラセボ療法で5.5ヶ月であった。また、このような変異のない患者のPFSは、ニラパリブ投与で9.3ヶ月、プラセボ投与で3.9ヶ月であった。
参考資料
外部リンク
- “Niraparib”. Drug Information Portal. U.S. National Library of Medicine. 2021年3月24日閲覧。
- “Niraparib tosylate”. Drug Information Portal. U.S. National Library of Medicine. 2021年3月24日閲覧。
- “Niraparib tosylate monohydrate”. NCI Drug Dictionary. National Cancer Institute. 2021年3月24日閲覧。
- “Niraparib tosylate monohydrate”. National Cancer Institute. 2021年3月24日閲覧。