ビクリビロク
| ビクリビロク | |
|---|---|
| |
|
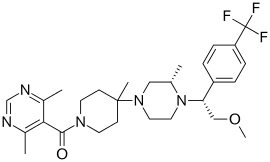
5-({4-[(3S)-4-{2-methoxy-1-[4-(trifluoromethyl)phenyl]ethyl}-3-methylpiperazin-1-yl]-4-methylpiperidin-1-yl}carbonyl)-4,6-dimethylpyrimidine | |
| 識別情報 | |
| CAS登録番号 |
306296-47-9 |
| PubChem | 3009355 |
| ChemSpider |
21106404 |
| UNII |
TL515DW4QS |
| MeSH | Vicriviroc |
| ChEMBL |
CHEMBL82301 |
| 807 | |
| |
| |
| 特性 | |
| 化学式 | C28H38F3N5O2 |
| モル質量 | 533.63 g mol−1 |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
ビクリビロク(Vicriviroc)は、ピリミジン系のHIV-1のCCR5エントリー阻害剤である。以前はSCH 417690やSCH-Dと呼ばれていた。製薬会社シェリング・プラウ社が開発した。メルク社は、後期臨床試験において主要な有効性評価項目を満たさなかったため、治療経験のある患者への使用について規制当局の承認を求めないことを決定した。治療未経験の患者を対象とした臨床試験は継続している。
背景
入手可能な多くの抗HIV薬はウイルスの逆転写酵素かプロテアーゼ酵素の阻害によって作用するため、ウイルスの細胞内への侵入後に効果が現れる。しかし本剤を含むCCR5阻害剤のようなHIV-1侵入阻害剤は、それ以前のウイルス侵入段階を阻害する。
HIV-1 ウイルスの侵入
HIVが標的となるT細胞やマクロファージに結合する際は、ウイルスエンベロープ表面に存在するgp120とgp41タンパクが用いられる。gp120とgp41はエンベロープ上で互いに非共有結合し、3対が集合してgp120/gp41ヘテロ三量体を形成する。この時gp41は構造的に準安定状態となる。
膜融合は、標的細胞の表面に発現する糖タンパク質であるCD4にgp120が結合することで始まる。結合後にgp120は構造変化を起こし、gp120上に共役受容体結合部位が形成される。すべてのHIV-1株は、CCR5またはCXCR4の2つの共役受容体のいずれかを使用する。gp120が受容体に結合するとgp41は準安定状態から解放されて構造変化を起こし、その疎水性のN末端(融合ドメインとも呼ばれる)を宿主細胞膜に挿入してウイルスを固定する。その後gp41タンパク質に構造変化が起こり、HR1・HR2の2つの三量体コイルドコイルがより合わさって6本のヘリックスの束が形成される。この過程でウイルス膜と細胞膜が引き寄せられ融合し、ウイルスゲノムが細胞質内に放出される。
共役受容体と選択性
HIV-1の侵入に関与する2つの共役受容体であるCCR5とCXCR4は、7回膜貫通型(7TM)Gタンパク質共役受容体という大きなファミリーに属している。HIV-1はどちらの受容体に対する特異性を有するかによって分類できる。R5ウイルス(M-指向性HIV-1)はマクロファージを標的とし、CCR5を使用する。X4ウイルス(T-指向性HIV-1)はT細胞を標的とし、CXCR4を使用する。両方の受容体を利用する二重指向性HIV-1も存在する。受容体の選択性は特に、gp120内の非常に変化に富み構造的に柔軟な領域であるV3ループに依存している。ここは約35個のアミノ酸からなり、11位と25位に塩基性アミノ酸が存在すればX4ウイルスと判定できる(11/25 method)。
しかし、利用する受容体は感染の進行によって変化することがある。感染の初期段階では90%の患者がR5ウイルスを持つが、感染から5年が経過すると全患者の約50%が検出可能な量のX4ウイルスを持つようになる。この原因は今のところ不明であるが、ウイルスがCXCR4受容体を使用するようになると、CD4+T細胞の減少速度や病状の進行が速まり、AIDSの発症率や死亡率が高まると判明している。
CCR5-Δ32
抗HIV薬のターゲットとしてCCR5共役受容体に注目が集まったのは、1996年にCCR5コーディング遺伝子の変異型であるCCR5-Δ32(CCR5 delta-32)が発見されてからである。この遺伝子の32塩基対が欠失するとCCR5受容体が機能しなくなる。白人集団におけるこの突然変異の頻度は0.0808であるが、アフリカ系やアジア系集団はこの変異を持たないようである。Δ32変異体を2コピー有する(Δ32ホモ接合体)場合は機能的なCCR5受容体を持たないため、HIV感染に対して高い抵抗性を示す。一方、Δ32変異体を1コピーと正常なCCR5遺伝子を1コピー有する(Δ32ヘテロ接合体)場合は依然としてHIV-1に感染しやすいが、正常なコピーを2つ持つ場合に比べ病気の進行が著しく遅れる。CCR5アンタゴニストはCCR5受容体を変形させるという同様の原理で、HIV gp120タンパク質との結合を防ぐ。
SCH-Cとビクリビロク
2001年、シェリング・プラウ社は、最初の低分子CCR5アンタゴニストの一つであるSCH-C(SCH 351125)を開発した。SCH-CはCCR5を結合のための共役受容体として使用する多くのHIV-1分離株の複製を阻害したが、用量依存的に補正QT時間(QTc)の延長を引き起こすという問題があった。このため、このような第一世代の化合物を上回る抗ウイルス特性と薬物動態特性を持つ代替化合物が検討され、ハイスループットスクリーニングと構造活性相関(SAR)解析によりビクリビロクが発見された。SCH-Cと比べ、ビクリビロクはより安定的かつ効果的にウイルスの複製を阻害し、CCR5との親和性が高く、ヒト遅延整流性カリウムイオンチャネル遺伝子(hERG)転写イオンチャネルに対する親和性が低いため心臓へのリスクが低いと考えられる。
作用機序
CCR5の非競合的なアロステリック・アンタゴニストである。経口投与され、ナノモル濃度で効果を発揮するため投与頻度は1日1回でよい。CCR5受容体の膜貫通ヘリックス間の細胞外表面近くにある小さな疎水性ポケットに結合することで、細胞外セグメントの構造が変化してgp120との結合が阻害され、ウイルスが細胞に侵入できなくなる。
CCR5とビクリビロクの特異的な結合相互作用については、2008年に初めて報告された。ビクリビロクのトリフルオロメチルフェニル基は、CCR5の第5膜貫通ヘリックス(TM5)のI198残基と強く疎水相互作用する可能性がある。さらに、ビクリビロクの第三級アミノ基の正電荷と、CCR5のTM7上のE238残基による親水性領域との間に静電的な相互作用がある可能性がある。この他にも、TM3のY108残基やTM6のY251残基などとの間に強い相互作用が予測されている。
臨床試験
HIV R5ウイルス感染成人を対象とした14日間の単剤投与試験において、すべての投与群(10、25、50mg。1日2回)でHIV RNAのベースラインからの平均減少量が1.5 log10以上となり、有意な減少を示した。
未治療のHIV-1感染者を対象とした第II相試験では、対照群に比べ投与群のウイルス学的再発率が増加したため中止された。しかしさらなる調査で、投与量が少なすぎた可能性が示唆された。
ビクリビロクの5mg、10mg、15mg投与の安全性と有効性を検討した48週間の第II相試験(ACTG5211)では、10mgと15mg投与群で、ベースラインからのウイルス量の減少(中央値)が1.92および1.44(log10 copies/mL)、CD4細胞数の増加(中央値)がそれぞれ130および96(cell/μL)を達成した。また、投与群はプラセボ群に比べ、48週時点でウイルスが検出されなかった(HIV-1 RNA<400 / <50コピー/ml)患者数が多かった(それぞれ14/11% 対 57/37%、43/27%)。
2008年2月、リトナビル配合プロテアーゼ阻害剤を含む3剤以上による最適基礎療法(OBT)に加え、ビクリビロク20mgまたは30mgを投与する48週間の第II相試験(VICTOR-E1)の結果が報告された。研究者らは「ビクリビロク30または20mgを1日1回とリトナビルを含むOBTを併用することにより、治療経験のある被験者において持続的なウイルス抑制効果が得られ、OBT中の有効成分の数にかかわらずCD4細胞数が増加した」と結論付けている。
2008年5月時点で、治療経験のある患者を対象とした2つの第3相試験(VICTOR-E3およびVICTOR-E4)が開始された。しかし、これらの後期臨床試験で主要な有効性評価項目を達成出来なかったため、メルク社は2010年1月時点で、規制当局による承認を求めないことを決定した。
CCR5アンタゴニストの懸念点
これまでの臨床試験データから、新たなHIV-1対抗方法としてCCR5アンタゴニストに期待が寄せられている。現在、ビクリビロクの研究が進行中であり、もう一つのCCR5アンタゴニストであるマラビロクも現在発売されている。しかし、これらはHIV-1の耐性株の出現を助長する懸念がある。耐性化には2つの可能性があると考えられている。即ち、HIV-1が進化してCXCR4のみを共役受容体として用いるようになるか、あるいは、受容体阻害薬が存在しているにもかかわらず、HIV-1がCCR5と相互作用するように変異するかである。実際、gp120のV3ループ内の残基が変異したマラビロク耐性HIV-1が既にin vitro で生成されている。
