
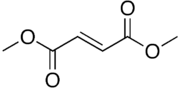
フマル酸ジメチル
| Dimethyl fumarate | |
|---|---|
| |
|
Dimethyl (E)-butenedioate | |
|
別称
trans-1,2-Ethylenedicarboxylic acid dimethyl ester
(E)-2-Butenedioic acid dimethyl ester | |
| 識別情報 | |
| CAS登録番号 | 624-49-7 |
| PubChem | 637568 |
| ChemSpider | 553171 |
| UNII | FO2303MNI2 |
| EC番号 | 210-849-0 |
| DrugBank | DB08908 |
| KEGG | D03846 |
| ChEBI | |
| ChEMBL | CHEMBL2107333 |
| 7045 | |
| |
| |
| 特性 | |
| 化学式 | C6H8O4 |
| モル質量 | 144.13 g mol−1 |
| 外観 | White crystalline solid |
| 密度 | 1.37 g/cm3 |
| 融点 |
103.5 °C, 377 K, 218 °F |
| 沸点 |
193 °C, 466 K, 379 °F |
| 薬理学 | |
| ATC分類 | L04AX07 |
| ライセンスデータ | |
| 危険性 | |
| GHSピクトグラム |

|
| GHSシグナルワード | 警告(WARNING) |
| Hフレーズ | H312, H315, H317, H319, H335 |
| Pフレーズ | P261, P264, P271, P272, P280, P302+352, P304+340, P305+351+338, P312, P321, P322, P332+313, P333+313, P337+313 |
| 関連する物質 | |
| 関連するジエステル | フマル酸ジエチル、マレイン酸ジメチル、リンゴ酸ジメチル、アジピン酸ジメチル |
| 関連物質 |
フマル酸 アクリル酸メチル |
| 特記なき場合、データは常温 (25 °C)・常圧 (100 kPa) におけるものである。 | |
フマル酸ジメチル(フマルさんジメチル、dimethyl fumarate、略称: DMF)は、フマル酸のメチルエステルである。フマル酸の化合物名はカラクサケマン(Fumaria officinalis)に由来する。その他3種類のフマル酸エステル(FAEs)と組み合わせたDMFは、もっぱらドイツにおいて乾癬の経口治療薬(商品名Fumaderm)として認可を受けている。2013年以降、再発性多発性硬化症の成人のための治療オプションとして、アメリカ食品医薬品局(FDA)によって認可されている(商品名Tecfidera)。2017年、DMFの新経口剤形(商品名Skilarence)が欧州医薬品庁(EMA)より、中等度から重度の尋常性乾癬の治療薬として承認された。DMFは大きな免疫抑制を起こさずに免疫調節作用を持つと考えられている。
DMFは、湿気の多い気候での保管や輸送中のカビの発生を防ぐために、家具や靴の殺生物剤としても使用されてきた。しかし、皮膚接触後のアレルギー反応の事例があるため、DMFを含む消費者向け製品は、欧州連合(EU)での製造(1998年以降)および輸入(2009年以降)がもはや認可されていない。
医学的用途
ドイツでは、DMFは乾癬の治療薬として販売されており、関連化合物と混合した経口製剤(Fumaderm)として入手可能である。英国では、純粋な経口製剤(Skilarence)として販売されている。また、米国では、再発性多発性硬化症の成人の治療に経口剤(Tecfidera)として販売されている。
乾癬の治療には、DMFは30 mgと120 mgの錠剤で処方され、1日の最大投与量は720 mgである。多発性硬化症の場合は120 mgと240 mg、1日の最大用量は480 mgである。2015年のコクラン・システマティック・レビューでは、DMF対プラセボの試験で、2年間の治療期間にわたって再発した再発性MSを持つ人々の数の減少について中等度の質のエビデンス(証拠)を発見しただけでなく、障害の悪化の減少の質の低いエビデンス、およびより長くフォローアップを行った質の高い研究の総合的な必要性が示された。
歴史
乾癬の外用剤としてのフマル酸の最初の医学的使用は、1959年にドイツの化学者であるWalter Schweckendiekによって記述され、乾癬のための外用剤であった。スイスのFumapharm社は、1994年にドイツで乾癬を対象としたDMF(といくつかのモノエステルを含む)経口剤であるFumadermを発売した。
本剤の有効性と安全性、およびDMFが主な有効成分であるというエビデンスに基づき、Almirall社がDMFの経口製剤を開発した。この経口製剤(商品名Skilarence)は、2017年6月に欧州において、成人の中等度から重度の尋常性乾癬の治療薬としてEMAの承認を取得した。
多発性硬化症治療のためのDMFの使用に関する最初の臨床研究は、Fumapharm社がBiogen Idec社と共同で行ったが、その後、Fumapharm社は2006年にBiogen Idec社に買収された。また、スウェーデンのAditech Pharma社もMSに対するDMFの経口製剤の研究を行っており、2010年にはデンマークのForward Pharma社がアディテック社の特許を取得した。
Biogen社は、Fumapharm社のDMF経口製剤をBG-12というコードネームで開発を続け、2013年3月にはTecfideraという商品名で、成人の再発型MSの治療薬として承認された。バイオジェン社はこの薬剤の米国での価格を年間5万4千米ドルとした。欧州では2014年に承認された。英国では、NICEが費用対効果が高いとして本剤を推奨するガイダンスを発表したが、活動性の高い、または急速に進行する重度の再発性多発性硬化症ではない患者のみが対象で、バイオジェン社が割引価格で提供することに同意した場合のみが対象となっている。
フォワード社とバイオジェン社は多くの法的管轄区域で特許訴訟を起こしており、2017年に両社は訴訟を解決し、バイオジェン社はフォワード社に12億5000万米ドルを支払い、様々な管轄区域での特許の状況に応じて最大で10%の使用料を支払う可能性があるとしている。
2020年6月、バイオジェンとマイランとの間の訴訟で、ウェストバージニア州の米国連邦地方裁判所は、バイオジェンのいわゆる「514」特許はジェネリック競争からTecfideraを保護しているとして、無効を宣告した。この判決により、マイランは数日以内に自社版Tecfideraを発売する権利を得たが、バイオジェンは控訴を予定していた。
薬理学
フマル酸ジメチルは、親油性で、ヒト組織内での移動性が高い分子である。DMFはα,β-不飽和求電子性化合物であるため、解毒剤であるグルタチオン (GSH) のマイケル付加反応によりすばやく攻撃される。これらの反応を経て、全身に分布する前にフマル酸モノメチル(MMF)に代謝される。DMFはプロドラッグと説明される。
DMFはフマル酸モノメチルの前駆体である。他にも、2019年10月にFDAから承認されたVumerityをはじめ、再発寛解性多発性硬化症の治療薬としてフマル酸モノメチルに代謝されるプロドラッグが開発されている。
DMFの正確な作用機序は明らかにされていない。DMFおよびMMFは、転写因子(Nuclear factor erythroid-derived 2)-関連因子2(Nrf2)経路を活性化することができ、MMFはin vitroでニコチン酸受容体アゴニストとして同定されている。しかし、Nrf2の発現を欠いたマウスにおいて、DMFは依然として免疫系を調節することができ、このことは、Nrf2がその免疫調節作用に必要とされないことを示している。乾癬の場合、その作用機序は、乾癬の発症に直接関与する細胞の細胞内還元型グルタチオンとMMFの相互作用によるものと考えられている。グルタチオンとの相互作用により、核内転座が阻害され、活性化B細胞の核内因子κ-軽鎖-エンハンサー(NF-κB)の転写活性が阻害される。
さらに最近では、DMFおよびMMFは、多発性硬化症および乾癬における病原性細胞の産生に不可欠なmicro-RNA-21の発現を低下させることが示されている。これは、細胞透過性代謝物としてのDMFおよびMMFが、発達中の免疫細胞における代謝-エピジェネティック相互作用を介してmicro-RNA-21の発現をエピジェネティックに調節することができるために達成することができる。
DMFおよびMMFの主な活性は免疫調節であると考えられており、その結果、ヘルパーT細胞(Th)がTh1およびTh17プロファイルからTh2表現型へとシフトする。炎症性サイトカイン産生は、プロアポトーシス事象の誘導、ケラチノサイト増殖の抑制、接着分子の発現の減少、乾癬性プラーク内の炎症性浸潤の減少によって減少する。
主な排泄経路はCO2の呼気であり、少量は尿や糞便から排泄される。
DMFとチトクロムP450や最も一般的な排出・取り込みトランスポーターとの相互作用を示す証拠はなく、したがって、これらの系で代謝または輸送される医薬品との相互作用は予想されない。
合成と反応
実験室でのDMF合成にはいくつかの方法が存在し、マレイン酸ジメチルのアルケン異性化、フマル酸のフィッシャーエステル化などが報告されている。
フマル酸ジメチルは工業化学で使用される古い化合物で、トン単位で購入することができる。2012年の時点では、メートルトン当たり1ドルから50ドルで購入することができ、最低購入量は2トンである。
本化合物は電解水素化二量化反応を受ける。
副作用
乾癬の治療において、最も一般的な有害事象は消化管事象、顔面紅潮、リンパ球減少であり、大抵は軽度である。その他の有害事象として、進行性多巣性白質脳症(PML)やファンコーニ症候群などがありますが、これらはまれなものと考えられている。PMLは、おそらくいくつかの因子の組み合わせによって引き起こされると考えられている。JCウイルス(JCV)への過去の感染は、PML発症の前提条件と考えられている。PMLのレビューでは、確認された症例はすべて、様々なリンパ球減少の期間にさらされた患者のものであった。
多発性硬化症に対しては、副作用として顔面紅潮や下痢、吐き気、上腹部痛などの消化管事象が報告されている。薬剤表示には、アナフィラキシーや血管性浮腫、PML、リンパ球減少症、肝障害などの危険性についての警告が記載されている。
DMFが妊娠中の胎児にどのように影響するかについての情報はない。動物実験では臨床的に関連する用量で胎児に害があった。
消費者向け製品
新しく購入したソファや椅子のフマル酸ジメチル接触アレルギーが関係していると思われる重度の接触皮膚炎の事例がある。フマル酸ジメチルは、非常に低濃度においてアレルギー感作剤であることが明らかにされており、治療が困難な接触アレルギーによる湿疹を生じる。濃度が1 ppmと低い場合でも、最も重篤な症例でアレルギー反応を引き起こす可能性がある。同じように強力な感作物質は、ほんの一握りしかない。
感作リスクが世間の注目を集めたのは、中国のメーカーであるLinkwise社が、保管や輸送中のカビを抑制するために内部にDMFの小袋を入れた2人掛けソファを製造した「ポイズンチェア」事件がきっかけであった。2006年から2007年にかけて販売されたフィンランドでは、60人のユーザーが重度の発疹に見舞われた。原因はフィンランドのTapio RantanenによってDMF誘発性アレルギー反応と特定され、原著論文はBritish Journal of Dermatologyの2008年7月号の表紙となった。イギリスでは、アルゴス、ランド・オブ・レザー、Walmsley Furnishingが販売したソファに本化学物質が含まれていたため、100人以上が被害を受けた。アルゴスは、店舗からソファを引き上げ、販売されていたものを回収するために購入者に連絡した。ランド・オブ・レザーは、購入者に通知することなくソファを店頭から引き上げ、Walmsleyは、危険性が明るみに出た後、彼らが販売したソファから小袋を削除したと述べた。BBCの番組ウォッチドッグが2008年にソファについて消費者を警告したことで、危険性が世間の注目を浴びるようになった。
欧州連合(EU)では、1998年から消費者向け製品の製造におけるDMFの使用が禁止され、2009年にはDMFを含む消費者製品の輸入も禁止された。2009年3月17日のEU委員会決定2009/251は、加盟国に対し、2009年5月1日以降、DMFを含む消費者製品が市場に出回っていないことを確実にするよう求めた。これにより、EU域内でのDMFを含有した消費者向け製品の販売が無条件に禁止された。決定2009/251で定められたDMFの禁止は、製品中のDMF濃度の最大値を0.1 ppmと定めたものである。同決定では、0.1 ppmを超えるDMFを含む消費者製品は市場から回収し、消費者からリコールされるべきであるとしている。
関連項目
外部リンク
- fishersci.ca: Dimethyl fumarate Material Safety Data Sheet (MSDS)