モノクローナル抗体
モノクローナル抗体(モノクローナルこうたい、英: monoclonal antibody、mAbまたはmoAb)は、単一の抗体産生細胞をクローニングして作られた抗体である。このようにして得られた後続の抗体は、すべて単一の親細胞までさかのぼる。
通常の抗体(ポリクローナル抗体)は抗原で免疫した動物の血清から調製するため、いろいろな抗体分子種の混合物となるが、モノクローナル抗体は抗体分子種が均一である。抗原は複数のエピトープ(抗原決定基。抗体によって認識される抗原の部分)を持つことが多く、ポリクローナル抗体は各々のエピトープに対する抗体の混合物となるため、厳密には抗原特異性が互いに異なる抗体分子が含まれている。これに対し、モノクローナル抗体では用いる抗原のエピトープが単一であるため、抗原特異性も単一である。また、1つのモノクローナル抗体の治療対象を2つのエピトープに増やすことで、二重特異性モノクローナル抗体を設計することもできる。
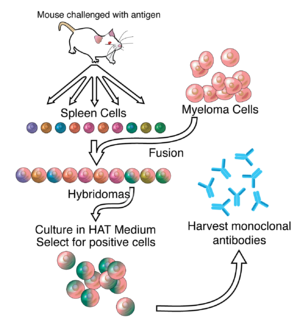
通常、抗体産生細胞と骨髄腫細胞とを細胞融合させることで自律増殖能を持たせた融合細胞ハイブリドーマ (hybridoma) を作成し、目的の抗原特異性をもつ融合細胞のみを選別(スクリーニング)し、これを抗原細胞とする。この抗原細胞を培養し、分泌物を精製して目的のモノクローナル抗体が作製される。事実上、あらゆる適切な物質に特異的に結合するモノクローナル抗体を作製し、その物質を検出または精製することができる。この機能は、生化学、分子生物学、および医学の分野で重要なツールとなっている。
歴史
1900年代、免疫学者のパウル・エールリヒは、病気の原因となる生物を選択的に標的とし、その生物に対して毒素を送達できる化合物として「魔法の弾丸」(Zauberkugel)のアイデアを提案した。これはモノクローナル抗体やモノクローナル薬物複合体の概念を支持した。エールリヒおよびイリヤ・メチニコフは、免疫学の理論的基礎を提供したことで、1908年のノーベル生理学・医学賞を受賞した。
1970年代になると、単一の抗体を産生するリンパ球が、B細胞の癌である多発性骨髄腫という形で知られるようになった。これらの異常な抗体またはパラプロテインは、抗体の構造を研究するために使用されたが、特定の抗原に特異的な同一の抗体を作ることはまだできなかった。1973年、Jerrold Schwaberは、ヒトとマウスのハイブリッド細胞を使用したモノクローナル抗体の生産について説明した。この研究は、ヒト由来のハイブリドーマを使用している人々の間で広く引用されている。1975年、ジョルジュ・ケーラーとセーサル・ミルスタインは、骨髄腫細胞株とB細胞を融合させて、既知の抗原に特異的で不死化された抗体を産生する、ハイブリドーマを作成することに成功した。彼らおよびニールス・カイ・イェルネは、この発見により、1984年にノーベル生理学・医学賞を受賞した。
1988年、グレッグ・ウィンターと彼のチームは、モノクローナル抗体をヒト化する技術を開拓し、多くのモノクローナル抗体が一部の患者に引き起こした反応を解消した。1990年代に入ると、モノクローナル抗体を治療に用いる研究が進展し、2018年には、抑制性連鎖を防ぐモノクローナル抗体を使用した負の免疫調節の阻害による癌治療法の発見により、ジェームズ・P・アリソンと本庶佑がノーベル生理学・医学賞を受賞した。
製造

ハイブリドーマ開発
モノクローナル抗体の作製の背後にある研究の多くは、ハイブリドーマの作製に根ざしている。ハイブリドーマ作成には、目的の抗原に特異的な抗体を産生する抗原特異的血漿/形質芽細胞(ASPC)を特定し、これらの細胞と骨髄腫細胞を融合させることが含まれる。ウサギのB細胞を使って、ウサギ・ハイブリドーマを形成することができる。隣接する細胞膜を融合させるためにポリエチレングリコールを用いるが成功率が低いため、融合細胞のみが増殖できる選択培地を使用する。これが可能なのは、骨髄腫細胞が、核酸のサルベージ合成に必要な酵素であるヒポキサンチン-グアニン-ホスホリボシルトランスフェラーゼ(HGPRT)を合成する能力を失っているためである。HGPRTが欠損していても、de novoプリン合成経路が破壊されない限り、これらの細胞にとっては問題にならない。細胞をアミノプテリン(葉酸類似物質で、ジヒドロ葉酸還元酵素(DHFR)を阻害する)にさらすと、細胞は de novo 経路を使用できなくなり、核酸に対して完全な栄養要求性になるため、生き延びるために補給が必要となる。
選択培地は、ヒポキサンチン、アミノプテリン、チミジンを含むため、HAT培地と呼ばれている。この培地は、融合細胞(ハイブリドーマ)に選択的である。未融合の骨髄腫細胞は、HGPRTが欠損しているため、DNAを複製することができず、増殖できない。未融合の脾臓細胞は、その寿命が限られているため、無制限に増殖することはできない。ハイブリドーマと呼ばれる融合したハイブリッド細胞のみが、培地中で無制限に増殖することができる。その理由は、脾臓細胞パートナーがHGPRTを供給し、骨髄腫細胞パートナーがそれを不死にする特性(癌細胞に似ている)を持つためである。
次に、この細胞の混合物を希釈し、マイクロタイターウェル上で単一の親細胞からクローンを増殖させる。その後、異なるクローンによって分泌された抗体は、抗原に結合する能力(ELISAや抗原マイクロアレイアッセイなどの試験で)や、またはイムノドットブロットで評価される。そして、最も生産的で安定したクローンが将来の使用のために選択される。
このハイブリドーマは、適切な細胞培養培地で無制限に増殖させることができる。それらはまた、マウスに注射することもできる(腸を囲む腹膜腔内)。そこで腹水と呼ばれる抗体を多く含む液体を分泌する腫瘍を生成する。
ハイブリドーマの増殖をさらに促進するために、器内(in vitro)での選択の際に培地を濃縮しなければならない。これは、フィーダー繊維細胞の層や、ブライクローンなどの補助媒体を使用することで実施される。マクロファージで調整した培地を使用することができる。腹水手法は動物に苦痛を与えるため、通常は細胞培養での製造が望ましい。代替技術が存在する場合、腹水は非倫理的と見なされる。
モノクローナル抗体の新規開発技術
近年、ファージディスプレイ、単一B細胞培養、さまざまなB細胞集団からの単一細胞増幅、単一形質細胞解析技術など、いくつかのモノクローナル抗体技術が開発された。従来のハイブリドーマ技術とは異なり、新しい技術は分子生物学的手法を用いて、抗体遺伝子の重鎖と軽鎖をPCRで増幅し、組換え技術で細菌や哺乳類系で生産する。新しい技術の利点の一つは、ウサギ、ラマ、ニワトリ、その他の実験室で一般的な実験動物など、複数の動物で適用できることである。
精製
培養したハイブリドーマの培地サンプルまたは腹水液サンプルをいずれかを入手した後、目的の抗体を抽出する必要がある。細胞培養液サンプルの夾雑物(きょうざつぶつ)は、主に成長因子、ホルモン、トランスフェリンなどの培地成分で構成されている。一方、生体内(in vivo)サンプルには、宿主の抗体、プロテアーゼ、ヌクレアーゼ、核酸、ウイルスが含まれている可能性がある。どちらの場合も、サイトカインのようなハイブリドーマによる他の分泌物が存在する可能性がある。また、細菌汚染があり、その結果、細菌が分泌する内毒素が存在する可能性もある。細胞培養に必要な培地の複雑さ、ひいては混入物に応じて、どちらか一方の方法(in vivoまたはin vitro)が好ましい場合がある。
サンプルは、まず前処理をするか精製の準備をする。最初に細胞、細胞組織片、脂質、および凝固物を、通常は遠心分離によって除去し、その後に0.45 µmのフィルターでろ過する。これらの大きな粒子は、後の精製工程で膜ファウリングと呼ばれる現象を引き起こすことがある。さらに、特に分泌量の少ない細胞株で目的の抗体が作られている場合、サンプル中の生成物の濃度が十分でない可能性もある。そのため、サンプルを限外濾過または透析によって濃縮する。
帯電した不純物の多くは、核酸やエンドトキシンなどの陰イオンである。これらは、イオン交換クロマトグラフィーによって分離することができる。目的の抗体がカラムに結合しながら陰イオンが流れるような低いpHで陽イオン交換クロマトグラフィーを使用し、目的の抗体がカラムに結合しながら流れるような高いpHで陰イオン交換クロマトグラフィーを使用する。また、さまざまなタンパク質を、その等電点(pI)に基づいて、陰イオンとともに分離することができる。タンパク質では、等電点(pI)は、タンパク質が正味の電荷を持たないpHと定義される。pH > pIの場合、タンパク質は正味の負電荷を持ち、pH < pIの場合、タンパク質は正味の正電荷を持つ。たとえば、アルブミンのpIは4.8であり、ほとんどのモノクローナル抗体のpIが6.1であるのと比べて著しく低い。したがって、pHが4.8から6.1の間では、アルブミン分子の平均電荷はより負になる可能性が高く、mAbs分子は正に帯電しているため、両者を分離することができる。一方、トランスフェリンのpIは5.9なので、この方法では簡単には分離できない。良好な分離のためには、少なくともpIの差は1を必要とする。
その代わりに、トランスフェリンは、サイズ排除クロマトグラフィーによって除去することができる。この方法は、より信頼性の高いクロマトグラフィー技術の一つである。タンパク質を扱っているので、電荷や親和性などの特性は一貫しておらず、pHによって分子がプロトン化および脱プロトン化されるため変化するが、サイズは比較的一定に保たれる。それでもなお、低分解能、低容量、低溶出時間などの欠点がある。
はるかに迅速な単一ステップの分離方法として、プロテインA/Gアフィニティークロマトグラフィーがある。この抗体は、プロテインA/Gに選択的に結合するため、高レベルの純度(通常80%以上)が得られる。しかし、この方法は一般的に過酷な条件で行われるため、損傷を受けやすい抗体には問題がある可能性がある。pHが低いと、結合が切断されて抗体がカラムから外れることがある。製品に影響を与える可能性があることに加え、pHが低いとプロテインA/G自体がカラムから漏れ出し、溶出したサンプルに混入する可能性がある。敏感な抗体が低pHにさらされるのを防ぐために、高塩濃度を採用した穏やかな溶出バッファーシステムを利用できる。固定化プロテインA/Gはより高価な樹脂であるため、この方法ではコストも重要な考慮事項となる。
単一の工程で最大の純度を達成するために、抗体に特異性を持たせるために抗原を使用して、アフィニティ精製を行うことができる。この方法では、抗体を生成するために用いる抗原は、アガロース担体に共有結合する。抗原がペプチドの場合、一般的には末端にシステインを持つように合成される。これにより、開発時にKLHなどのキャリアタンパク質に選択的に結合させ、精製を保持することができる。その後、抗体含有培地を、固定化された抗原とインキュベートする。このとき、抗体はバッチ式またはカラムを通過させることにより選択的に結合し不純物を洗い流す間保持される。その後、低pHバッファーまたはより穏やかな高塩濃度溶出バッファーで溶出し、担体から精製された抗体を回収する。
抗体の不均一性
モノクローナル抗体やその他の組換え生物学的製品では、製品の不均一性が普通に見られ、一般的には発現時の上流側、または製造時の下流側のいずれかでもたらされる。
これらの変異体は、典型的には、凝集体、脱アミド化生成物、グリコシル化変異体、アミノ酸側鎖の酸化物、さらにはアミノおよびカルボキシル末端のアミノ酸付加物である。このような微小な構造変化は、前臨床試験の安定性とプロセスの最適化、ひいては治療薬の効力、バイオアベイラビリティ、および免疫原性に影響を及ぼす可能性がある。モノクローナル抗体のプロセス流における一般的に受け入れられている精製方法は、プロテインAによる製品ターゲットの捕捉、溶出、潜在的な哺乳動物ウイルスを不活性化するための酸性化、それに続くイオンクロマトグラフィー(最初に陰イオンビーズ、次に陽イオンビーズ)が含まれる。
置換クロマトグラフィーは、これらのあまり見られない変異体を、動物の薬物動態試験などの前臨床評価レジメンに適した量で同定し、特性を明らかにするために使用されている。前臨床開発段階で得られた知識は、製品の品質に対する理解を深めるために重要であり、リスク管理や規制の柔軟性を高めるための基礎となる。最近の米国食品医薬品局(FDA)のクオリティ・バイ・デザインイニシアチブは、開発に関するガイダンスを提供し、製品の製造可能性を高めながら、有効性と安全性プロファイルを最大化するような製品およびプロセスの設計を促進しようとするものである。
組換え
組換えモノクローナル抗体の作製には、レパートリークローニング、CRISPR/Cas9、またはファージディスプレイ/酵母ディスプレイ技術が用いられる。組換え抗体工学では、マウスではなくウイルスや酵母を使用して抗体を作製する。これらの技術は、免疫グロブリン遺伝子セグメントの迅速なクローニングに基づき、アミノ酸配列がわずかに異なる抗体のライブラリを作成し、そこから目的の特異性を持つ抗体を選択することができる。ファージ抗体ライブラリは、ファージ抗原ライブラリの別形である。これらの技術は、抗体が抗原を認識する特異性、さまざまな環境条件での安定性、治療効果、および診断用途での検出性を高めるために使用することができる。発酵槽は大規模な抗体生産に使用されている。
キメラ抗体
マウスとヒトの抗体は構造的には類似しているが、マウスモノクローナル抗体をヒトに注射したときに、それらの違いは免疫応答を引き起こすのに十分であり、その結果は、マウスモノクローナル抗体は血液中から速やかに除去され、全身性の炎症作用およびヒト抗マウス抗体(HAMA)の産生をもたらす。
組換えDNAは、滞留時間を長くするために1980年代後半から探究されてきた。ある研究アプローチにおいて、モノクローナル抗体の結合部分をコードするマウスDNAを、生細胞の中でヒトの抗体産生DNAと融合させた。この「キメラ」または「ヒト化」されたDNAを細胞培養で発現させると、一部マウスで一部ヒトの抗体を産生する。
ヒト抗体
モノクローナル抗体を作製できるという発見以来、科学者たちは、ヒト化抗体またはキメラ抗体の副作用を軽減するために、完全ヒト製品の作製を目標としてきた。いくつかの成功したアプローチとして、トランスジェニックマウス、ファージディスプレイ、単一B細胞クローニングが確認されている。
2016年11月現在、市販されている完全ヒトモノクローナル抗体治療薬19種のうち、13種がトランスジェニックマウス技術に由来している。
トランスジェニック技術を採用して市場に出している組織は次のとおりである。
- Medarex - UltiMabプラットフォームを販売していた。Medarex社は2009年7月にブリストル・マイヤーズ スクイブ社に買収された。
- Abgenix社 - Xenomouse技術を販売していた。Abgenix社は2006年4月にアムジェン社に買収された。
- リジェネロン・ファーマシューティカルズ社 - VelocImmune技術。
- Kymab - Kymouseテクノロジーを販売している。
- Open Monoclonal Technology社のOmniRat™およびOmniMouse™プラットフォーム。同社は、2015年12月にLigand社に買収された。
- TRIANNI, Inc - TRIANNIマウスプラットフォームを販売している。
- Ablexis, LLC - AlivaMabマウスプラットフォームを販売している。
ファージディスプレイは、繊維状ファージの外皮タンパク質(Phage major coat protein)上で可変抗体ドメインを発現させるために使用可能である。これらのファージディスプレイ抗体は、さまざまな研究用途に使用できる。ProAbは1997年12月に発表され、罹患組織と非罹患組織に対する抗体ライブラリのハイスループットスクリーニングを行うもので、Proximolはフリーラジカル酵素反応を利用して、特定のタンパク質に近接する分子を標識するものである。
モノクローナル抗体は、癌、心血管疾患、炎症性疾患、黄斑変性症、移植拒絶反応、多発性硬化症、ウイルス感染症の治療に承認されている。
2006年8月、米国研究製薬工業協会の報告によると、米国企業は160種類のモノクローナル抗体を臨床試験中または米国食品医薬品局の承認を待っている。
コスト
モノクローナル抗体の製造は、複雑なプロセスが関与したり、その全般的な分子サイズのため、低分子化合物よりもコストが高く、これらはすべて新しい化学物質を患者に提供するための膨大な研究開発費に追加される。それらは、製造業者が多額の投資費用を回収できるように価格設定されており、米国のように価格統制がない場合は、価値が高いほど価格が高くなることがある。ピッツバーグ大学の7人の研究者は、患者一人当たり「mAb療法の年間費用は、腫瘍学および血液学の領域では他の疾病よりも約10万ドル高い」と結論づけた。新血管疾患や代謝性疾患、免疫領域、感染症、アレルギー、眼科の各領域と比較された。
用途
診断検査
ある物質に対するモノクローナル抗体ができれば、それを使ってその物質の存在を検出することができる。タンパク質は、ウェスタンブロットやイムノドットブロットを使用して検出できる。免疫組織化学検査では、モノクローナル抗体を使用して、固定組織切片中の抗原を検出でき、同様に、免疫蛍光検査では、凍結組織切片または生細胞中の物質を検出できる。
分析および化学的用途
抗体はまた、免疫沈降法を使用して、混合物から標的化合物を精製するためにも使用される。
治療用途
治療用モノクローナル抗体は、標的分子の機能の遮断、標的分子を発現している細胞のアポトーシス誘導、またはシグナル伝達経路の調節など、複数の機構を通じて作用する。
臨床への応用
モノクローナル抗体の臨床適用
1970年代に発明されたモノクローナル抗体は臨床に革命的な変化を起こすといわれたが、その後ほぼ20年間、臨床試験は上手くいかなかった。これは主に、マウスの抗体はヒトに抗原認識されることが原因であった。しかし1990年代になって、CHO細胞内に、マウスでなくヒトの免疫グロブリン遺伝子を発現するプラスミドを直接形質転換する方法が開発されて以降、この問題は克服された。この方法はさらに進化し、現在ではハイブリドーマを使用せず、ファージディスプレイにより1兆個の分子からなる莫大なクローンライブラリーから最適抗体がスクリーニングされ、その遺伝子をCHO細胞で大量生産する方法が用いられている。もしくは、ヒトの抗体を生産するトランスジェニックマウスを使い、直接ヒト抗体を得る方法が用いられる。これらの方法は、前臨床段階までの開発費がわずか約2億円で済むといわれており、従来の古典的化学薬品にかかる20億円と比較して非常に効率がよい。ただし細胞培養を必要とするため、最終製品の製造費用は化学合成による化学薬品と比べると、非常に高い。
モノクローナル抗体はタンパク質薬品であり、いわゆる化学薬品と違い経口投与ができない(普通週一回の注射)、製造費用が非常に高い、細胞内部に侵入できないなどの欠点を持つ。しかしいったん標的分子に結合すると、患者自身の免疫機構が働いて標的分子を含むがん細胞を高率で破壊できるなどの利点をもつ。また、免疫グロブリン自体はヒトの体内に存在する分子なので、それ自身による副作用は予想しやすい。
原理的にはポリクローナル抗体も臨床に使用可能であるが、人間の患者への薬品として使用するためには、薬品内の分子が化学的に厳密に定義され、さらにそれらを極めて高純度でかつ安定的に大量生産する必要があり、現実にはほぼ不可能であるといわれている。 ヒト血漿由来(血液製剤)の免疫グロブリン製剤は一種のポリクローナル抗体であり、様々な難病に対して使用され有効性を示している。しかし、これら血液由来の免疫グロブリン製剤が組換え抗体医薬品に容易に置き換えることができないのは、上記の品質管理の困難さからである。
事例紹介
癌治療
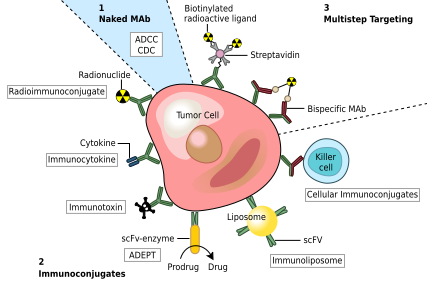
癌の治療法の一つとして、癌細胞に特異的な抗原にのみ結合し、標的となる癌細胞に対する免疫応答を誘発するモノクローナル抗体が考えられる。このようなモノクローナル抗体は、毒素、放射性同位体、サイトカイン、その他の活性コンジュゲートの送達用に修飾することができる。あるいは、Fab領域で標的抗原およびコンジュゲート(またはエフェクター細胞)の両方に結合できる二重特異性抗体を設計できる。すべてのインタクト抗体は、そのFc領域で細胞受容体または他のタンパク質に結合することができる。
米国食品医薬品局(FDA)が癌に対して承認しているモノクローナル抗体は次のとおりである。
自己免疫疾患
自己免疫疾患に用いられるモノクローナル抗体にはインフリキシマブやアダリムマブがあり、TNF-αに結合して阻害することにより、関節リウマチ、クローン病、潰瘍性大腸炎、強直性脊椎炎に効果がある。バシリキシマブとダクリズマブは、活性化T細胞のIL-2を阻害することにより、腎移植の急性拒絶反応を予防に役立つ。オマリズマブは、ヒト免疫グロブリンE(IgE)を阻害し、中等症から重症のアレルギー性喘息の治療に有用である。
治療用モノクローナル抗体の例
研究用のモノクローナル抗体は、抗体サプライヤーから直接またはCiteAbのような専門家検索エンジンを使用して入手することができる。次は臨床的に重要なモノクローナル抗体の例である。
| 主なカテゴリー | 種類 | 用途 | 機構/標的 | 形態 |
|---|---|---|---|---|
| 抗炎症 | インフリキシマブ | TNF-α阻害 | キメラ | |
| アダリムマブ | TNF-α阻害 | ヒト | ||
| バシリキシマブ |
|
活性化T細胞のIL-2抑制 | キメラ | |
| ダクリズマブ |
|
活性化T細胞のIL-2抑制 | ヒト化 | |
| オマリズマブ |
|
ヒト免疫グロブリンE (IgE) 抑制 | ヒト化 | |
| 抗癌 | ゲムツズマブ |
|
白血病細胞の骨髄細胞表面抗原CD33を標的 | ヒト化 |
| アレムツズマブ | Tリンパ球およびBリンパ球の抗原CD52を標的 | ヒト化 | ||
| リツキシマブ |
|
Bリンパ球上のリン酸化タンパク質CD20を標的 | キメラ | |
| トラスツズマブ |
|
HER2/neu (erbB2) 受容体を標的 | ヒト化 | |
| ニモツズマブ |
|
EGFR阻害 | ヒト化 | |
| セツキシマブ |
|
EGFR阻害 | キメラ | |
| ベバシズマブ & ラニビズマブ |
|
VEGF阻害 | ヒト化 | |
| 抗癌および抗ウイルス | バビツキシマブ |
|
免疫療法、ホスファチジルセリンを標的 | キメラ |
| 抗ウイルス | 免疫療法、SARS-CoV-2スパイクタンパクを標的 | キメラ | ||
| バムラニビマブ/エテセビマブ | 免疫療法、SARS-CoV-2スパイクタンパクを標的 | キメラ | ||
| その他 | パリビズマブ |
|
RSV融合 (F) タンパク質を阻害 | ヒト化 |
| アブシキシマブ | 血小板上の受容体GpIIb/IIIaを阻害 | キメラ |
病気の迅速診断キット
モノクローナル抗体を使用したイムノクロマト法で各種の迅速診断キットが販売されている。5分から15分で診断できる。 たとえば、感染症にはインフルエンザウイルス、RSウイルス、A群β溶連菌、アデノウイルス、肺炎マイコプラズマ、ヒトメタニュウモウイルス、ノロウイルス、ロタウイルス、肺炎球菌、レジオネラ、病原性大腸菌O157、便中ピロリ菌などである。
副作用
ベバシズマブやセツキシマブなどのいくつかのモノクローナル抗体は、さまざまな種類の副作用を引き起こす可能性がある。これらの副作用は、一般的な副作用と重篤な副作用に分類される。
一般的な副作用には次のものがある。
- めまい
- 頭痛
- アレルギー
- 下痢
- 咳
- 発熱
- かゆみ
- 背中の痛み
- 全身の脱力感
- 食欲不振
- 不眠症
- 便秘
重大な副作用の可能性として次のものがある。
米バイオテクノロジー産業における役割
モノクローナル抗体は1990年代後半から、バイオテクノロジー産業に革命をもたらし、現在のバイオテクノロジー薬品のほぼ3分の1はモノクローナル抗体である。1997年にGENENTECH社のRituxan抗体が抗CD20抗体として非ホジキンリンパ腫 (NHL) に対して認可されたのをはじめ、Herceptin, Avastinなどのシグナルトランスダクションやアンジオジェネシスを標的とする新型をふくめ、現在15以上のモノクローナル抗体ががん治療などに使われ、少なくとも100を超えるモノクローナル抗体がPhaseI・II・IIIの臨床試験で開発されている。特にがん治療において使われ、2004年の売り上げは約60億ドル、2008年までにモノクローナル抗体の売り上げは150億ドルを超えると予想される。また、次世代モノクローナル抗体で呼ばれる、放射性同位体を結合したものや、抗体可変部位のみの極小型、などの新型が開発されている。
成功した抗体の売り上げは莫大で、2004年は抗TNF-α抗体Remicade(Centocor社)がトップで21億ドル、Rituxanが17億ドルとブロックバスター製品となっている。特にGENENTECH社が開発した3つのモノクローナル抗体製品(Rituxan, Herceptin, Avastin)はその全てがFDAから認可されており、その全てがヒット製品になっている。一般に4-6年に及ぶ臨床試験で製品が生き残る確率はわずか20%であることから考えて、これは米製薬業界史上稀にみる成功である。
モノクローナル抗体が最も成功した要因のひとつは、抗体はもともと生体防御タンパク質として進化した分子なので、他のタンパク質と比べ極めて安定性の高く半減期が長いこと、標的と結合した後、身体の免疫機構を利用するため、増幅効果を期待できることなどである。これとくらべ、同じく1990年代から開発中のアンチセンス (antisense) 薬品は、標的細胞内の核内に輸送すること自体が至難の業であることから、GENTA社やISIS社が莫大な開発費を投じた製品はほぼ全て失敗に終わっている。
日本で上市されている医薬品
モノクローナル抗体薬の名称は語尾が"-mab"(Monoclonal AntiBodies)であらわされる。
参照項目
- アフィマー
- 抗体ミメティック
- アプタマー
- 免疫毒素 - モノクローナル抗体を標的とすることもある
- モノクローナル抗体の一覧
- モノクローナル抗体療法
- モノクローナル抗体の命名法
- ポリクローナル抗体
- MAbs (雑誌)
脚注
推薦文献
- 2019 Historical overview of monoclonal antibodies in the journal Nature
- Monoclonal Antibodies, from John W. Kimball's online biology textbook
外部リンク
- Monoclonal antibodies - MeSH・アメリカ国立医学図書館・生命科学用語シソーラス(英語)
- Antibodypedia - 科学界で利用可能なあらゆる抗体に関するデータと解説を公開したオープンアクセスの仮想リポジトリ
- Antibody Purification Handbook - 抗体精製ハンドブック
|
モノクローナル抗体に関する 図書館収蔵著作物 |