
リモナバン
| |
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com |
患者向け情報(英語) Consumer Drug Information |
| ライセンス | EMA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 投与方法 | Oral |
| 薬物動態データ | |
| 生物学的利用能 | Undetermined |
| 血漿タンパク結合 | Nearly 100% |
| 代謝 | Hepatic, CYP3A4 involved |
| 半減期 | Variable: 6 to 9 days with normal BMI 16 days if BMI >30 |
| 排泄 | Fecal (86%) and renal (3%) |
| 識別 | |
|
CAS番号 |
168273-06-1 158681-13-1 |
| ATCコード | A08AX01 (WHO) |
| PubChem | CID: 104850 |
| IUPHAR/BPS | 743 |
| DrugBank |
DB06155 |
| ChemSpider |
94641 |
| UNII |
RML78EN3XE |
| KEGG |
D05731 |
| ChEMBL |
CHEMBL111 |
| 化学的データ | |
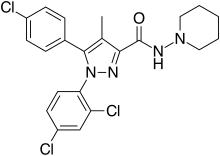
| 化学式 | C22H21Cl3N4O |
| 分子量 | 463.79 g·mol−1 |
| |
リモナバン(リモナバント, 英語: Rimonabant, SR141716)は、選択的なカンナビノイド受容体タイプ1の拮抗薬で、食欲抑制剤または抗肥満薬 である。
かつての製品名はアコンプリア(Acomplia)やスリモナ(Slimona)。
歴史
2006年に欧州各国で承認されたが、2008年に自殺企図など動面での副作用によって市場から撤退した。日本を含め、進行していた治験は中止された。
欧州の規制当局が神経精神的な副作用を容認できないと判断したため心血管イベント予防の臨床試験でフォローアップ(投与中止後)平均13.8か月目に試験が中止された。リモナバン群とプラセボ群の有害事象は、精神神経系が32%:21%で、自殺既遂が4例:1例(有意差不明)であった。
薬理
体内にある内因性のカンナビノイドは、食欲を司るカンナビノイド受容体タイプ1に作用することで食欲を起こす。 リモナバンは逆にこれに拮抗して食欲を抑制する。逆に、大麻の成分であるテトラヒドロカンナビノール (THC) は、ここに作用することで食欲を起こす。
アデニリルシクラーゼの活性を阻止し、輸精管の収縮を抑える。
有効性
食事療法と併行し1年間継続的に服用した結果、5%の体重減少が約50%の頻度で、10%の体重減少が約27%の頻度でみられたとの報告がある。偽薬群は、5%の体重減少が19.7%の頻度で、10%の体重減少が7.8%の頻度であった。
副作用
英国の1998から2011年の有害事象報告では、うつ病の報告数と自殺未遂の割合が2番目に多かった。リモナバンの自殺既遂はランク外で目立っていない。サノフィ社による市販後調査において、約1-10%の頻度で抑うつが、約1%の頻度で自殺企図が、自発報告されていた。
禁忌
うつ病患者あるいは抗うつ薬を服用している人への投与は禁忌となっている。さらに、本薬は母乳中へ移行することが動物実験で示されており、授乳期の母親への投与は禁忌である。
また、ケトコナゾール、イトラコナゾールなどの抗真菌薬、テリスロマイシンやクラリスロマイシンなどの抗菌薬といった肝臓のCYP3A4阻害薬との併用はリモナバンの効果を増幅するので、注意を要する。