
大動脈解離
| 大動脈解離 | |
|---|---|

| |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 |
血管外科学 |
| ICD-10 | I71.0 |
| ICD-9-CM | 441.0 |
| DiseasesDB | 805 |
| MedlinePlus | 000181 |
| eMedicine | emerg/28 |
| Patient UK | 大動脈解離 |
| GeneReviews | |
大動脈解離(だいどうみゃくかいり、英: aortic dissection)とは、3層構造を作っている大動脈のうち、何らかのきっかけで真ん中の層の膜(中膜)に血流が入り込み、層構造が別々に剥がれていく(解離してしまう)疾患。
なお、大動脈解離と解離性大動脈瘤(かいりせいだいどうみゃくりゅう、dissecting aneurysm of the aorta)を混同しないよう留意されたい。この症例においては特に瘤形成を認めないことも多く、前述の症状の中でも、大動脈の径が拡大して瘤形成を認めた場合にのみ「解離性大動脈瘤」と呼ばれるからである。
病態
正常な層構造が壊れた大動脈は弱くなり、最悪の場合破裂してしまう。また、大動脈の出発点である大動脈起始部(バルサルバ洞)から心臓にかけて解離が進めば、そこから出ている冠動脈の血流を阻害して心筋梗塞を起こしたり、大動脈弁輪拡張に伴い大動脈弁を壊したり(大動脈弁閉鎖不全症)、心臓を包む心嚢という袋の中に出血を起こしたりすると、心タンポナーデを起こす。これらの合併症は死に至るものであり、大動脈解離が危険な病気である所以といえる。
また、急性大動脈解離においては破裂や心タンポナーデのみが危険というわけではない。解離によって偽腔が重要血管を閉塞すると、脳梗塞、脊髄梗塞、腸管などの消化管虚血、下肢の虚血を引き起こす。重要臓器に対する虚血が起きた場合の救命率は手術を行い得た場合でも70%以下であり、血管疾患の中でも特に重篤なものである。
分類

|
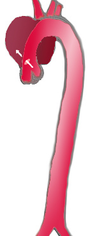
|

|
|
| 頻度 | 60% | 10–15% | 25–30% |
|---|---|---|---|
| 分類 | DeBakey I | DeBakey II | DeBakey III |
| Stanford A | Stanford B | ||
| 近位 | 遠位 | ||
Stanford(スタンフォード)分類、DeBakey(ドゥベイキー)分類が用いられる。
Stanford分類
- Stanford A
- 上行大動脈に解離が及んでいる状態
- Stanford B
- 上行大動脈に解離が及んでいない状態
DeBakey分類
- I型
- 上行大動脈にtearがあり弓部大動脈より末梢に解離が及ぶもの
- II型
- 上行大動脈に解離が限局するもの
- III型
- 下行大動脈にtearがあるもの
- IIIa型
- 腹部大動脈に解離が及ばないもの
- IIIb型
- 腹部大動脈に解離が及ぶもの
DeBakey分類に際しては以下の亜型分類を追加できる 追加分類
- 弓部型
- 弓部にtearがあるもの
- 弓部限局型
- 解離が弓部に限局するもの
- 弓部広範型
- 解離が上行または下行大動脈に及ぶもの
- 腹部型
- 腹部にtearがあるもの
- 腹部限局型
- 腹部大動脈のみに解離があるもの
- 腹部広範型
- 解離が胸部大動脈に及ぶもの
(逆行性III型解離という表現は使用しない)
症状
強烈な痛みは患者の96%にみられ、解離の場所を推定するのにも重要な症状である。しかし解離が腹部大動脈まで及ぶと「全身を動き回るように痛む」ともいわれている。加藤茶が、2006年にStanford Aを発症した際の痛みとして述べたことがある。心不全症状を起こすことがあるほか、初発症状が突然死であることもある。また、解離によって血圧の上昇または低下が起こるほか、胸水の貯留がみられることもある。
- Adamkiewicz 動脈・前脊髄動脈を圧迫・閉塞させることにより、対麻痺がみられることがある。
原因
大動脈解離は、高血圧および多くの結合組織障害に関連している。血管炎(動脈の炎症)がまれに大動脈解離と関連する。胸部外傷が起きた結果の可能性もある。大動脈解離が起きた人の約72〜80%は、高血圧の既往歴がある。コカインやメタンフェタミンなどの覚醒剤による違法薬物使用も、大動脈解離の修正可能な危険因子である。喫煙が原因の場合もある。
大動脈二尖弁(大動脈弁が関与する先天性心疾患の一種)は、大動脈解離が起きた人の7〜14%にみられる。これらの人は上行大動脈で乖離する傾向がある。大動脈二尖弁を有する人の解離のリスクは、弁の狭窄(英語: Stenosis)の程度とは関連していない。
マルファン症候群、エーラス・ダンロス症候群、ロイス・ディエツ症候群(英語: Loeys–Dietz syndrome)などの結合組織病(英語: Connective tissue disease)は、大動脈解離のリスクを高める。同様に、高安動脈炎、巨細胞性動脈炎、結節性多発動脈炎、ベーチェット病などの血管炎は、その後の大動脈解離と関連している。マルファン症候群は、大動脈解離を起こした個人の5〜9%にみられる。この集団では、若い人の発生率が増加する。マルファン症候群の人は大動脈瘤を患う傾向があり、大動脈の近位切開を起こしやすい。
またターナー症候群は、大動脈根の拡張により、大動脈解離のリスクを高める。
大動脈解離につながる胸部外傷は、原因に基づいて2グループに分けることができる。鈍い胸部外傷(自動車事故と医原病で一般的にみられる。医原病の原因には、心臓カテーテル検査または大動脈バルーンパンピングによる外傷が含まれる。
大動脈解離は、心臓手術の後遺症である可能性がある。急性大動脈解離が起きた人の約18%は、開心術の病歴がある。大動脈弁閉鎖不全のために大動脈弁置換術を受けた人は、大動脈弁閉鎖不全が上行大動脈の血流を増加させるため、特にリスクが高くなる。これにより、上行大動脈の壁が拡張したり弱くなったりする可能性がある。
梅毒は、その三次段階でのみ大動脈解離を引き起こす可能性がある。
検査・診断
激痛から大動脈解離を疑う。胸部X線で大動脈陰影や上縦隔の拡大がみられることがあるが、特に所見がみられないこともあるため、基本的にCTやMRIで診断する。
- CT
- 静脈内に造影剤(ヨウ素系)を注入して造影する撮影法が基本である。真腔、偽腔、フラップの検出が可能で、感度は83〜87%、特異度は87〜100%と高い。最近登場したヘリカルCTはより正確な診断が可能であり、感度は96%、特異度は100%にも及ぶ。また、近年の多チャンネルヘリカルCTでは造影CTではなく単純CTで診断可能な場合もまれではない。
- MRI
- さまざまな断面で鮮明な画像を得られるのが特徴である。解離の範囲や状態を正確に把握するのに適している。感度・特異度はともに96%。
- 心エコー
- 内膜フラップを検出できれば確定できる。また、Stanford A型解離では心タンポナーデ(エコーフリースペースとして見える)をきっかけに解離を診断するケースもある。
- D-ダイマー
- 解離した部分では血栓が形成されるため、D-ダイマーが生成される。発症24時間以内の血中Dダイマー値が500mg/mL未満であれば、急性大動脈解離は除外可能であるという報告がある。
治療・予後
予後はStanford AであるかStanford Bのどちらかによって大きく異なる。
Stanford Bの場合、脳に血流を送る腕頭動脈、左総頚動脈が保たれるため、保存的に治療が行われる。ただし、腹腔動脈、両側腎動脈、上腸間膜動脈に解離が及んだ場合は手術適応となりえる。また、腸骨動脈が解離によって閉塞された場合も下肢の筋壊死を引き起こすため、ステントや非解剖学的バイパスなどの手術治療が行われる場合がある。この場合、閉塞した時間が長ければ、筋腎代謝症候群(MNMS: MyoNephrotic Metabolic Syndrome)を引き起こし、これにより命を失う場合もある。
Stanford Aの場合、腕頭動脈、左総頚動脈に血流が減少し脳死の危険が高いので、緊急手術適応となる場合が多い。ただし、早期血栓閉塞型であれば保存的に治療を行う。大動脈弁に解離が及んで大動脈弁閉鎖不全、心筋梗塞、心タンポナーデを起こした場合、予後は非常に悪い。
なお、大動脈解離に伴う急性心筋梗塞 (AMI: Acute Myocardial Infarction)に対して血栓溶解療法や抗凝固療法、IABP(Intra Aortic Balloon Pumping:大動脈内バルーンパンピング)が禁忌であるが、実際の診療の場においては、医師の慎重な判断の下にIABPが行われることがある。
脚注
参考文献
この節の加筆が望まれています。 |
関連項目
外部リンク
この節の加筆が望まれています。 |