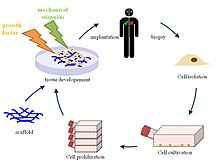
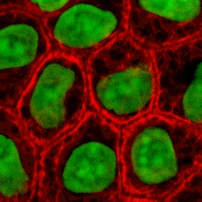
組織工学
この項目「組織工学」は翻訳されたばかりのものです。不自然あるいは曖昧な表現などが含まれる可能性があり、このままでは読みづらいかもしれません。(原文:en:Tissue engineering) 修正、加筆に協力し、現在の表現をより自然な表現にして下さる方を求めています。ノートページや履歴も参照してください。(2017年2月) |
組織工学(そしきこうがく、英語: Tissue engineering、ティッシュエンジニアリング)とは、生物の組織を改善または置換するために、細胞を組み合わせたり、工学、特に材料工学の手法を取り入れたり、生化学的や物理化学的な因子を使うことである。例として、医療目的において生きた組織をつくり出す際に、細胞が育つ「足場」となる材料を使用する技術などが挙げられる。かつてはバイオマテリアルの一分野として分類されていたが、その範囲が拡大し、重要性が増してきたことから、それ自体、一分野とされる。
組織工学の定義は多くあり、広い範囲をカバーしたりもするが、実際には、この用語は、組織の一部または全部(すなわち骨、軟骨、血管、膀胱、皮膚、筋肉など)を修復または置換する医療と密接に関連して用いられる。しばしば、対象とする組織は、適切な機能をはたすために、ある種の機械的、構造的な特性を必要とする。組織工学の用語は、人工的につくられたシステム(例えば、人工膵臓や人工肝臓)内に細胞を用いて、特定の生化学的なはたらきをする試みにも適用されている。再生医療という用語は、組織工学と同義語として使用されることが多いが、再生医療に関わる者は、幹細胞または前駆細胞を用いて組織を生産することに重点を置いている。
概要
ランガーやバカンティが述べるように、組織工学の一般的な定義は「生物の組織や臓器の回復、維持、強化のための、生物学的代用品の開発に向けて、工学および生命科学の原則を適用する学際的な分野」であろう。組織工学はまた、「組織の成長の原理を理解し、臨床用途のために機能的に置換できる組織を作製するためにこれを適用する」とも定義されている。さらに「組織工学の基本的な想定は、自然な生物学のシステムを使い、組織機能の置換、修復、維持、強化を目的とした治療方法の開発においてより大きな成功を可能にすることである」とも説明される。
組織工学の多くの分野における力強い発展により、組織置換部分と実現戦略の新たな組み合わせが得られている。バイオマテリアルや幹細胞、成長因子、分化因子、生物模倣環境における科学進歩によって、実験室において人工的な細胞外マトリックス(足場)や細胞、生物活性分子から組織を組み上げるまたとない機会が産み出されている。現在、組織工学が直面している大きな課題は、移植を目的とした実験室で育てる組織に、より複雑な機能や、生体力学的な安定性をもたせ、血管を新生させることである。組織工学での継続的な成功や、ヒトの組織を代替できる組織をいずれ開発するためには、組織、マトリックス、成長因子、幹細胞、発生生物学、ならびに材料科学とバイオインフォマティクスの研究分野での、工学的研究と基礎研究を統合する必要がある。
2003年にはアメリカ国立科学財団(NSF)は、この分野の歴史を徹底的に解説した「研究分野としての組織工学の誕生」と題する報告を発表した。
例
- 人工気管:「バイオ人工」器官として再生医療として使われた。
- 培養肉: in vitroで培養された食用の肉。培養された動物の筋肉組織。
- 人工肝臓:研究努力により、生きた肝細胞を利用した肝臓支援装置が製造されている。
- 人工すい臓:特に糖尿病の治療のために、すい臓のベータ細胞を用いてインスリンを産生およびその調節することを目標として研究されている。
- 人工膀胱:Anthony Atala アンソニー アタラ (ウェイクフォレスト大学)は、長期実験の一環として人工的に育てた膀胱を7人の患者に正常に移植した。
- 軟骨:研究室で成長した組織は、膝軟骨の修復にうまく用いられている。
- 足場を使わずに育てた軟骨:細胞を育てる「足場」を外から加えずに生成された軟骨。軟骨中の全ての物質は、その細胞自体によって産生された物質である。
- ドリス・テイラーの瓶の中の心臓
- 組織工学により生み出された気道
- 組織工学により生み出された血管
- 人工皮膚:ハイドロゲル中に埋め込まれたヒト皮膚細胞から構築された人工皮膚。戦場の火傷修復のためにバイオプリントされたものもある。
- 人工 骨髄
- 人工骨
- 実験室で成長した陰茎
- 組織工学により生み出された口腔粘膜
- 包皮
細胞ブロック
組織工学は、生きた細胞を、工学材料として利用する。例えば、皮膚の置換または修復には生きた線維芽細胞を使い、軟骨には生きた軟骨細胞を使うなど、それぞれの用途に応じて、いろいろな種類の細胞が使われる。
抽出
血液などの液体の組織からは、細胞は、通常は遠心分離またはアフェレーシスによって抽出される。 固形組織からの抽出はより困難である。 通常、組織を細かく刻み、トリプシンまたはコラゲナーゼなどの酵素で消化して、細胞を保持する細胞外マトリックス(ECM)を除去する。 その後、細胞は自由に浮遊するため、遠心分離またはアフェレーシスを用いて抽出される。トリプシンによる消化は温度に強く依存する。より高い温度ではマトリックスをより速く消化するが、より多くの損傷を与える。コラゲナーゼは温度依存性が少なく、損傷を与える細胞の数は減るが、時間がかかり、試薬が高価になる。
細胞の種類
細胞は、普通それらの起源によって分類される:
- 自己由来の細胞:自己由来の細胞は、それらが再移植される同じ個体から得られる。自己由来の細胞は、拒絶反応および病原体の伝播の問題が最も少ないが、場合によっては、利用できない場合もある。例えば、遺伝病では、適切な自己細胞は利用できない。また、重度のやけどを患っている患者は、緊急を要するので自己細胞を培養している時間がない。老人または高齢者は、じゅうぶんな細胞が得られない場合がある。さらに、この方法では、細胞は患者から採取する必要があるため、外科手術によって、ドナーの採取部位の感染または慢性の疼痛を引き起こす懸念もある。自己由来の細胞は、治療に使用する前に採取した細胞を、培養しなければならないが、これには時間がかかる。最近、骨髄および脂肪からつくられる間葉系幹細胞の使用が増えている。これらの細胞は、骨、軟骨、脂肪および神経を含む様々な組織の細胞の型に分化することができる。脂肪からは、多数の細胞を容易かつ迅速に単離することができるメリットがある。
- 同種異系細胞:自分自身からとった細胞を使うためには、スピード、コストなどを考え現実的ではないため、別のヒトからとった細胞を必要となる前にあらかじめ用意することが考えられている。それは同種異系細胞であり、同じ種のドナーの体に由来する細胞を使う、ということである。インビトロの研究のためのヒト細胞の使用にはいくつかの倫理的制約があるが、ヒト包皮からの真皮線維芽細胞の使用は免疫学的に安全であり、したがって皮膚の組織工学のための有望な選択肢であると考えられている。
- 異種細胞:ほかの種の生物、例えばブタから採取した細胞の使用も考えられている。これらは、異種細胞であり、別の種の個体から単離される。特に、心臓血管インプラントの構築を目的とした実験では、動物細胞がかなり広く使用されている。
- 同系または同起源の細胞は、双子、クローン、またはモデル生物など、遺伝的に同一の生物から単離される。
- 一次細胞とは、生物に由来する細胞。二次細胞は、細胞バンクに由来する細胞。
- 幹細胞は、培養で分裂する能力を有する未分化の細胞であり、異なる形態の特殊化細胞を生じる。さらに幹細胞は、その供給源により、「成体」、「胚」由来の幹細胞に分けられる。また、第一のクラスは多分化能であり、続いて多能性である。胚の最も初期の段階で得られるいくつかの細胞は、全能性である。胚性幹細胞(ES細胞)の使用に関連して依然として大きな倫理的議論が存在するが、iPS細胞が代替するだろう。これらの幹細胞は、病変組織または損傷組織の修復に有用だろうし、新しい器官を育てるために使用され得ると考えられる。
足場
「足場」は、細胞が育つ際に細胞が足場とする材料である。望ましい細胞間相互作用が得られるように、医療目的のための、機能をもった新しい組織の形成に使われるためにつくれる。細胞は、ときに、三次元の組織を形成するため、三次元の「足場」に「播種」される。足場は、天然の組織の細胞外マトリックスを模倣し、in vivo環境を再現し、細胞が自分自身の微小環境に影響を及ぼすことを可能にする。それらは通常、以下の目的の少なくとも1つに役立つ。
- 細胞がくっつきやすくし、移動しやくすする
- 細胞と、生化学的因子を、適度に拡散し、保持する
- 重要な細胞への栄養素と、細胞が発現した産物を、うまく拡散する
- 細胞の挙動を修正するために、特定の機械的な生物学的な影響を与える
2009年には、胸部外科医のThorsten Wallesが率いる学際的なチームが、初めて、移植後も血管からの血流を受ける人工的な気管を患者に移植した。
組織の再建のために、足場はいくつかの特定の要件を満たさなければならない。細胞の「播種」および、栄養素の全体にわたる拡散を容易にするためには、多孔で、孔のサイズも適切である必要がある。足場は、外科的な除去を必要としないように、周辺組織によって吸収されるべきで、「足場」の用途によっては、生分解性は必須の因子である。分解が起きる速度は、組織形成の速度とできるだけ一致しなければならない。これは、細胞が自身の周囲に独自の自然な細胞外マトリックスをつくる間、「足場」は生物の体内で構造的にサポートし、機械的負荷を新たに形成された組織に引き継ぎ、分解される。注射可能性もまた、臨床用途にとって重要である。臓器プリンティングに関する最近の研究では、三次元的な環境を良好に制御することが、実験の再現性を保証し、よりよい結果を出すことを示している。
材料
多くの異なる材料(天然および合成、生分解性および永久的)が研究されている。これらの材料のほとんどは、組織工学が誕生する前に、生体再吸収可能な縫合糸として既に使用され、医療分野ではすでに知られていたものである。これらの材料の例としては、コラーゲンおよびいくつかのポリエステルがあげられる。
新しいバイオマテリアルは理想的な特性と機能をカスタマイズできるように設計されている。つまり、注入性、合成、生体適合性、非免疫原性、透明度、ナノスケールの細い繊維、低濃度、吸収率などを調整できる。PuraMatrixは、MITの研究室のZhang、Rich、Grodzinskyとランガーにより開発され、現在では商業化され、臨床の組織工学に影響を与えている、新しい生体を模倣した足場ファミリーの一つである。一般的に使用される合成材料はPLA(ポリ乳酸)である。これは体内で分解して乳酸を生成するポリエステルで、乳酸は体から容易に取り除かれる天然の化学物質である。同様の材料は、ポリグリコール酸(PGA)およびポリカプロラクトン(PCL)である。それらの分解メカニズムはPLAのそれと同様であるが、PLAに比べて分解速度がPGAは速く、PCLは遅い。これらの材料は、機械的強度や構造面では十分だが疎水性を示す。この疎水性は、それらの生体適合性を阻害し組織を育てる足場として生体内での使用にはむかない。生体適合性の欠如を修正するために、これらの疎水性の材料を、親水性でありより生体適合性のあるハイドロゲルと組み合わせるための多くの研究が行われている。これらのハイドロゲルは優れた生体適合性をもつが、PLA、PCLおよびPGAの構造的な強度に欠ける。 2つの異なるタイプの材料を組み合わせることによって、研究者はより生体適合性のある組織の足場を生成する素材を作り出そうとしている。「足場」は、天然材料から構築されてもよく、特に、天然の素材から採取した細胞外マトリックスのいろいろな誘導体が、細胞増殖を支持する「足場」としての利用できるかが研究されている。コラーゲンやフィブリンなどのタンパク質性の材料や、キトサンやグリコサミノグリカン(GAG)のような多糖類はすべて細胞適合性はあることが示されているが、潜在的な免疫原性の問題が依然として残っている。 GAGの中で、おそらく架橋剤(例えばグルタルアルデヒド、水溶性カルボジイミドなど)と組み合わせたヒアルロン酸は、骨格材料として有望な選択肢の1つである。研究中の足場の別の例は、生体の組織から細胞を除去し、細胞が残した細胞外マトリックスを、足場として使うというものである。2014年には、ナノマテリアルをハイドロゲルに組み込んで、ナノコンポジットの生体材料がつくられ、生物活性のある足場がつくられた。
Ratmirらによる2009年の研究では、生体内のような三次元の組織の培養条件を改善することを目的とし、「細胞外マトリックスとしてのハイドロゲルに細胞を懸濁したものを含浸させた紙を、層状を積み重ね、その後、その層をはがし分析することで、酸素や栄養勾配が変わることで、分子レベルや、遺伝的応答が、三次元的にどう変わるかを調べられた」。培養中の可溶性分子の濃度をうまく勾配をつけることで、従来の3D培養よりも効果的に、これらの勾配の細胞を特徴付けることが可能である。異なる厚さの紙および培地の種類は、様々な実験環境を再現することができる。解体時に、これらのシートは細胞ベースのハイスループットスクリーニングおよび創薬に有用であるかもしれない。
合成
組織工学では細胞を培養する「足場」として使用される多孔質の構造をつくるための多くの異なる方法が、文献で発表されている。これらの手法のそれぞれには利点があるが、欠点のないものは出てきていない。以下にいくつか、多孔質構造をつくる方法を紹介する。
- ナノファイバーの自己組織化
- 複雑な組織を組織工学でつくるための重要な段階としては、生体内の細胞外マトリックス(ECM)と同じサイズと化学的性質をもつ生体材料をつくることであるが、その数少ない方法の1つが「分子の自己組織化」である。さらに、ハイドロゲルの足場は、従来の大きなサイズの足場や、動物組織由来の足場と比較して、生体内での毒性が低く、生体適合性がすぐれている。
- 織物技術
- 不織布をさまざまなポリマーでつくる技術がある。 特に、不織ポリグリコリド構造は、組織工学への応用のために研究されており、いろいろな種類の細胞を増殖させるのに有用であることが判明しているが、高い多孔性を得ることや、規則的な孔径を得ることが困難である。
- Solvent casting and particulate leaching (SCPL)
- この手法は、規則的な多孔性を有する構造物をつくることができるが、厚さが制限される。最初に、ポリマーを適切な有機溶媒(例えば、ポリ乳酸をジクロロメタンに溶解するなど)に溶解し、次いで溶液をポロゲン粒子で満たした鋳型に注ぐ。そのようなポロゲンは、塩化ナトリウム、スクロースの結晶、ゼラチンスフィアまたはパラフィンスフィアのような無機塩であり得る。ポロゲン粒子のサイズは足場の孔のサイズに影響を与えるが、ポリマーとポロゲンの比は最終構造の多孔度に直接相関する。ポリマー溶液が注がれた後、溶媒を完全に蒸発させ、次いで鋳型の内の複合構造体を、適した溶液に浸すことで、ポロゲンを完全に溶解すると、多孔質構造が得られる。SCPLの欠点として、得られる厚さが薄いものに限られるが、また、それ以外の欠点としては、使用した有機溶媒を細胞を播種する前に完全に除去しないといけないことがあげられる。
- Gas foaming
- 有機溶媒や固体のポロゲンを使用する必要性を克服するために、ポロゲンとして気体を使用する技術が開発されている。まず、加熱した金型を用いて圧縮成形することにより、所望のポリマーからなる円盤状の構造体を作製する。 次に、円盤状の構造体をチャンバー内に置き、そこで数日間高圧の二酸化炭素にさらす。チャンバー内の圧力は徐々に大気レベルに戻される。 この手順の間、孔が、ポリマーから出ていく二酸化炭素分子によって形成され、スポンジのような構造ができる。この技術の問題点は、圧縮成形中の高い熱(温度に不安定な材料をポリマーマトリックスとして使用できない)と、孔が相互に接続した構造を形成しない点である。
- 乳化(エマルジョン)と、フリーズドライ(凍結乾燥)
- この技術は、SCPLとは違い、固体のポロゲンの使用を必要としない。最初に、合成ポリマーを適当な溶媒(例えばジクロロメタン中のポリ乳酸)に溶解し、次いで水をポリマー溶液に添加し、2つの液体を混合して乳化液を得る。 2つの相が分離する前に、乳化液を鋳型に流し込み、液体窒素で急速に凍結させる。凍結したエマルションを凍結乾燥し、水や溶媒を除去すると、凝固した多孔性ポリマー構造が残る。乳化および凍結乾燥はSCPLと比較してより迅速な調製を可能にするが(時間を要する浸出工程を必要としないので)、溶媒を使用する必要がある。さらに、孔の径は比較的小さく、孔は不規則である。凍結乾燥自体も足場の製造に一般的に用いられる技術である。特に、コラーゲンのスポンジを調製するために使用され、コラーゲンが、酢酸または塩酸に溶解され、これを金型に流し込み、液体窒素で凍結し、次いで凍結乾燥してつくられる。
- 熱誘起相分離 (TIPS)
- これまで紹介した技術と同様に、この相分離法は昇華しやすい低融点の溶媒を使用する。 例えば、ジオキサンを用いてポリ乳酸を溶解し、その後、少量の水を加えることによって相分離が誘発され、ポリマーが豊富な相と、ポリマーが少ない相に分離される。 溶媒の融点より低温まで冷却し、数日間真空乾燥して溶媒を昇華させると多孔質の足場が得られる。 この相分離は、乳化/凍結乾燥と同じく、溶媒を使用する、孔が不規則であるなどの欠点がある。
- エレクトロスピニング
- マイクロメートルからナノメートルまでの直径の繊維を製造できる汎用性の高い技術。典型的なエレクトロスピニングの装置では、溶液を紡糸口金を通して供給し、高電圧を先端に加える。帯電した溶液内に、静電反発力が蓄積され、細い繊維状の流れを放出させる。反対側に電荷をもつコレクタ板またはロッドに、連続的に繊維がつき、高度に多孔質のネットワークが形成される。この技術の主な利点は、その単純さとバリエーションの容易さである。実験室レベルでは、典型的なエレクトロスピニングを行うために必要なものは、高電圧電源(最大30 kV)、シリンジ、フラットチップニードルおよび導電性コレクタのみである。この理由から、エレクトロスピニングは、多くの研究室での足場製造の一般的な方法となっている。コレクタまでの距離、電圧の大きさ、または溶液の流量などを変更することで、つくる足場の構造を劇的に変えることができる。
- CAD/CAM技術
- 上記の技術の大部分は、気孔率および細孔サイズの制御に関しては制限がある。そのため、コンピュータでの設計や製造技術も、組織工学に導入されている。CADソフトウェアを用いて3次元構造が設計される。 多孔性は、ソフトウェアのアルゴリズムを使用し調整することができる。足場は、ポリマー粉末のインクジェット印刷や、ポリマー溶解液の熱溶解積層法によってつくることもできる。
El-Ayoubiらによる2011年の研究発表に「治療的のための関節軟骨の置換えのための、コンピュータ支援設計(CAD)を使った固体自由形状形成(SSF)を用い、2つの異なる孔サイズをもつ、(生体適合性および生分解性の)ポリ-L-ラクチドマクロポーラスの足場(poly-L-Lactide macroporous scaffolds)を製造するための3Dプロット技術」がある。この研究は、バイオリアクター内の機械的ストレスと、小さい細孔径が、治療において、細胞生存率が高く移植に向いていることを見出した。
- レーザーアシストバイオプリンティング(LaBP)
- 2012年のKochらの研究では、レーザーアシストバイオプリンティング(LaBP)を使用して、天然のマトリックス中に多細胞の3Dパターンを構築することができるかどうか、および生成された構築物が機能して組織を形成するかどうかに焦点が当てられた。LaBPは、少量の生きた細胞の懸濁液を設定された高分解能のパターンで3Dプリンターで配置することができる。 研究者らは、メラノサイト、シュワン細胞、毛包細胞などのいろいろな種類の細胞を3Dプリンターに組み込むことによって、in vitroでのこれらの細胞の挙動その天然のものに類似した微小環境が分析され、創薬および毒物学研究に有用であるとしている。
組織を組み立てる方法
組織工学において大きな問題の1つは、物質輸送に限界があることである。つくられた組織は、一般的に、最初、血液供給が不足しているため、移植された細胞が、生き残ることや、生き残ったとしても適切に機能するのに十分な酸素や栄養素を得ることが困難である。
自己組織化
自己組織化は、重要な役割を果たす。細胞とタンパク質のカプセル化の観点からも、また、設計した組織の構築や細胞の成長のための、適切なスケールでの足場の作製の両方においても、自己組織化は、重要な役割を果たす。ミクロメイソンリー(ミクロ石積み)とは、実験室で成長した細胞を3次元形状に組み立てるための最先端技術である。組織を単一の細胞に分解するためには、通常、一緒に結合している細胞外マトリックスを溶解しなければならない。しかし、それは接着剤の役割を果たしており、それが除去されれば、細胞を自然の組織を構成する複雑な構造に再集合させることは非常に困難である。細胞は容易に積み重ねられないが、「細胞ブロック」は簡単に重ねられる。したがって、micromasonryは、ポリマーでできたキューブ内に生きた細胞をカプセル化し、「細胞ブロック」をつくることから始まる。そのブロックは、任意の形状で自己集合させることができる。
液体を使った組み立て
気体との液体の表面に起こる波を、組織工学に活用する手法が探究されている。この手法は、液体の表面の波を使い、それは数秒で動的に再構成することができ、マイクロスケールで、かつ並列的に達成することができる。ハイドロゲル、細胞、ニューロンを植えたビーズ、細胞スフェロイドを様々な対称構造および周期構造にマイクロスケールで組み立て、細胞の生存率も良好であった。 3次元的なニューラルネットワークの形成は、14日間の組織培養後に達成された。
別の製造技術
3Dプリンターを用いて、臓器、または場合によっては生物全体を印刷することが可能になるかもしれない。最近の革新的な方法では、熱可逆性ゲルをマトリックスとし、細胞の正確な層を、インクジェットタイプの3Dプリンターを用いて構築する。血管を覆う細胞である内皮細胞は、層を積み上げられリングとして「印刷」される。「印刷」後、培養することで、これらがチューブ状に融合し、血管のようになる。
組織やさらには臓器全体を、3次元で高精度につくる試みは、先駆的な複数のプロジェクトや技術によってなされており、細胞の足場や、細胞を層ごとに積み上げ、組織や、臓器そのものをつくろうとしている。この装置はウェイクフォレスト大学再生医療研究所のAnthony Atalaとウェイクフォレスト大学泌尿器科長W.H. BoyceがTEDで示した。この講演では講演中に腎臓が舞台で「印刷」され、観衆に提示された。この技術は、将来的に、移植のための肝臓などの臓器の作製を可能にし、毒物学および他の生物学的研究のための使用も可能になると予想される。
近年、多光子プロセッシング(Multi-Photon Processing、MPP)が、軟骨の作製に使われている。ある種の幾何形状の細孔がほどこされた、三次元の足場に軟骨細胞を播くことで、生体への移植の性能を改善することがわかった。生体適合性は、市販のコラーゲン膜と同等だった。この研究の成果は、六方形の細孔が開いた微細構造骨格に、軟骨細胞を播種することを組み合わせ、有機 - 無機ハイブリッドで軟骨組織をつくれる可能性があることを示唆している。
足場
2013年には、様々な形状の3次元のマトリゲルの足場を使用して、実質的な膵臓オルガノイドがin vitroで生産された。少数の細胞のクラスターは1週間で4万個の細胞に増殖した。クラスターは消化酵素やインスリンのようなホルモンを作り出す細胞へと転換し、膵臓に似た膵臓オルガノイドへと自己組織化した。
細胞は、ゲルのかたさや他の細胞との接触などまわりの環境に影響されやすい。細胞を1つ1つばらばらにすると、オルガノイドは育たず、その発育には最低4個の近接細胞が必要であった。培地組成を改変することで、主に膵臓前駆細胞からなる中空球であったり、膵臓の形態の形成、分化を自発的にする複雑なオルガノイドを産生した。膵臓前駆細胞の維持および拡大には、NotchおよびFGFシグナル伝達が必須であり、生体内でその細胞が受ける、シグナル伝達相互作用の再現が必要である。
オルガノイドは、薬物検査や、インスリン産生細胞を移植医療で使うためのミニ臓器をつくり出せる可能性があると考えられている。
組織培養
多くの場合、機能をもつ組織や、生物学的構造をin vitroで作製するためには、細胞の生存、成長および機能の誘発を促進するために、さまざまな培養を必要とする。 一般に、細胞に基本的に必要なものは、酸素、pH、湿度、温度、栄養素および浸透圧の維持であり、それらは培養の条件によって維持されなければならない。
組織工学において、培養条件をどのようにするかというのは、大きな問題である。標準的な細胞培養においては、「拡散」が、しばしば栄養素および代謝産物輸送の唯一の手段である。 しかしながら、臓器や、組織全体の場合のように培養する物がより大きく複雑になるにつれて、培養物を維持するためには、組織内の毛細血管網の形成のように、他の機構を使用する必要がある。
組織培養では、機能を誘発するために、適切な因子または刺激を与える必要があり、それも問題となっている。多くの場合、単純な培養では不十分である。成長因子、ホルモン、特定の代謝物または栄養素、化学的および物理的刺激が必要な場合がある。例えば、特定の細胞は、酸素濃度の変化に応答し、骨格の分化において、軟骨細胞は、正常な発生の過程で、低酸素状態または低酸素に適応しなければならない。他の例では、内皮細胞のようなものは、血管で遭遇する液体の流れによる、「流れに流されてしまいそうになるストレス(shear stress)」に応答する。圧力パルスなどの機械的刺激は、心臓弁、血管または心膜のようなあらゆる種類の心臓血管組織に有益であるようである。
バイオリアクター
産業バイオリアクターとは異なり、組織工学におけるバイオリアクターは、インビトロで細胞または組織の増殖を促進するために生理学的環境をシミュレートしようとする装置である。生理学的環境は、温度、酸素濃度、二酸化炭素濃度などの多くの異なるパラメータや、あらゆる種類の生物学的、化学的または機械的刺激に及ぶ可能性がある。したがって、組織へ力を加えたり、ストレスを与えたり、または二次元または三次元的に電流をかけるシステムも存在する。
学術および産業研究施設では、成長する組織の特定の生理学的環境(例えば、心臓組織の成長のための屈曲および流体せん断(流れによるストレス))を、再現できるバイオリアクターを開発する。汎用的なバイオリアクター、あるいは特定用途のバイオリアクターも市販されており、静的な化学的刺激、機械的刺激、それらの組み合わせた環境を再現できる。
3D細胞培養に使用されるバイオリアクターは、3次元で細胞を増殖させる目的で特別に設計された、内部湿度と湿度が調節された、小さなプラスチックの円筒形の培養器である。バイオリアクターの中には、ポリエチレンテレフタレート膜のような生物活性合成材料を使用して、スフェロイド細胞を取り囲み、高レベルの栄養素を維持する環境下で培養する。それらは開閉が容易で、スフェロイド細胞を検査のために取り出すことができるが、その間もチャンバは100%の湿度を維持することができる。この湿度は、細胞増殖や、細胞の機能のために重要である。三次元にわたって各方向に等しい細胞増殖を確実にするために、回転するより大きな装置の中にバイオリアクターの培養器が入れられている。MC2Biotekは、細胞の培養器の内で高い酸素濃度を維持するためにガス交換ができるProtoTissueと呼ばれるバイオリアクターを開発した。以前のバイオリアクターとは違って、高い酸素濃度が細胞の成長を助け、正常な細胞呼吸を行うのを助ける。
長い繊維の生成
2013年には、東京大学のグループが、長くて長さ1メートル程度、太さ100 μm程度の細胞を含んだ繊維を開発した。これらの繊維は、2つの層流を形成するマイクロ流体装置を使用して作製された。マイクロ流体装置の2つの層には、(細胞外マトリックスとしてハイドロゲルに播種された細胞、および最終的に塩化カルシウム溶液)の各「層」がある。播種した細胞をハイドロゲル内で数日間培養し、次にそれを生存可能な細胞繊維に取り込む。様々な細胞タイプ、筋細胞、内皮細胞、神経細胞繊維、および上皮細胞繊維を含む細胞外マトリックスを繊維に取り込んだ。このグループは、これらの繊維を織り、繊維をおるのと同様の機構で組織または器官を製造することができることを示した。繊維状の形態は、伝統的な足場設計とは異なる手法であり、筋肉などは繊維細胞から構成されていることもこの手法の有利な点である。
人工臓器
人工臓器とは、特定の臓器の機能の回復を目的として、臓器を取り換えるために、人間に移植または一体化される人工の装置である。人工臓器によって置き換えようとする機能は、ほとんどの場合、生命維持に必須である。学問としての組織工学の最終的な目標は、身体の「棚から離れた」人工臓器と、損傷組織の再生を可能にすることである。患者の幹細胞から人工臓器を作製するために、組織工学の学問領域では、研究が続けられている。例えば、多くの研究が、細胞を取り巻く微小な環境の手掛かりを理解することを目的としている。
脚注
参考文献
- Fountain, Henry (2012年9月15日). “A First: Organs Tailor-Made With Body’s Own Cells”. New York Times. http://www.nytimes.com/2012/09/16/health/research/scientists-make-progress-in-tailor-made-organs.html?pagewanted=all&_r=0 2017年2月22日閲覧。
外部リンク
- Clinical Tissue Engineering Center State of Ohio Initiative for Tissue Engineering (National Center for Regenerative Medicine)
- Pittsburgh Tissue Engineering Initiative
- Tissue Engineering Society of Malaysia Pages
- Tissue Engineering and Regenerative Medicine International Society
- Tissue and Cell Engineering Society
- Malaysia Tissue Engineering Laboratory Pages
- Tissue engineering articles and information
- Tissue Engineering Pages
- Institute for Chemical Process and Environmental Technology Tissue engineered (TE) corneas
- Organ Printing Multi-site NSF-funded initiative
- Team Research Tissue Engineering and Medical Research Programmes
- LOEX Center Université Laval Initiative for Tissue Engineering
- Dedicated issue of Philosophical Transactions B on Tissue Engineering the Heart
- Journal of Tissue Engineering
|
新技術
| |||
|---|---|---|---|
| 分野 |
|
||
| トピック | |||