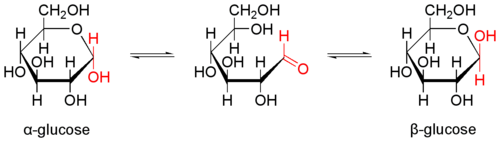
アノマー
アノマー(anomer)とはピラノースあるいはフラノースが環状構造を取ることで発生する立体異性体の関係を示す化学用語である。ピラノースやフラノースは他の糖とグルコシド結合していない状態ではヘミアセタール(ヘミケタール)結合を生成したり、加水分解したりすることで、鎖状構造と環状構造との間で平衡が存在する。アノマーは環状構造を取ったときに、ヘミアセタール(ヘミケタール)を形成するC-1炭素が不斉炭素になることで発生する立体異性体なので、糖が単独で存在する場合はアノマー同士には平衡状態が存在する。
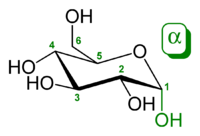
アノマーの違いを表記する為にα-またはβ-の接頭辞が使用される。D-Glucoseをハース投影式で記述した場合、C-1炭素のヒドロキシ基が下向きなアノマーがα-D-Glucoseであり、上向きのアノマーがβ-D-Glucoseに相当する。
命名法
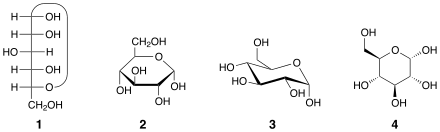
2種のアノマーは、アノマー中心とアノマー参照原子間の立体配置の相関によって、それぞれα(アルファ)あるいはβ(ベータ)と命名される。したがってこれらは相対立体記述子である(カーン・インゴルド・プレローグ順位則)。アノマー中心は、ヘミアセタールではC-1炭素で、ヘミアセタール酸素(環内)に結合しており、ヘミケタールではC-2炭素で、ヘミケタール酸素に結合している。アルドヘキソースおよび小さな糖質では、アノマー参照原子 (anomeric reference atom) は環内で最も遠いキラル中心である(糖がD体かL体かを定義する参照原子)。α-D-グルコピラノースでは参照原子はC-5位である。
もし環状フィッシャー投影式でアノマー中心の環外酸素原子がアノマー参照原子の環外酸素原子(ヒドロキシル基)とシス(同じ側)であった場合、アノマーはαである。もし2つの酸素原子がトランス(異なる側)であった場合、アノマーはβである。環状化合物では、しかしながら、フィッシャー投影式は複雑であり一般的ではない。
もしアノマー炭素と参照原子の絶対立体配置を比較すると、異なる場合(S,RあるいはR,S)がαアノマー、同じ場合が(R,RあるいはS,S)がβアノマーである。
例
α-D-グルコピラノースは、C-1位とC-5位で異なる立体化学(それぞれSおよびR)を有しているのに対して、β-D-グルコピラノースでは同じ配置である(両方ともR)。
α-L-アラビノピラノースでは、C-1とC-4位の絶対立体配置はそれぞれRおよびSであるが、α-D-グルコピラノースとは逆である。アノマー酸素の配置はそれぞれ異っているが、どちらの糖もαである。
 |

|
|
|
|
 |

|
|
|
アノマー化
アノマー化 (anomerization) は、あるアノマーが他のアノマーに変換する過程である。還元糖では、アノマー化は溶液中で直ちに起こる。この可逆的過程の結果、通常2つのアノマー環の平衡状態であるアノマー混合物となる。2つのアノマーの比は、糖の種類に特異的である。例えば、出発物質であるD-グルコースの立体配置にかかわらず、溶液は次第におよそβ-D-グルコピラノシド64%とα-D-グルコピラノシド36%の混合物となる。比が変化すると、旋光度も変化する。この現象は変旋光と呼ばれる。
アノマー化の機構


糖の環状構造は大抵非常に有利であるが、液体単糖(水溶液中の単糖)は常に鎖状構造との平衡状態にある。アルドヘキソースでは、この平衡はC-1とC-5間のヘミアセタール結合の切断と再形成によって起こる。ヘミアセタール結合が再形成される時、C-5位のOH基はC-1位のアルデヒド基のどちらの面からでも攻撃できる。どちらの面から攻撃が起こるかでαあるいはβアノマーが生成するかが決定される。
もしこの反応が2-ピリドンといった両性溶液中で起こると、アノマー化の速度はより速くなる。
物理的特性と安定性
アノマーは構造的に異なっている、したがって異なる安定化および不安定化効果をそれぞれ有している。安定性に寄与する主要な要因は、
- アノマー効果(安定化)
- 電子求引性基(通常酸素あるいは窒素原子)が環のアキシアル配置にあるアノマーを安定化させる。この効果は水のような極性溶媒中ではなくなる。
- 1,3-ジアキシアル相互作用(不安定化)
- 通常アノマー基が環のアキシアル配置にあるアノマーを不安定化させる。この効果はピラノースおよびその他の六員環化合物において特に重要である。この作用は水中での主要な要素である。
- 水素結合
- アノマー基と環内のその他の官能基との水素結合はアノマーを安定化させる。
- 双極子反発
- アノマー基と環内のその他の官能基との双極子反発はアノマーを不安定化させる。
D-グルコピラノシドでは、βアノマーがより安定なアノマーである。この場合の主要な効果は、1,3-ジアキシアル相互作用の欠如である。D-マンノピラノースでは、アノマーヒドロキシル基と環内の隣りの炭素上のヒドロキシル基との双極子反発を避けるためにαアノマーがより安定なノマーである。
アノマーは互いにジアステレオマーであるため、これらの物理的および化学的特性はしばしば異なっている。アノマーの研究で使用される最も重要な物理的特性の一つは比旋光度である。
脚注
関連項目
外部リンク
- Michael W King (2011年10月27日). “Biochemistry of Carbohydrates”. 2011年11月7日閲覧。