エストラムスチン
| |
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Emcyt, Estracyt |
| Drugs.com | monograph |
| MedlinePlus | a608046 |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 | |
| 法的規制 | |
| 投与方法 | By mouth |
| 薬物動態データ | |
| 生物学的利用能 | 44–75% (as estramustine and estromustine) |
| 血漿タンパク結合 | • Estradiol: 98% • Estrone: 96% |
| 代謝 | Liver, intestines |
| 代謝物質 | • Estramustine • Estromustine • Estradiol • Estrone • Phosphoric acid • Normustine |
| 半減期 | • EMP: 1.27 hr • Estromustine: 10–14 hr • Estrone: 15–17 hr |
| 排泄 | Bile, feces (2.9–4.8%) |
| 識別 | |
|
CAS番号 |
4891-15-0 52205-73-9 (sodium) 325726-21-4 (meglumine) |
| ATCコード | L01XX11 (WHO) |
| PubChem | CID: 259329 |
| IUPHAR/BPS | 9076 |
| DrugBank | DB01196 |
| ChemSpider | 227633 |
| UNII | MUZ9585Y7B |
| KEGG | D02398+D06397 |
| ChEBI | CHEBI:68643 |
| ChEMBL | CHEMBL1756 |
| 別名 | EMP; Leo 299; NSC-89199; Ro 21-8837/001; Estradiol normustine phosphate; Estradiol 3-normustine 17β-phosphate; Estradiol 3-(bis(2-chloroethyl)carbamate) 17β-(dihydrogen phosphate) |
| 化学的データ | |
| 化学式 | C23H32Cl2NO6P |
| 分子量 | 520.38 g·mol−1 |
| |
| |
エストラムスチンリン酸エステル(Estramustine phosphate;EMP)は、男性の前立腺癌の治療に用いられるエストロゲン作用とアルキル化作用の2つの作用を持つ医薬品である。細胞増殖抑制作用に関してはエストラムスチンとエストロムスチンのプロドラッグであり、エストロゲン作用に関してはエストラジオールのプロドラッグである。1日複数回、経口または静脈内注射で投与される。日本ではナトリウム塩水和物の経口カプセル剤が承認されている。
EMPの副作用には、悪心、嘔吐、女性化、脱男性化、性機能障害、血栓、心血管系合併症などがある。EMPは標準的な臨床用量において強いエストロゲン作用を有し、その結果顕著な抗ゴナドトロピン作用および機能的抗アンドロゲン作用を有する。
EMPは1970年代初頭に医療用として導入された。米国、カナダ、英国、欧州諸国、日本など、世界各国で販売されている。
効能・効果
日本
海外
米国では「転移性および進行性前立腺癌の姑息的治療」に、英国では「無反応性または再発性前立腺癌の治療」に適応を有している。EMPは通常、ホルモン抵抗性の前立腺癌に使用されるが、ファーストラインの単剤療法としても使用される。前立腺癌におけるEMPの奏効率は、従来の高用量エストロゲン療法と同等と言われている。
EMPは比較的重い副作用と毒性があるため、特に今日の欧米諸国では前立腺癌の治療にはほとんど使用されていない。その結果、またリュープロレリンのようなゴナドトロピン放出ホルモン調節薬(GnRH modulators)の副作用が乏しいことから、EMPはほとんど見放されていた。しかし、臨床研究の成果により、前立腺癌の治療薬としてEMPが再び注目されるようになった。
EMPは、140~1,400mg/日の用量で経口投与される。280mg/日 などの低用量は、高用量と同等の効果を示すが忍容性が改善され、毒性が減少することが判明している。静脈内投与の用量は、240から450mg/日である。
EMPおよびポリリン酸エストラジオールやエチニルエストラジオールなどのエストロゲンは、GnRH調節薬、酢酸アビラテロン、エンザルタミドなどの新しい治療法よりも遥かにコストが低い。さらにエストロゲンは、例えば骨粗鬆症や骨折、火照り、認知、代謝状態などの点で、他のアンドロゲン除去療法よりも大きな利点を提供する可能性がある。
EMPは、前立腺癌の男性におけるGnRH作動薬療法開始時のテストステロンの一過性上昇を防ぐためにも使用される。
禁忌
次の患者には禁忌である。
- 製剤成分、エストラジオールまたはナイトロジェンマスタードに過敏症の既往歴のある患者
- 血栓性静脈炎、脳血栓、肺塞栓などの血栓塞栓性障害、虚血などの重篤な冠血管疾患、またはその既往歴のある患者
- 重篤な肝障害のある患者
- 重篤な血液障害のある患者
- 消化性潰瘍のある患者
海外では体液貯留にも禁忌とされる。
副作用
重大な副作用として、
- 呼吸困難を伴う顔面、舌、声門、喉頭の腫脹
が知られている。
EMPの副作用は、全体的に比較的重いと言われている。EMPの副作用で最も多いのは、嘔気、嘔吐、下痢などの消化器系の副作用で、男性の40%に嘔気・嘔吐が見られると報告されている。これらは通常、軽度または中等度であり、吐き気および嘔吐は予防的な制吐薬投与で管理できる。しかしながら、EMPによる消化器系副作用が重篤な場合には、投与量の減量または治療の中止が必要となる場合がある。EMPの副作用として最も一般的なものは悪心・嘔吐であるが、女性化乳房(男性の乳房の発達)はEMP治療を受けた男性の83%に見られると報告されており、勃起不全の発生率は女性化乳房のリスクと同等かやや低い可能性があるとされている。原則として、女性化、女性型脂肪分布、脱男性化およびインポテンスは、高用量エストロゲン療法を受けた男性のほぼ100%に生じると言われている。また、EMP治療を受けた男性では、性行為の減少が報告されている。これらの副作用は、高いエストロゲン濃度と低いテストステロン濃度に起因している。乳房への予防的照射は、エストロゲンによる女性化乳房の発生率と重症度を減少させることができる。
EMPの重篤な副作用は、肺塞栓症、深部静脈血栓症、脳卒中、血栓性静脈炎、冠動脈疾患(虚血性心疾患;心筋梗塞など)、体液貯留を伴う鬱血性心不全などの血栓塞栓および心血管系合併症である。EMPはジエチルスチルベストロールと同様に心血管毒性を生じるが、低用量での比較では程度が低い(例えば、EMP 280mg/日 経口投与 vs. ジエチルスチルベストロール 1mg/日 経口投与)。また、前立腺癌の病態は血栓塞栓症のリスクを高め、ドセタキセルとの併用は同様に血栓塞栓症のリスクを悪化させる可能性がある。臨床試験のメタアナリシスでは、EMPを使用した場合の血栓塞栓症の全リスクは4~7%であり、EMPを使用しない化学療法レジメンの0.4%に比べ、相対的に高いことが判明している。血栓塞栓症は、毒性によるEMP投与中止の主な原因となっている。アスピリン、ワルファリン、未分画ヘパリン、低分子量ヘパリン、ビタミンK拮抗薬などの抗凝固療法は、EMPおよびジエチルスチルベストロールやエチニルエストラジオールなどの他のエストロゲンによる血栓塞栓症のリスクの低減に有用であろう。
肝機能検査異常はEMPでよく見られるが、この薬で重度の肝機能障害が発生することはまれである。中枢神経系の副作用はほとんど見られないが、非常に高用量のEMP(20~140mg/kg/日)を3~6カ月間投与したサルでは、脳室拡大と神経細胞の色素沈着が報告されている。EMPは、正常な脳組織では細胞増殖抑制作用を示さないと思われる。臨床試験でEMPを投与された女性において、軽度の婦人科領域出血が数例観察されている。EMPは、細胞障害性抗悪性腫瘍剤およびナイトロジェンマスタード剤の中では比較的忍容性が高く、骨髄抑制などの重大な血液毒性や胃腸毒性、他の顕著な毒性を伴うことはほとんどないかまったくない、と記述されている。骨髄抑制、白血球減少および好中球減少を引き起こすことが多い他の多くの静注用薬剤とは対照的に、EMPは副作用として実際に白血球増多を引き起こす。
EMPを280mg/日、150日間経口投与した小規模な低用量試験では、胃腸の刺激性が男性の15%に見られるだけで、忍容性は著しく改善され、重篤な心血管毒性や深部静脈血栓症の発生は見られなかった。また、一過性の軽微な肝酵素上昇以外の副作用は認められなかった。これらの知見は、前立腺癌の治療において、高用量よりも低用量の経口EMPがより安全な選択肢となる可能性を示唆している。
相互作用
EMPは、アミトリプチンやイミプラミンなどの三環系抗うつ薬の有効性と毒性を高めることが報告されている。牛乳などの乳製品や各種栄養補助食品、制酸薬などのカルシウム、アルミニウム、マグネシウムを含む製品をEMPと同時に摂取すると、EMPとこれらの金属の間に不溶性の錯体やリン酸塩が形成され、EMPの吸収、ひいては経口生物学的利用能が著しく損なわれる可能性がある。ACE阻害薬を同時に服用している場合、血管浮腫のリスクが増加する可能性がある。
作用機序
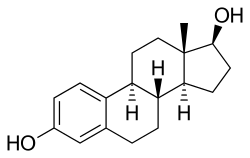
EMPは、エストラジオール ノルムスチンリン酸エステルとも呼ばれ、エストロゲンエステルかつナイトロジェンマスタードエステルである。エストロゲンであるエストラジオールに、ナイトロジェンマスタードであるノルムスチンとリン酸がエステル結合している。薬力学的には、エストラムスチン、エストロムスチンおよびエストラジオールのプロドラッグである。エストラジオールのプロドラッグとして、EMPはエストロゲンであり、従ってエストロゲン受容体の作動薬である。EMP自体は、エストロゲン受容体に対して非常に弱い親和性しか有していない。C3ノルムスチンとC17βリン酸エステルの存在により、エストラジオールより分子量が約91%大きい。EMPはエストラジオールのプロドラッグであるため、エストラムスチンとエストロムスチンによる付随的な細胞増殖抑制活性を有するものの、天然かつ生物学的に同一な形態のエストロゲンと考えることができる。
EMPは、二重の作用機序で作用する。1) 多くの作用を介した直接的な細胞増殖抑制活性、2) エストロゲン受容体を介した抗ゴナドトロピン作用および機能的な抗アンドロゲン作用を介した高用量エストロゲン療法の一形態、である。EMPの抗ゴナドトロピン作用および抗アンドロゲン作用には、性腺のアンドロゲン産生を強く抑制してテストステロンなどのアンドロゲンの循環血中濃度を低下させ、性ホルモン結合グロブリン血中濃度を大幅に上昇させて循環血中の遊離アンドロゲンの割合を大きく減少させる効果に加え、前立腺細胞における直接的抗アンドロゲン作用も寄与している。経口EMPによる遊離アンドロゲン指数は、除睾術に比べ、平均4.6倍低いことが判明している。このように、EMP療法は、睾丸摘出術に比べ、かなり強力なアンドロゲン遮断をもたらす。エストラムスチン、エストロムスチン、エストラジオール、エストロンなどのEMPの代謝物は、アンドロゲン受容体の弱い阻害薬(EC50 = 0.5~3.1 μM)として働くことが知られているが、その臨床的意義は判っていない。
EMP治療中は、極めて高濃度のエストラジオールおよびエストロンが発生する。EMPのエストロゲン代謝物は、その最も一般的な副作用と心血管系毒性の原因となっている。EMPは、幾つかの論文で比較的弱いエストロゲン作用を有すると記述されている。しかし、臨床試験において、高用量のジエチルスチルベストロールおよびエチニルエストラジオールと、乳房圧痛、女性化乳房、心血管系毒性、肝臓タンパク質合成の変化、テストステロン抑制などのエストロゲン作用の割合および程度は本質的に同じであることが示された。EMPのエストロゲン活性が比較的弱いという考え方は、EMPがラットにおいてエストラジオールの100分の1の向子宮性作用を有するという動物実験に基づいており、また、ヒトにおいて臨床的に使用されるEMPの非常に高い用量が考慮されていない可能性がある。
EMPの細胞増殖抑制作用の作用機序は複雑であり、部分的にしか解明されていない。EMPは主に有糸分裂阻害剤であり、細胞周期の有糸分裂期に関与する機構を阻害すると考えられている。具体的には、微小管関連タンパク質やチューブリンに結合し、微小管の脱重合(エストラムスチンのKd = 10~20 μM)を生じ、その結果、細胞分裂をG2/M期(特にM期)で停止させる。EMPは当初、ナイトロジェンマスタードであるノルムスチンのプロドラッグとして細胞増殖抑制作用を発揮すると考えられており、抗悪性腫瘍薬(アルキル化剤)であると考えられていた。しかしその後の研究により、EMPにはアルキル化作用がないこと、微小管に対するEMPの影響はエストラムスチンとエストロムスチンによりもたらされノルムスチンやエストラジオール単独では微小あるいは無視できる程度の影響しかないことが判明した。このように、カルバミン酸エステル結合を含むエストラムスチンおよびエストロムスチン構造のユニークな性質が、EMPの細胞増殖抑制効果に関与しているようである。EMPは、その抗有糸分裂作用に加えて、アポトーシスの誘導、DNA合成の妨害、核基質の相互作用、細胞膜の変化、活性酸素種(酸素フリーラジカル)の誘導、およびおそらくはさらなるメカニズムなど、他の細胞障害性作用をももたらすことが判明している。EMPは、前立腺癌や神経膠腫の細胞において放射線増感作用を示し、放射線治療に対する感受性も向上させることが判っている。
EMPの細胞障害性代謝産物は、前立腺癌細胞などにおいて選択的に組織内に蓄積される。これは、前立腺癌、神経膠腫、悪性黒色腫、乳癌細胞で検出されたプロスタチンまたは前立腺分泌タンパク質(PSP)としても知られる特異的なエストラムスチン結合タンパク質(EMBP)(エストラムスチンに対するKd=10~35 nM)の存在によるものではないかと考えられている。EMPは組織選択性があるため、健康な組織では細胞増殖抑制効果がほとんどないと言われており、その組織選択性が前立腺癌細胞に対する治療的細胞増殖抑制効果に関与していると思われる。
EMPは当初、エストロゲンとノルムスチンの二重エステルプロドラッグとして開発された。エストロゲン受容体への親和性により、エストロゲン標的組織、即ちエストロゲン受容体陽性の腫瘍細胞に選択的に蓄積されるアルキル化抗悪性腫瘍薬となり、その結果、アルキル化剤であるノルムスチンをこれらの組織に優先的に送達し、健康な組織における細胞障害性作用を低減することができ、その結果、有効性と忍容性が改善されると考えられた。しかし、その後の研究により、ノルムスチンエステルの開裂は非常に限られており、開裂速度も遅く、EMPにはアルキル化活性がないことが判明した。さらに、エストラムスチンとエストロムスチンは、エストロゲン受容体への親和性ではなく、異なるEMBPへの親和性によって、エストロゲン標的組織に優先的に蓄積されるようである。
エストラジオールが極めて高く、妊娠に近い状態にあることが、EMP治療を受けた人に見られる白血球増多の原因である可能性がある。この副作用は、骨髄抑制、白血球減少および好中球減少を引き起こす他のほとんどの細胞毒性薬剤とは対照的である。
抗ゴナドトロピン作用
EMPを280mg/日 投与すると、男性のテストステロン値を20日以内に去勢域(30ng/dLまで)に、30日以内に低去勢域(10ng/dLまで)に抑制することが確認されている。同様に、EMP 70mg/日の投与では、4週間以内にテストステロンレベルを去勢範囲に抑制した。
薬物動態
| 代謝物 | 血漿中濃度 | 比率 |
|---|---|---|
| エストラムスチン | 20–23ng/mL | 1:9.6–9.8 |
| エストロムスチン | 191–267ng/mL | |
| エストラジオール | 4.9–9ng/mL | 1:9.4–11.8 |
| エストロン | 71–85ng/mL | |
| 出典 | ||
| 代謝物 | 濃度比 |
|---|---|
| エストラムスチン | 6.3±2.9 |
| エストロムスチン | 1.1±0.4 |
| エストラジオール | 1.7±1.1 |
| エストロン | 1.1±0.5 |
| 出典 | |
EMPは経口投与されると、消化器内の最初の通過点でホスファターゼにより迅速かつ完全に脱リン酸化され、エストラムスチンになる。また初回通過中に、17β-ヒドロキシステロイドデヒドロゲナーゼにより部分的ではあるがかなり酸化され、エストロムスチンに変換される。このように、EMPはエストラムスチンおよびエストロムスチンとして循環血中に到達し、EMPの主要代謝物はエストロムスチンである。エストラムスチンとエストロムスチンの内の約10~15%のみが、ノルムスチンエステルの加水分解を経て、それぞれエストラジオールとエストロンにさらにゆっくりと代謝される。この反応はカルバミダーゼによって触媒されると考えられているが、その酵素をコードする遺伝子は明らかにされていない。EMPから生成されるノルムスチンの循環血中濃度は極僅かである。カルボン酸基の開裂によるノルムスチンからのナイトロジェンマスタードガスの放出は証明されておらず、発生しないようである。EMPの経口バイオアベイラビリティは低く、これは徹底的な初回通過代謝(特にEMPの脱リン酸化)に起因する。エストラムスチンおよびエストロムスチンとしてのEMPの経口バイオアベイラビリティは44~75%であり、吸収が不完全である可能性が示唆されている。何れにせよ、EMPの経口投与量とエストラムスチンおよびエストロムスチンの循環血中濃度の間には直線的な関係が存在する。EMPの経口投与と同時にカルシウム、アルミニウムまたはマグネシウムを摂取すると、腸からの吸収が低下するためバイオアベイラビリティが著しく損なわれ、低用量での治療効果が阻害される可能性がある。
前立腺癌の男性にEMP420mgを単回経口投与した処、エストロムスチンの最大値は310~475ng/mLで、2~3時間後に到達した。280mg/日のEMP経口投与によるエストラジオール濃度は、治療開始後1週間以内に非常に高い濃度まで上昇することが判明している。EMP治療中のエストラジオールとエストロンの循環血中濃度は、男性ではそれぞれ100倍以上、1,000倍以上と正常値を上回ることが報告されている。エストラムスチンとエストラジオールの循環血中濃度は、それぞれエストロムスチンとエストロンより著しく低く、両者の比率は約1:10である。それにも拘らず、EMP療法中のエストラジオール濃度は5~40ng/mLの範囲で、妊娠中期から後期にかけての妊婦の血中濃度と同様であるように思われる。経口投与で循環血中に未変化のEMPは見られない。
EMPの薬物動態は、静脈内注射の場合とは異なる。EMP300mgを単回静脈内注射した場合、最初の8時間はEMPの濃度がその代謝物の濃度より高かった。これは、初回通過代謝がバイパスされたためと考えられる。しかし,投与後24時間までには,未変化体のEMPは循環血中に検出されなくなった。EMPの血漿蛋白結合率は高い。エストラムスチンは腫瘍組織、例えば前立腺癌や神経膠腫組織に蓄積され、これらの組織におけるエストラムスチンレベルは血漿中よりもはるかに高い(例えば、それぞれ6.3-および15.9倍)。逆に、腫瘍と血漿中のエストロムスチンの濃度は同程度である(それぞれ1.0倍と0.5倍)。エストラムスチンとエストロムスチンは脂肪組織に蓄積されるようである。
EMPの経口投与によるエストロムスチンの消失半減期は平均13.6時間であり、その範囲は8.8時間から22.7時間であった。一方、エストロムスチンの静脈内注射による消失半減期は10.3時間であり、その範囲は7.36時間から12.3時間であった。比較のため、エストロンの対応する消失半減期は、経口投与で16.5時間、静脈内投与で14.7時間であった。エストラムスチンおよびエストロムスチンは主に胆汁中に排泄され、その結果、糞便中に排出される。尿中に排泄されることはないと考えられている。

化学的特徴
EMPは、エストラジオール3-ノルムスチン-17β-リン酸または3-(ビス(2-クロロエチル)カルバミン酸)エストラジオール-17β-(リン酸二水素) としても知られており、合成エストランステロイドでエストラジオールの誘導体である。エストロゲンエステルであり、具体的には、EMPはエストラジオールのC3ノルムスチン(ナイトロジェンマスタード-カルバミン酸部位)エステルおよびC17βリン酸エステルのジエステルである。EMPは、ナトリウム塩またはメグルミン塩として提供される。EMPは、硫酸エストラジオールや吉草酸エストラジオールのような他のエストラジオールエステルと化合物として類似しているが、ナイトロジェンマスタードエステル部分の存在が異なっている。EMPに類する抗悪性腫瘍薬としては他に、上市されていないものの、アレストラムスチン、アトリムスチン、酢酸シテストロール、エストラジオールマスタード、ICI-85966、フェネストロールなどがある。
リン酸エステル部分の親水性により、EMPは水溶性の高い化合物である。これは、他のほとんどのエストラジオールエステルが脂肪酸エステルなどの親油性化合物であり、水にとても溶けがたいのとは対照的である。EMPとは異なり、エストラムスチンは親油性が高く、実質的に水に溶けず、イオン化不可能である。EMPのリン酸エステルは、水溶性を高め、静脈内投与を可能にするために分子内に取り込まれたものである。
歴史
EMPは1960年代半ばに初めて合成され、1967年に特許を取得した。当初は乳癌の治療薬として開発された。EMPのアイデアは、放射性同位元素で標識されたエストロゲンが乳癌組織に取り込まれ、蓄積されることにヒントを得たものであった。しかし、乳癌女性におけるEMPの最初の臨床所見は期待外れであった。その後、放射性同位元素で標識されたEMPがラットの前立腺に取り込まれ蓄積されることが判明し、前立腺癌の治療に再利用されるに至った。EMPは、1970年代初頭に前立腺癌の治療薬として導入され、1981年に米国で承認された。当初、EMPは静脈注射用として発売された。その後、経口剤が発売されて静脈内投与はほぼ中止され、経口剤に切り替わった。日本では1983年5月に経口剤が発売された。
調査研究
EMPは、神経膠腫や乳癌など、他のがんの治療法として研究されている。神経膠腫の患者では、治療開始後3ヶ月間でQOL(生活の質)をわずかに改善することが確認されている。
参考資料
関連文献
- “The mechanism of action of estramustine”. Semin. Oncol. 10 (3 Suppl 3): 21–6. (September 1983). PMID 6364362.
- “Estramustine phosphate (Estracyt): experimental and clinical studies in Europe”. Semin. Oncol. 10 (3 Suppl 3): 27–33. (September 1983). PMID 6364363.
- “Metabolic aspects and actions unique to Estracyt”. Semin. Oncol. 10 (3 Suppl 3): 3–15. (September 1983). PMID 6364364.
- “Immunological effects of diethylstilbestrol and estramustine phosphate”. Scand J Urol Nephrol Suppl 83: 1–32. (1984). PMID 6387896.
- “Estramustine phosphate sodium”. Drug Intell Clin Pharm 18 (5): 368–74. (May 1984). doi:10.1177/106002808401800502. PMID 6373212.
- “Metabolic parameters of Estracyt pertinent to its effects in prostatic cancer”. Urology 23 (6 Suppl): 11–21. (June 1984). doi:10.1016/S0090-4295(84)80092-8. PMID 6375075.
- “Clinical pharmacokinetics of estramustine phosphate”. Urology 23 (6 Suppl): 22–7. (June 1984). doi:10.1016/S0090-4295(84)80093-X. PMID 6375076.
- “Specific binding of estramustine to prostatic proteins”. Urology 23 (6 Suppl): 34–8. (June 1984). doi:10.1016/S0090-4295(84)80095-3. PMID 6375077.
- “Immunologic effects of estramustine phosphate”. Urology 23 (6 Suppl): 39–45. (June 1984). doi:10.1016/S0090-4295(84)80096-5. PMID 6375078.
- “Mode of action of Emcyt”. Urology 23 (6 Suppl): 46–8. (June 1984). doi:10.1016/S0090-4295(84)80097-7. PMID 6375079.
- “Preclinical pharmacology and toxicology of estramustine phosphate”. Urology 23 (6 Suppl): 6–10. (June 1984). doi:10.1016/S0090-4295(84)80091-6. PMID 6375082.
- “Clinical toxicity and long-term results of Emcyt therapy for prostate cancer”. Urology 23 (6 Suppl): 73–7. (June 1984). doi:10.1016/S0090-4295(84)80103-X. PMID 6375085.
- “Mode of action of estramustine phosphate in hormone dependent and hormone non-dependent prostate cancer”. Prog. Clin. Biol. Res. 185A: 197–202. (1985). PMID 3898129.
- “Estracyt--mode of action and clinical experience”. Prog. Clin. Biol. Res. 243B: 215–9. (1987). PMID 3309981.
- “A current review of the clinical experience with Estracyt”. Prog. Clin. Biol. Res. 243B: 221–5. (1987). PMID 3309982.
- “Estramustine-binding protein in rat and human prostate”. Scand J Urol Nephrol Suppl 107: 56–8. (1988). PMID 3287598.
- “Intracellular effects of estramustine (Estracyt/Emcyt)”. Prog. Clin. Biol. Res. 303: 169–75. (1989). PMID 2674983.
- “Estramustine--a nitrogen mustard/steroid with antimicrotubule activity”. Pharmacol. Ther. 43 (3): 299–319. (1989). doi:10.1016/0163-7258(89)90012-0. PMID 2682681.
- “Estramustine phosphate (Estracyt) in the treatment of prostatic carcinoma”. Int Urol Nephrol 21 (4): 393–7. (1989). doi:10.1007/BF02559635. PMID 2693392.
- “Mechanisms of action and clinical uses of estramustine”. Cancer Invest. 8 (3–4): 375–80. (1990). doi:10.3109/07357909009012056. PMID 2207764.
- “The present role of estramustine phosphate in advanced prostate cancer”. Prog. Clin. Biol. Res. 370: 323–41. (1991). PMID 1924466.
- “Estramustine phosphate and other cytotoxic drugs in the treatment of poor prognostic advanced prostate cancer”. Prostate Suppl 4: 105–10. (1992). doi:10.1002/pros.2990210516. PMID 1574449.
- “Preclinical and clinical perspectives on the use of estramustine as an antimitotic drug”. Pharmacol. Ther. 56 (3): 323–39. (December 1992). doi:10.1016/0163-7258(92)90023-S. PMID 1301594.
- “Estramustine revisited”. Cancer Treat. Res.. Cancer Treatment and Research 78: 163–84. (1995). doi:10.1007/978-1-4615-2007-8_8. ISBN 978-1-4613-5829-9. PMID 8595142.
- “Estramustine phosphate sodium. A review of its pharmacodynamic and pharmacokinetic properties, and therapeutic efficacy in prostate cancer”. Drugs Aging 7 (1): 49–74. (July 1995). doi:10.2165/00002512-199507010-00006. PMID 7579781.
- “Estramustine-based chemotherapy”. Semin. Urol. Oncol. 15 (1): 13–9. (February 1997). PMID 9050135.
- “Pharmacokinetics and pharmacodynamics of estramustine phosphate”. Clin Pharmacokinet 34 (2): 163–72. (February 1998). doi:10.2165/00003088-199834020-00004. PMID 9515186.
- “Necessity of re-evaluation of estramustine phosphate sodium (EMP) as a treatment option for first-line monotherapy in advanced prostate cancer”. Int. J. Urol. 8 (2): 33–6. (February 2001). doi:10.1046/j.1442-2042.2001.00254.x. PMID 11240822.
- Simpson, D; Wagstaff, AJ (2003). “Estramustine Phosphate Sodium”. American Journal of Cancer 2 (5): 373–390. doi:10.2165/00024669-200302050-00013.
- “The use of estramustine phosphate in the modern management of advanced prostate cancer”. BJU Int. 108 (11): 1782–6. (December 2011). doi:10.1111/j.1464-410X.2011.10201.x. PMID 21756277.
- “Chemotherapy with or without estramustine for treatment of castration-resistant prostate cancer: A systematic review and meta-analysis”. Medicine (Baltimore) 95 (39): e4801. (September 2016). doi:10.1097/MD.0000000000004801. PMC 5265899. PMID 27684806. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5265899/.
- Inoue, Takahiro (2018). “Role of Estramustine Phosphate and Other Estrogens for Castration-Resistant Prostate Cancer”. Hormone Therapy and Castration Resistance of Prostate Cancer. pp. 249–256. doi:10.1007/978-981-10-7013-6_26. ISBN 978-981-10-7012-9



