オシメルチニブ
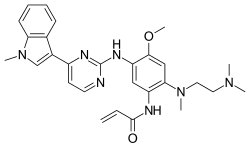
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com | entry |
| 法的規制 |
|
| 投与方法 | Oral tablets |
| 薬物動態データ | |
| 血漿タンパク結合 | Probably high |
| 代謝 | Oxidation (CYP3A) |
| 半減期 | 48 hours |
| 排泄 | Feces (68%), urine (14%) |
| 識別 | |
|
CAS番号 |
1421373-65-0 |
| PubChem | CID: 71496458 |
| DrugBank | DB09330 |
| ChemSpider | 31042598 |
| UNII | 3C06JJ0Z2O |
| KEGG | D10766 |
| ChEBI |
CHEBI:90943 |
| 別名 | AZD9291 |
| 化学的データ | |
| 化学式 | C28H33N7O2 |
| 分子量 | 499.62 g·mol−1 |
| |
| |
オシメルチニブ(Osimertinib、旧名:メレレチニブ、mereletinib)は、第三世代の上皮成長因子受容体(EGFR)チロシンキナーゼ阻害薬(TKI)である。従来のEGFR-TKIでは効果の乏しかったEGFR T790M変異陽性例に対する効果も有している。商品名タグリッソ。
効能・効果
EGFR遺伝子変異陽性の手術不能又は再発非小細胞肺癌
承認取得状況
2015年11月、優先審査保証の後、米国FDAはオシメルチニブをEGFRチロシンキナーゼ阻害薬治療後に増悪した転移性EGFRT790M 変異陽性非小細胞肺癌(NSCLC)の治療薬として迅速承認した。
FDAの承認は承認された方法でEGFR T790M 変異が確認された患者に対する2本の臨床試験の結果に基いて与えられた。
欧州では2016年2月に2本の第II相臨床試験(AURA延長試験およびAURA2試験)に基いて承認された。
日本では2016年3月に欧州と同じ試験の結果を根拠にして承認された。
それまでは他のEGFR-TKI治療歴がありかつT790M変異を有する症例のみが投与対象であったが、2018年8月にFLAURA試験の結果を受けて、T790Mの有無にかかわらず初回治療における適応を取得した。
副作用
重大な副作用に設定されているものは、間質性肺疾患(2.7%)(間質性肺炎、肺臓炎など)、QT間隔延長(2.9%)、血小板減少(12.7%)、好中球減少(8.0%)、白血球減少(9.2%)、貧血(5.1%)、肝機能障害(7.8%)である。
臨床試験での副作用発現率は86.4%であり、主な内訳は、発疹・痤瘡など155例(37.7%)、下痢150例(36.5%)、皮膚乾燥・湿疹など117例(28.5%)、爪障害(爪囲炎を含む)96例(23.4%)などであった。また日本人のみについて見た場合、間質性肺疾患が6.3%に起こっている。
