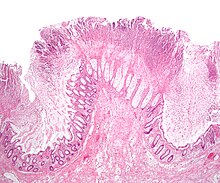
クロストリジウム・ディフィシル腸炎
| クロストリジウム・ディフィシル腸炎、偽膜性大腸炎 | |
|---|---|
 血液寒天培地中のC. difficile コロニー
| |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 |
Infectious disease |
| ICD-10 | A04.7 |
| ICD-9-CM | 008.45 |
| MedlinePlus | 000259 |
| eMedicine | med/1942 |
| MeSH | D004761 |
| GeneReviews | |
クロストリジウム・ディフィシル腸炎(クロストリジウム・ディフィシルちょうえん、英語: Clostridium difficile colitis)(CD腸炎)または偽膜性大腸炎(ぎまくせいだいちょうえん、英語: Pseudomembranous colitis)は、芽胞産生性偏性嫌気性細菌であるクロストリディオイデス・ディフィシル(Clostridioides difficile)の異常増殖の結果として生じる大腸炎である。クロストリジウム・ディフィシル関連下痢症 (C. difficile associated diarrhea, CDAD) と呼ばれる炎症性下痢症の原因となる。潜在性のC. difficile 感染症 (CDI) は、しばしばインフルエンザ様症状と共通点があり、炎症性腸疾患患者の場合には腸炎の再燃を思わせる。C. difficile が産生する毒素は腹痛を伴う巨大結腸症(中毒性巨大結腸症)や下痢を引き起こし、重篤となる場合もある。
なお、本感染症の原因となる「クロストリジウム・ディフィシル」は、2016年にクロストリジウム属から、クロストリディオイデス属(クロストリディオイデス・ディフィシル)へと変更となった。このため、クロストリディオイデス・ディフィシル感染症へと呼び変えることがある。
解説
この大腸炎は、抗生物質の投与等で正常な腸内細菌叢が撹乱されて菌交代症が生ずる事で発生すると考えられている。正常腸内細菌叢を掻き乱す事は、C. difficile に増殖の機会を与えていることになる。つまり、この疾患は抗生物質関連下痢の一つである。
治療法は、非重篤なCDIの場合は、抗生物質を中止するのみである。重篤な場合には、C. difficile に対する抗生物質が投与される。最大で2割の患者で、CDIの再燃が発生する。2011年に米国では29,000名の患者がC. difficile 感染症で亡くなった。
旧属名の「クロストリジウム」はギリシア語で「紡錘」を意味するkloster (κλωστήρ) から、「ディフィシル」はラテン語で「困難」を意味するdifficile から命名された。現在は、Clostridiumに-oides(ギリシャ語で「~の様なもの」の意)を付けた、Clostridioides(クロストリディオイデス属)へと変更されている。
感染経路は腸内に常在した細菌によるもののほか、環境中に存在している芽胞の経口摂取、不顕感染者や発症者の糞便を介した接触感染とされる。また、入院患者では入院期間とC. difficile の検出率が相関する
徴候と症状
CDIの徴候と症状は軽度な下痢から時に致死的な大腸炎までが含まれる。
成人の場合は、臨床予測ルールに採用される最良の症状と徴候は抗生物質暴露後の著明な下痢(24時間以内に3回以上の軟便または水様便)、腹痛、発熱(40.5℃まで)、ならびに馬糞に似た特有の糞臭である。重篤な症例では、腸管潰瘍による血性下痢。臨床的には、白血球増多やCRP高値を伴う。入院患者の場合は、「抗生物質投与後の下痢および腹痛」は感度86%、特異度45%であった。この研究では、細胞毒素検出率は14%であり、陽性適中率は18%、陰性適中率は94%であった。
小児の場合は、最適なCDI検出症状は、「1日3回以上の便通が2日以上継続した後の水性下痢」であり「発熱あり、食欲無し、嘔気および/または腹痛あり」であった。しかし、これらの感染症では重篤な大腸炎を起こしていても下痢がほとんどまたは全くない場合もある。
原因
毒素産生能を有するC. difficileへの顕性感染は、C. difficile 下痢の原因である。
以前はクロストリジウム属とされていたが、2016年にクロストリディオイデス属に変更されている。
C. difficile
| クロストリディオイデス・ディフィシル | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
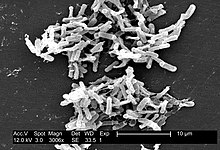 Clostridium difficile
| |||||||||||||||||||||
| 分類 | |||||||||||||||||||||
| |||||||||||||||||||||
| 学名 | |||||||||||||||||||||
|
Clostridioides difficile (Hall & O'Toole, 1935) Lawson & Rainey, 2016 |

顕微鏡下では、細胞の端が膨らんだ特徴的な太鼓バチ状の桿菌として観察される。C. difficile はグラム染色陽性で、酸素不在下でヒト体温の寒天培地上で最適成長する。ストレスを与えると芽胞を形成して休眠し、栄養型では生存できない極端な環境でも生き延びることが可能である。
C. difficile はヒト大腸内に存在しており、成人の2〜5%で検出される。
病原性C. difficile 株は複数の毒素を産生する。その性質が最も良く判っている毒素はエンテロトキシン(腸毒素、Clostridium difficile toxin A)とサイトトキシン(細胞毒素、Clostridium difficile toxin B)である。両者は感染患者に下痢および炎症を発生させるが、その寄与の大きさについては議論がなされている。トキシンAおよびトキシンBは、RhoファミリーG蛋白質をターゲットとして不活性化させるグルコース転移酵素である。トキシンBは低分子量GTP結合Rho蛋白質のADPリボース化の減少と関連するメカニズムでアクチンの脱重合を誘導する。もう1つのトキシンである二元毒素も産生されることが知られているが、疾患における役割は充分には解明されていない。
CDIに対する抗生物質治療はC. difficile の薬剤耐性と細菌学的特性(芽胞形成、偽膜生成)から困難である。シプロフロキサシンやレボフロキサシンなどのニューキノロン系抗生物質に耐性であるC. difficile の新型高毒性株が北米大陸で地理的に分散して集団感染を起こしたと2005年に報告された。アトランタの米国疾病予防管理センター (CDC) は、新型流行株について毒性の上昇、抗生物質への耐性、あるいはその両方について警告を発した。
C. difficile は糞口経路でヒトからヒトへと感染する。この微生物は熱等に耐性を持つ芽胞を形成し、アルコール系の手指消毒液やルーチンに行われる清浄化では殺菌されない。芽胞は臨床環境下で長時間生存する。そのため、C. difficile はほとんど全ての物の表面から検出され得る。一旦芽胞が体内に取り込まれると、芽胞の耐酸性により無傷で胃を通過する。胆汁酸に触れると、C. difficile は“発芽”して栄養型となり、大腸内で増殖を開始する。
C. difficileの病院感染に関連して、院内で少なからぬ濃度で芽胞が存在し入院期間が長くなるほど保菌率が高まる傾向にあり、抗菌薬の使用によって腸内細菌の乱れと菌交代が生じ腸炎が発生しうることや芽胞が消毒に対して高い抵抗性があることが指摘されている。
2005年中に、C. difficile 強毒株が、制限酵素処理解析でBI型、パルスフィールド電気泳動で北米NAP1型、リボタイピングで027型であることが判明した。そのためこの菌株はC. difficile BI/NAP1/027と呼ばれている。
RT027株とRT078株についてはトレハロースの関与の可能性が指摘された (http://news.livedoor.com/article/detail/14146335/)
リスク因子
抗生物質
C. difficile 腸炎の発生は、抗生物質であるニューキノロン、セファロスポリン、クリンダマイシンの使用と強く相関している。
一部の研究者は、日常的な家畜への抗生物質使用がC. difficile などの流行に結び付く危険性があると指摘している。
ヘルスケア環境
感染はほとんどの場合、病院や介護老人福祉施設などの医療関連施設で発生しているが、これらの施設外での感染も増加している。C. difficile の推定保有率は2週間以内の入院の場合は13%、4週間以上の入院の場合は50%と見積もられている。
長期入院している場合や介護施設に入居している場合は、1年以上の入院・入居は菌定着の独立リスク因子である。
胃酸抑制療法
市中CDIの増加率は、胃酸抑制薬の使用に相関している。ヒスタミンH2受容体拮抗薬の使用で感染症のリスクは1.5倍に、プロトンポンプ阻害薬の1日1回の使用で1.7倍に、それを超える頻度での使用で2.4倍に増加する。
病態生理学
あらゆるペニシリン系抗生物質(アンピシリン等)、セファロスポリン、クリンダマイシンなどの抗生物質(前掲に限らない)を全身投与すると、正常な腸内細菌叢が変化する。特に、抗生物質が一部の微生物を殺してしまうと、生き残った競合細菌は、繁殖場所および栄養の点で競争が少なくなり、抗生物質使用前よりも広い場所で旺盛に繁殖する。Clostridium difficile はその様な微生物の一つである。腸内での繁殖に加えて、C. difficile は毒素を産生する。トキシンAとトキシンBを生産しなければ、C. difficile は偽膜性大腸炎を引き起こす可能性は低いと思われる。重症感染症に関連した大腸炎は炎症反応の一部であり、偽膜は、炎症細胞、フィブリン、壊死細胞から成る粘稠な集合体である。
診断
C. difficile 毒素を検出する臨床検査が登場する以前は、大腸内視鏡検査やS状結腸鏡検査が盛んに行われていた。大腸や直腸での「偽膜」形成はクロストリジウム・ディフィシル腸炎を強く示唆するものであったが、確定診断できるものではなかった。偽膜は炎症性のデブリや白血球から構成されており、C. difficile 特異的ではないため、C. difficile 毒素を検出する検査が最初に実施される様になったが、内視鏡検査は今でも実施されている。毒素検査ではトキシンAとトキシンBのみが検査されるが、C. difficile は他の毒素も産生する。検査は100%正確ではなく、偽陰性は稀ではあるが、繰り返し検査したとしても完全に排除することはできない。
サイトトキシン検査
C. difficile 毒素は培養細胞塊に対しては細胞変性効果を示し、特異的な抗血清で見られる中和効果は、新たなCDI診断技術を開発する際に最も標準的な比較対象となっている。長い時間と多くの手間が掛かるが、選択性培地で毒素産生コロニーを発生させ毒素の産生を確かめる方法は検査のゴールドスタンダードであり、感度特異度共に最高である。
トキシンELISA
トキシンAとトキシンBの酵素結合免疫吸着検査法 (ELISA) は、感度63〜99%、特異度93〜100%である。
以前は、1回の下痢症状発生中に糞便サンプルを最大3回採取して検査する事で除外診断できるとされていたが、今ではその方法では不充分であるとされている。C. difficile 毒素は治療が有効であれば一掃される。多くの病院では、産生される事の多いトキシンAのみが検査されている。トキシンBのみを産生する株が多くの病院から見つかっており、A、Bの両毒素を検査すべきである。最初に両毒素を検査しないことは臨床検査の結果確定を遅らせ、しばしば疾患を遷延させ、予後不良を来たす。
その他の糞便検査
糞便中の白血球量やラクトフェリン濃度が検査法として提案された事があるが、何方も正確性に限界がある。
PCR
糞便試料をリアルタイムPCRで分析すると、検出率90%程度、偽陽性4%程度で検査することができる。マルチステップPCR検査アルゴリズムで全般的なパフォーマンスを改善できる。
予防
抗生物質
最も効果的なCDI予防法は、抗生物質の使用適正化である。CDIが多い病院内では、CDIを発症したほとんどの全ての患者で抗生物質が使用されていた。抗生物質の適正使用は容易であるにもかかわらず、約半数の抗生物質使用は不適切なものであった。このことは、病院のほか、診療所、市中、大学内にも当てはまる。不要な抗生物質の使用を制限してCDIが減少する(集団感染か否かにかかわらず)事は、明確に示されている。2011年には、CDI感染症は米国の病院内で見られた医薬品の副作用の内で最多であった。
共生細菌
プロバイオティクスが感染予防や再発防止に有用であるとの報告がある。C. difficile に対する免疫が抑制されていない患者に対してもSaccharomyces boulardii を用いた治療は有用であった。米国感染症学会は2010年には、合併症の危険があるとしてS. boulardii の使用に反対した。しかしその後のレビューでは、治療に伴う有害事象の増加は認められず、治療は全般的に安全であると思われた。
感染制御
微生物伝播を最小限にするためには、厳密な感染(制御)プロトコルが必要である。手袋を着ける、重要性の低い医療用具はCDI感染患者1人にのみ使用して使い捨てる、などの感染制御手順は、予防に効果的である。これは病院内でのC. difficile 拡散を制限できる。加えて、石鹸および水で手を洗うと汚染された手指から芽胞を除去することができるが、アルコール消毒液で手を擦る方法では効果がない。
0.55%次亜塩素酸ナトリウム漂白液で物の表面を拭うと、芽胞が除去され、患者間の伝播が防がれる。蓋付きのトイレを設置し、水を流す前に蓋を閉じる事も汚染リスクを減少させる。
CDI患者はCDI患者のみを集めた部屋に収容するか、個室に隔離すべきである。
一般的な消毒薬はC. difficile 芽胞には無効であり、寧ろ芽胞形成を促進するが、漂白剤の1⁄10水希釈液は、芽胞を殺す事ができる。蒸気化過酸化水素 (HPV) でCDI患者退院後の部屋を消毒すると、次の患者のCDI感染リスクを低下させることができる。この操作でCDI発生率は53%または42%に低下する。紫外線殺菌装置やC. difficile 感染患者退院後専門の病室清掃員を配置すると効果がある。
治療
C. difficile 無症候性キャリアは多い。症状のないこれらのキャリアを治療する事の是非は議論が分かれている。一般に、軽症の症状では治療を要しない。下痢で脱水状態の患者には経口補水療法をすると良い。また、腸内細菌叢を正常化させるプロバイオティクスの利用は有効と考えられる。
医薬品投与
多くの異なる抗生物質がC. difficile 治療に用いられ、いずれもそれなりの効果がある。
- メトロニダゾールは安価であり、軽度から中等度の疾患の選択肢となる。通常は1日3回10日間服用する。2012年から国内で保険適用となった。
- 経口バンコマイシンは重度の疾患に用いられる。またメトロニダゾール投与後に下痢が続いている場合にも使用される。メトロニダゾールは先天性障害を引き起こす危険性があるので、妊婦のC. difficile 感染症については重篤度を問わずバンコマイシンが用いられる。バンコマイシンとメトロニダゾールの有効性は同等であると思われる。通常バンコマイシンは、1日4回10日間投与する。
- フィダキソマイシンは軽度から中等度の疾患に対してバンコマイシンと同等の効果を持つ。バンコマイシンと同程度の忍容性があり、症状再燃のリスクは少ない。再発性感染症で他の抗生物質が無効な場合に使用すべきである。
ロペラミドなどの止瀉薬を用いて下痢を止めようとすると却ってC. difficile 感染症を悪化させるので勧められない。イオン交換樹脂であるコレスチラミンはトキシンA、トキシンBを共に吸着除去するので排便回数を減少させる効果があり、脱水を予防できる。コレスチラミンとバンコマイシンの併用が推奨される。免疫抑制状態にある患者を治療する最後の手段は、免疫グロブリン療法 (IVIG) である。また、毒素に対する中和抗体としてベズロトクスマブ(商品名ジーンプラバ)が日米欧で承認されており、再発抑制のために上記治療薬と併用される。
共生細菌
治療におけるプロバイオティクスのエビデンスは不充分であるので、標準治療に上乗せして用いたり単独で用いてはならない。またその一方で、クロストリジウム・ブチリカム(宮入菌)の有用性は、高病原性菌の増殖と拮抗することによってクロストリジウム・ディフィシル腸炎の原因菌である高病原性クロストリディオイデス・ディフィシルの増殖を妨害するその能力に主として起因している。
糞便移植
便微生物移植または糞便移植法と呼ばれている治療法では、抗生物質が効かなくなった患者の約85%から90%で有効である。これは感染症再発の原因である腸内細菌の不均衡を是正するために健康なドナーから正常な腸内細菌叢を移植する方法である。この方法で抗生物質で破壊された腸内の菌環境が再構築され、C. difficile 増殖が抑制される。副作用は、少なくとも治療後直ぐにはほとんど起こらない。
飲み薬の形での腸内細菌移植の試みで効果が上がっている。米国では実施可能な施設はあるが、2015年時点では米国食品医薬品局の認可は得られていない。
手術
重症C. difficile 大腸炎の場合、結腸切除術が予後を改善し得る。どの様な患者の場合に手術で最良の結果が得られるのかを見極めるために、専用の判定基準が定められている。
予後
メトロニダゾールまたはバンコマイシンでの最初の治療後、C. difficile 感染症は、約2割の人々で再発する。再発率は、回数を重ねる毎に4割、6割と増加していく。
疫学
C. difficile 下痢症は北米では毎年10万人当り8人の割合で発生していると推計されている。入院患者に限って計算すると、千人当り4〜8人である。2011年には、米国内で50万人が感染し、2万9千人が死亡した。ニューキノロン耐性株が出現した事で、C. difficile 関連死は2000年から2007年での米国での年間死亡数が5倍となった。
歴史
1935年にホール(Hall)とオトゥール(O'Toole)が発見した際には、菌の単離が困難であり、コロニー形成が非常に遅かった事から、Bacillus difficilis と命名された。この名称は1970年に変更された。
偽膜性大腸炎は1978年に初めてC. difficile 感染症の合併症として記述され、偽膜性大腸炎患者から毒素が検出されてコッホの原則に合致する処となった。
治療法の研究開発
- CDA-1およびCDB-1(MDX-066とMDX-1388、MBL-CDA1とMBL-CDB1、ActoxumabとBezlotoxumab等の別名がある)は研究中の1対のモノクローナル抗体であり、C. difficile のトキシンAとトキシンBをそれぞれ中和し、CDIを治療する。CDIを既存の抗生物質で治療する場合の補助療法に位置付けられている。このうちトキシンBに対する中和抗体は、2016年に米国で、2017年には日本で、ベズロトクスマブ(商品名ジーンプラバ)として「クロストリジウム・ディフィシル感染症の再発抑制」に対する適応が承認されている。
- ニタゾキサニドは合成ニトロチアゾリルサリチルアミド誘導体であり、抗原虫薬(クリプトスポリジウムとランブル鞭毛虫)として米国で承認されている。CDIへの効果についてバンコマイシンを対照薬として研究が実施されている
- リファキシミンは米国で臨床使用中の半合成リファマイシン系非全身投与抗生物質である。FDAはCDADの治療について承認している。
- 他のCDI治療薬としては、リファラジル、チゲサイクリン、ラモプラニン、リジニラゾール等が開発中である。
- 虫垂がC. difficile にとって重要な意味を持つか否かについて研究されている。虫垂は腸内の善玉菌の住居であると考えられており、2011年の研究では、C. difficile が腸内に侵入した時に、虫垂がそれに対抗する抗体を増加させる作用があることが示された。虫垂にあるB細胞は移行して成熟し、抗トキシンA IgAおよびIgG抗体を産生し、C. difficile に対抗して善玉菌が生き延びる確率を高めている。
- 毒素を産生しないC. difficile を摂取すると、その後のCDIを予防できるとの結果が得られている。
- clostridium-difficile-関連下痢症 MSDマニュアル