
グラチラマー
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| Drugs.com | monograph |
| ライセンス | US FDA:リンク |
| 胎児危険度分類 |
|
| 法的規制 |
|
| 識別 | |
|
CAS番号 |
147245-92-9 |
| ATCコード | L03AX13 (WHO) |
| PubChem | CID: 3081884 |
| DrugBank | DB05259 |
| UNII |
5M691HL4BO |
| KEGG | D04318 |
| ChEMBL | CHEMBL1201507 |
| 化学的データ | |
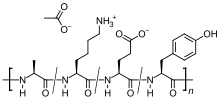
| 化学式 | (C25H45N5O13)n |
| 分子量 | 平均分子量:5,000〜9,000 |
| |
| |
グラチラマー酢酸塩(Glatiramer acetate、別名:Copolymer-1)は多発性硬化症の治療に用いる免疫療法剤である。ミエリン塩基性蛋白質から発見されたペプチドで、Glu、Lys、Ala、Tyr の4種のアミノ酸から成るランダムコポリマーであり、一部が酢酸塩となっている。投与すると免疫系に対してミエリンのデコイとして機能すると思われる。商品名コパキソン。多発性硬化症の再発予防薬として承認されているが、疾患・障害の進行を遅らせる目的の医薬品ではない。観察研究で疾患の進行を遅らせたとの報告があるが、臨床試験として適切に制御された研究ではない。
多発性硬化症の臨床的定義では2つ以上の症状・兆候が必要であるがグラチラマーは症状・兆候が1つでもあれば投与できる。再発寛解型多発性硬化症の治療にも使用できる。皮下注射薬である。
日本では2015年9月に承認された。
組成
モル%で見るとグルタミン酸(13〜15)、リシン(39〜46)、アラニン(8.6〜10)、チロシン(30〜37)で平均分子量は5,000〜9,000、100塩基当り15〜24の残基が酢酸塩を形成している。
効能・効果
効能・効果は「多発性硬化症の再発予防」であるが、進行型多発性硬化症に対する有効性および安全性は確立していない。
2004年のコクランレビューでは、グラチラマーは“MSの治療効果―疾患進行抑制―は全く見られず、疾患再発リスクに実質的な影響を与えない”と結論された。
251名の患者を対象とした2年後の臨床試験では、疾患進行抑止効果は全く示せなかった。
結果としてFDAは、疾患再発回数の減少については承認したが、疾患の進行抑制については承認しなかった。
グラチラマーの投与を継続した患者と中止した患者を15年間追跡調査した結果、継続した患者では再発率が低下し、疾患の進行度および二次進行型MSへの移行が減少したと報告された。しかし追跡調査は臨床試験でないので、比較は不可能であり、結果は無意味である。また長期投与時の安全性は未知である。
2007年の欧州多発性硬化症治療研究会議(ECTRIMS)で報告された2つの臨床試験で、グラチラマー酢酸塩と高用量・高頻度インターフェロン(IF)-β投与とが比較された。その2つの試験(REGARD試験とBECOME試験)では、主要評価項目である「増悪までの期間」を始めほとんどいずれの評価項目でもグラチラマーとIF-βとで差が付かなかったが、MRI画像を用いた疾患進行評価についてはわずかに差があったと主張された。
3年間の二重盲検試験では、一次進行性MSに対するグラチラマー投与は効果がない事が報告された。
FDAは単一脱髄性症状(Clinically Isolated Syndrome、CIS)についてPreCISe試験に基いて承認している。PreCISe試験は最初の臨床症状が発生した患者を対象にした試験であり、多発性硬化症の診断(2つ以上の臨床症状発現)が下される患者を45%減少させた。偽薬群では3年間の内に43%の患者がMSと診断されたのに対して、グラチラマー群では25%であった。
副作用
副作用発現率は、日本国内の試験(17例)で100%、海外の試験(269例)で96.3%(有害事象として)である。日本国内の試験で見られた主要な副作用は注射部位反応(94.1%)(注射部位紅斑(88.2%)、注射部位疼痛(88.2%)、注射部位硬結(76.5%)、注射部位瘙痒感(70.6%)、注射部位腫脹(64.7%)等)であった。その他注射直後反応(注射後の全身症状)が29.4%に発現した。直後反応の内訳は、動悸(17.6%)、呼吸困難(11.8%)、胸痛(5.9%)であった。また海外の試験で見られたその他の直後反応は、血管拡張(23.8%)、頻脈(5.6%)であった。なお、グラチラマーに過敏症の既往歴のある患者は投与禁忌とされている。
添付文書に記載されている重大な副作用は、注射直後反応(41.3%;海外の試験に基づく)、注射部位壊死(頻度不明)、過敏性反応(呼吸困難、気管支痙攣、発疹、蕁麻疹、失神等)(頻度不明)である。
その他5%以上の患者に不安、振戦、悪心、嘔吐、カンジダ症、多汗症、リンパ節症、顔面浮腫が発現する。
これらの副作用は注射後30分以内に出現する。また注射部位の脂肪組織の破壊により皮下脂肪萎縮症が発生することがある。
米国FDAの添付文書に拠ると、重篤な副作用として循環器系、消化器系、肝臓、血液・リンパ系、筋骨格系、神経系、呼吸器系、感覚器系(特に眼)、泌尿生殖器系障害の発現が報告されている。
作用機序
グラチラマー酢酸塩はミエリン塩基性蛋白質から発見された4種のアミノ酸のランダムポリマーの酢酸塩である。作用機序はいくつか提唱されているが不明である。グラチラマーを投与するとT細胞の分布が炎症誘発性Th1細胞優位から炎症抑制性Th2細胞優位に変化する。ミエリン塩基性蛋白質との相似性から考えると、ミエリンに対する自己免疫応答のデコイとして働いていると可能性があるが、血液脳関門を通過しないと考えられ、少なくとも疾患早期においては奏効しないと思われる。臨床試験では、症状増悪の頻度および重症度の軽減が見られている場合がある。
多発性硬化症(MS)に対するグラチラマー酢酸塩の作用機序は完全には解明されていないが、MSの病因と思しき免疫応答のプロセスを改変すると思われる。この仮説はミエリンで中枢神経系に対する免疫応答を誘導した実験性自己免疫性脳脊髄炎(EAE)動物(MSモデル動物)の実験結果から支持される。動物実験およびin vitro 実験系では、グラチラマー特異性サプレッサーT細胞が誘導され、末梢で活性化される。
臨床開発
グラチラマー酢酸塩の有効性と安全性は3本の主臨床試験で示された。1本目の試験は中央登録二重盲検偽薬対照試験であり、50名の患者を対象とした。2つ目の試験は多施設共同二重盲検偽薬対照試験であり、米国の11施設の251名の患者が対象となった。3つ目の試験は多国多施設共同二重盲検MRI試験であり欧州の6ヶ国とカナダから29のMS施設、239名の患者が参加した。
研究開発
グラチラマーが脳マラリアの予防効果を示す事がマウスで示された。
萎縮型加齢黄斑変性(AMD)に対する臨床試験が実施され、グラチラマーが総ドルーゼン(色素斑)面積を減少させることが示された。
