
ヌシネルセン
| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Spinraza, スピンラザ |
| 法的規制 |
|
| 薬物動態データ | |
| 代謝 | DNAエキソヌクレアーゼによる加水分解 |
| 半減期 | 135-177 日間 (脳脊髄液中), 63-87 日間 (血漿中) |
| 識別 | |
|
CAS番号 |
1258984-36-9 |
| ATCコード | None |
| DrugBank | DB13161 |
| ChemSpider | 34983394 |
| UNII |
5Z9SP3X666 |
| KEGG | D10881 |
| 別名 | IONIS-SMNRx, ISIS-SMNRx |
| 化学的データ | |
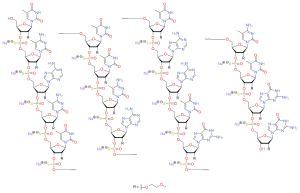
| 化学式 | C234H323N61Na17O128P17S17 |
| 分子量 | 7501 Da |
ヌシネルセン(Nusinersen、国際一般名)は、脊髄性筋萎縮症の治療に用いられる薬品である。2016年12月、この病気の初めての承認薬となり、スピンラザ (Spinraza)の商標で発売された。日本では2017年7月3日製造販売承認を得た。この薬品は、SMN1遺伝子の変異と関連する脊髄性筋萎縮症の治療に用いられる。くも膜下注射によって、中枢神経系に直接投与される。
薬理学
化学修飾
アンチセンス核酸の易分解性に対応する核酸化学修飾には、リン酸部分、糖部分、塩基部分の修飾と3つに大別される。ヌシネルセンは2'-MOE修飾を用いて完全糖鎖修飾型かつホスホロチオエートを用いた完全リン酸修飾型のヌクレオチドである。そのため核酸分解酵素に認識されにくく、脳脊髄液中の終末相半減期は135~177日と生体内で長い半減期を持つ。
作用機構
脊髄性筋萎縮症発症には複数の遺伝的病因が存在するが、約95%以上の患者ではSMN1(survival motor neuron 1)遺伝子の機能喪失を引き起こす突然変異が存在する。この突然変異によってSMN蛋白質の発現量が低下し、運動ニューロンの細胞死を引き起こすことで、体幹や四肢の筋力低下や筋萎縮が進行する。SMN1遺伝子には同一アミノ酸配列をコードする相同遺伝子としてSMN2遺伝子が存在する。両遺伝子間には11塩基の相違があるが、この違いによりSMN2遺伝子ではSMN1遺伝子と異なるスプライシングが起きるため、SMN2遺伝子から産出されるSMN蛋白質のほとんどは不安定な不完全長の蛋白質となる。そのためSMA患者においてSMN2遺伝子から完全長転写物の産出量を増加させれれば、不足している完全長のSMN蛋白質の量を補うことができると考えられていた。ヌシネルセンはSMN2 mRNA前駆体エクソン7近傍に位置するイントロン7の特定部位と結合する。ヌシネルセン非存在下では選択的スプライシングを制御するヘテロ核リボヌクレオ蛋白質(hnRNP)がmRNA前駆体上に結合しておりエクソン7がスキップされることで不完全長のSMN蛋白質が産出される。一方、ヌシネルセンの存在下ではhnRNPのmRNA前駆体上への結合が阻害されるためエクソン7の含有が促進され、最終的に完全長のSMN蛋白質産出量が増加する。ヌシネルセンと同様のスプライシング制御を行う低分子化合物も開発されており、実用化されれば経口薬で治療可能になる可能性もある。
薬物動態学
この薬品は、中枢神経系及び末梢神経系中に分布する。 脳脊髄液中の半減期は135~177日と生体内で長い半減期を持つ、血漿中で63から87日間と推定されている。代謝は、DNAエキソヌクレアーゼによる加水分解によって行われ、CYP450とは相互作用しない。ヌシネルセン及びその代謝物の主な排出経路は、恐らく尿による排出である。
副作用
他の核酸医薬と同様、血液凝固異常、血小板減少症、腎障害等のリスクがある。
臨床試験では、ヌシネルセンによる治療を行った人々は、上気道及び下気道の感染症、鬱血、耳感染症、便秘、誤嚥、歯の欠損、脊柱側弯症等のリスクが高かった。また臨床試験を行った1名の乳児は食塩の補充が必要なほどの低ナトリウム血症が起こり、何名かの乳児には発疹がみられた。さらに、幼児や子供の成長が阻害されるリスクもある。高齢者の臨床試験では、最も多い副作用は、頭痛、背痛、脊髄注射による副作用であった。
この薬品に対する抗体を形成する者もいるが、2016年12月の時点では、これが薬品の有効性や安全性にどのような影響を及ぼすかは分かっていない。
臨床応用
ヌシネルセンの有効性は2つの臨床試験で確立した。それはENDEAR試験とCHERISH試験である。ENDEAR試験では生後6ヶ月以内に発症した乳児型SMA患者121例を対象に運動機能と予後を評価し、どちらも改善が認められた。CHERISH試験では6ヶ月以降に発症した2~12歳の遅発型SMA患者126名を対象として運動機能の改善が認められた。
歴史
ヌシネルセンは、コールド・スプリング・ハーバー研究所のアドリアン・クライナーとアイオニス・ファーマシューティカルズ社により共同開発された。研究の一部は、Cure SMAの資金提供によりマサチューセッツ大学で行われた。
2012年から、アイオニス社はバイオジェン社と開発の協業を開始し、2015年にバイオジェン社は、ライセンス料7500万ドル、マイルストーンでの支払い1億5000万ドル、その後のロイヤルティを含めた排他的なライセンス契約を結んだ。さらにバイオジェン社はライセンス取得後の開発費用も支払った。バイオジェン社に提供されたライセンスには、アイオニス社がコールド・スプリング・ハーバー研究所とマサチューセッツ大学から得た知財も含まれた。
2016年11月、アメリカ食品医薬品局の優先審査プロセスの下で新薬申請が受け付けられ、同時に欧州医薬品庁でも申請の受付が行われた。2016年12月には、アメリカ食品医薬品局で、脊髄性筋萎縮症のための初めての薬品として承認された。同様に2017年4月、欧州医薬品庁も脊髄性筋萎縮症の治療薬として、欧州連合内での販売の承認を勧告し、2017年6月、ヌシネルセンの欧州連合での市販が承認された。
社会と文化
ヌシネルセンはアメリカ合衆国および欧州連合において希少疾病用医薬品に指定されている。
ニューヨーク・タイムズ誌によると、スピンラザは、治療初年度の推定費用75万ドル、その後毎年約37.5万ドルの費用を要する「世界で最も高価な医薬品」になりうるとされる。2016年8月、ヌシネルセンのピークの年間売上げは約17億ドルに達すると推計された。
関連文献
- Finkel, Richard S; Chiriboga, Claudia A; Vajsar, Jiri; Day, John W; Montes, Jacqueline; De Vivo, Darryl C; Yamashita, Mason; Rigo, Frank et al. (2016). “Treatment of infantile-onset spinal muscular atrophy with nusinersen: A phase 2, open-label, dose-escalation study”. The Lancet 388 (10063): 3017. doi:10.1016/S0140-6736(16)31408-8.
関連項目
- オナセムノゲンアベパルボベク (商品名: ゾルゲンスマ) - 遺伝子治療薬。