ファージ
ファージ(英: phage)は、細菌や古細菌に感染して複製するウイルスで、正式にはバクテリオファージ(英: bacteriophage)と呼ばれる。ファージの基本構造は、タンパク質の外殻と遺伝情報を担う核酸 (主に二本鎖DNA) からなる。ファージが感染した細菌は細胞膜を破壊される溶菌という現象を起こし、死細胞を残さない。細菌が食べ尽くされるかのように死滅するため、これにちなんで「細菌(bacteria)を食べるもの(ギリシア語:phagos)」を表す「バクテリオファージ(bacteriophage)」という名がつけられた。
概要

バクテリオファージは、DNAまたはRNAのゲノムをカプセル化したタンパク質で構成され、単純なものから精巧なものまである。それらのゲノムは、わずか4つの遺伝子(例:MS2)から数100の遺伝子までをコードしている。ファージは、細菌の細胞質にゲノムを注入した後、細菌内で複製する。
バクテリオファージは、生物圏で最も一般的で多様な存在である。バクテリオファージは汎存ウイルスであり、細菌が存在する場所ならどこにでも存在する。地球上には、バクテリオファージが1031個以上存在すると推定されており、これは細菌を含む地球上の他のすべての生物を合わせた数よりも多くなっている。ウイルスは、世界の海の水柱(水面から底質への水の概念的な柱)に最も豊富な生物学的実体であり、原核生物に次いで2番目に大きなバイオマス構成要素であり、表面の微生物マットで1ミリリットル当たり9x108個のウイルスが検出され、海洋細菌の最大70%がファージに感染している可能性がある。
バクテリオファージは、20世紀初頭に、アーネスト・ハンキンとフレデリック・トウォートによってそれぞれ独立に発見され、カナダの生物学者フェリックス・デレーユによって溶菌作用が見出された。初期の分子生物学においてモデル生物として盛んに用いられた。またファージのゲノムは改変され、遺伝子導入やDNA断片のライブラリ作成などにも用いられている。有名なファージの一つにはラムダファージ(λファージ)があり、大腸菌に感染する。全ゲノムの解読はラムダファージで行われた(ゲノムプロジェクト)。また、ウイルス粒子が非常に複雑な形態のT4ファージもよく知られている。
20世紀後半から、旧ソビエト連邦、中央ヨーロッパ、およびフランスで抗生物質の代替品として使用されてきた。ファージは、多くの細菌の多剤耐性株に対する治療法として考えられている(ファージセラピーを参照)。一方、イノウイルス科(Inoviridae)のファージは、肺炎や嚢胞性線維症に関与するバイオフィルムを複雑化して、病気を根絶するための薬剤から細菌を保護し、持続的感染を促進することが示されている。
構造
バクテリオファージには多くの種類が知られており、その大きさは25〜200nm程度である。形状も様々な種類が知られており、多くの種は正二十面体様のカプシドを頭部としてそこから尾が伸びている。中には真核生物に感染するウイルスのように、単純に頭の部分のみを持つ種もある。ファージの尾部は細菌の細胞外に発達した莢膜や、ペプチドグリカンから成る細胞壁を突破して、細菌の細胞内にファージの核酸を送り込む機能を持つ。例えばT4ファージの尾の先端にある基盤を構成する蛋白質にはリゾチームとして機能する部分があり、これがペプチドグリカンを加水分解して細菌の細胞壁に穴を開ける。ファージの尾は、細菌細胞に核酸を送り込む時に収縮する長い尾、柔軟に屈曲するが収縮はしない長い尾、収縮しない短い尾の3種類がある。例えばT4ファージは長くて収縮するタイプ、ラムダファージは長くて屈曲するタイプの尾を持っている。
分類
バクテリオファージは生物圏に豊富に存在し、それぞれゲノムやライフスタイルが異なる。ファージは、国際ウイルス分類委員会(ICTV)により、形態学と核酸により分類されている。
| 目 | 科 | 形態 | 核酸 | 例 |
|---|---|---|---|---|
| Belfryvirales | Turriviridae | Enveloped, isometric | Linear dsDNA | |
| Caudovirales | Ackermannviridae | Nonenveloped, contractile tail | Linear dsDNA | |
| Myoviridae | Nonenveloped, contractile tail | Linear dsDNA | T4, Mu, P1, P2 | |
| Siphoviridae | Nonenveloped, noncontractile tail (long) | Linear dsDNA | λ, T5, HK97, N15 | |
| Podoviridae | Nonenveloped, noncontractile tail (short) | Linear dsDNA | T7, T3, Φ29, P22 | |
| Halopanivirales | Sphaerolipoviridae | Enveloped, isometric | Linear dsDNA | |
| Haloruvirales | Pleolipoviridae | Enveloped, pleomorphic | Circular ssDNA, circular dsDNA, or linear dsDNA | |
| Kalamavirales | Tectiviridae | Nonenveloped, isometric | Linear dsDNA | |
| Levivirales | Leviviridae | Nonenveloped, isometric | Linear ssRNA | MS2, Qβ |
| Ligamenvirales | Lipothrixviridae | Enveloped, rod-shaped | Linear dsDNA | Acidianus filamentous virus 1 |
| Rudiviridae | Nonenveloped, rod-shaped | Linear dsDNA | Sulfolobus islandicus rod-shaped virus 1 | |
| Mindivirales | Cystoviridae | Enveloped, spherical | Segmented dsRNA | Φ6 |
| Petitvirales | Microviridae | Nonenveloped, isometric | Circular ssDNA | ΦX174 |
| Tubulavirales | Inoviridae | Nonenveloped, filamentous | Circular ssDNA | M13 |
| Vinavirales | Corticoviridae | Nonenveloped, isometric | Circular dsDNA | PM2 |
| Unassigned | Ampullaviridae | Enveloped, bottle-shaped | Linear dsDNA | |
| Bicaudaviridae | Nonenveloped, lemon-shaped | Circular dsDNA | ||
| Clavaviridae | Nonenveloped, rod-shaped | Circular dsDNA | ||
| Finnlakeviridae | dsDNA | FLiP | ||
| Fuselloviridae | Nonenveloped, lemon-shaped | Circular dsDNA | ||
| Globuloviridae | Enveloped, isometric | Linear dsDNA | ||
| Guttaviridae | Nonenveloped, ovoid | Circular dsDNA | ||
| Plasmaviridae | Enveloped, pleomorphic | Circular dsDNA | ||
| Portogloboviridae | Enveloped, isometric | Circular dsDNA | ||
| Spiraviridae | Nonnveloped, rod-shaped | Circular ssDNA | ||
| Tristromaviridae | Enveloped, rod-shaped | Linear dsDNA |
ピコビルナ科(Picobirnaviridae)のメンバーは細菌に感染するが、哺乳類には感染しないことが示唆されている。
もう一つの提案されているファミリーは、Autolykiviridae(dsDNA)である。
歴史
1896年、イギリスの細菌学者アーネスト・ハンキンは、インドのガンジス川とヤムナー川の水に含まれる何かがコレラに対して顕著な抗菌作用を示し、それは非常に細かい磁器フィルターを通過できることを報告した。1915年、ロンドンのブラウン研究所の監督であるイギリスの細菌学者フレデリック・トウォートは、細菌に感染して死滅させる小さな病原体を発見した。彼は、その病原体は次のいずれかに違いないと考えた。
トウォートの研究は、第一次世界大戦の勃発、資金不足、抗生物質の発見によって中断された。
独立して、パリのパスツール研究所で働いていたフランス系カナダ人の微生物学者フェリックス・デレーユは、1917年9月3日に「赤痢菌に拮抗する目に見えない微生物」を発見したと発表した。デレーユにとって、彼の発見の本質については疑問の余地はなかった。「一瞬にして私が理解した。(寒天培地上の)透明なゾーンの原因は、実際には目に見えない微生物...細菌に寄生するウイルスだった。」デレーユはこのウイルスをバクテリオファージ、バクテリアイーターと呼んだ。(ギリシャ語のphageinから「むさぼり食う」という意味)。彼はまた、赤痢に苦しんでいた男性がバクテリオファージによって健康を取り戻したという劇的な記録も残している。バクテリオファージについての多くの研究を行い、ファージセラピーの概念を導入したのはデレーユであった。
半世紀以上後の1969年、マックス・デルブリュック、アルフレッド・ハーシー、サルバドール・ルリアは、ウイルスの複製とその遺伝子の発見によりノーベル生理学・医学賞を受賞した。
応用
ファージセラピー
ファージは、抗菌剤であることが発見され、1920年代から1930年代にかけて、旧ソビエト連邦内の共和国ジョージアで、細菌感染症を治療するために使用された(ジョージアの細菌学者ギオルギ・エリアバが、バクテリオファージの共同発見者であるフェリックス・デレーユの助けを借り、開拓した)。それらは赤軍の兵士の治療を含めて、広く使用された。しかし、いくつかの理由から欧米諸国での一般的な使用は放棄された。
- 抗生物質が発見されて広く販売された。それらは、製造、保管、および処方が容易であった。
- ファージの医学的試験が行われたが、基本的な理解不足から、これらの試験の妥当性に疑問が生じた。
- ソビエト連邦での研究の出版は主にロシア語かジョージア語で行われ、長い間、国際的には追随されていなかった。
冷戦終結後、ファージの使用は、ロシア、ジョージア、中央および東ヨーロッパの他の場所で継続されている。最初の制御、無作為化、二重盲検臨床試験は、2009年6月にJournal of Wound Care誌に報告され、ヒト患者の下肢の感染性静脈潰瘍を治療するためのバクテリオファージカクテルについて安全性と有効性を評価した。アメリカ食品医薬品局(FDA)はこの試験を第I相臨床試験として承認した。同試験の結果、バクテリオファージの治療応用の安全性を示したが、有効性は示されなかった。著者らは、標準的な創傷治療の一部である特定の化学物質(ラクトフェリンや銀など)の使用が、バクテリオファージの生存を阻害した可能性があると説明した。その後まもなく、西ヨーロッパで別の対照臨床試験(緑膿菌によって引き起こされた耳感染症の治療)が、2009年8月のジャーナルClinical Otolaryngologyで報告された。この研究では、バクテリオファージ製剤はヒトの慢性耳感染症の治療に安全で効果的であると結論づけている。さらに、感染した火傷や創傷、嚢胞性線維症に伴う肺感染症など、さまざまな疾患に対するバクテリオファージの有効性を評価する動物実験やその他の実験的臨床試験が数多く行われてきた。
一方、バクテリオファージの研究者は、抗生物質耐性を克服するための遺伝子改変ウイルスの開発や、バイオフィルムマトリクスを分解する酵素をコードするファージ遺伝子、ファージの構造タンパク質、細菌の細胞壁を溶解する酵素などの遺伝子改変を行ってきた。小型で短尾型のT4ファージは、人体における大腸菌の検出に有用であることを示す結果が出ている。
多剤耐性アシネトバクター・バウマニ(MDR A. baumannii)の鼻腔感染モデルマウスを用いて、ファージカクテルの治療効果を評価した。ファージカクテルで治療したマウスは、感染後7日目に未治療マウスに比べて2.3倍の高い生存率を示した。2017年、MDR A. baumanniiによって膵臓に障害を受けた患者は、複数の抗生物質を投与されたにもかかわらず、患者の健康状態は4ヶ月の間に悪化し続けた。効果的な抗生物質がないため、患者はMDR A. baumanniiに対して有効であることが実証されている9種類のファージを含むファージカクテルを用いたファージ療法を受けた。この治療を受けると、患者の下降していた臨床経過は一転し、健康な状態に戻った。
デレーユは「バクテリオファージは、下水道、パイプからの廃棄物が流入する川、回復期の患者の便の中など、バクテリアが繁殖する場所ならどこにでもあることをすぐに知った」。これには、インドのガンジス川など、伝統的に治癒力があると考えられてきた川も含まれている。
その他
- 食品業界
- 2006年以降、アメリカ食品医薬品局(FDA)とアメリカ農務省(USDA)は、いくつかのバクテリオファージ製品を承認している。LMP-102(Intralytix)は、加工(RTE)鶏肉および肉製品の治療に承認された。同年、FDAは、一般に安全と認められる(GRAS)ステータスを与えるために、チーズにバクテリオファージを使用してリステリア・モノサイトゲネス菌を殺すLISTEX(マイクレオスによって開発・製造された)を承認した。2007年7月には、すべての食品での同じバクテリオファージの使用が承認された。2011年、USDAは、LISTEXをクリーンラベル加工助剤として、USDAに含まれることを確認した。食品安全の分野では、さまざまな食品中の他の食物由来病原体を制御するため、実行可能な選択肢として、溶菌性ファージがあるかどうかの研究が続けられている。
- 酪農
- 環境中に存在するバクテリオファージは、チーズスターター培養物の発酵失敗を引き起こす可能性がある。これを回避するために、混合株スターター培養や培養物ローテーション計画を使用することができる。
- 診断法
- 2011年、FDAは、体外(in vitro)診断用の最初のバクテリオファージに基づく製品を承認した。KeyPath MRSA/MSSA血液培養検査では、バクテリオファージのカクテルを使用して、陽性の血液培養物中の黄色ブドウ球菌(Staphylococcus aureus)を検出し、メチシリン耐性または感受性を判定する。この検査では、標準的な微生物同定および感受性検査法では2~3日かかるのに対し、約5時間で結果が得られる。これは、FDAによって承認された最初の迅速化抗生物質感受性検査である。
- 生物兵器や毒素への対抗
- 欧米の政府機関は数年前から、炭疽菌やボツリヌス菌などの生物兵器や毒素に対抗するためのファージの利用について、ジョージアや旧ソビエト連邦に協力を求めてきた。米国の研究グループ間で開発が続けられている。その他の用途としては、植物や野菜の生産物を腐敗や細菌感染の蔓延から保護するための園芸での散布などがある。バクテリオファージの他の用途は、病院などの環境表面の殺生物剤として、また、臨床現場で使用する前のカテーテルや医療機器の予防処置としてである。ファージを乾燥した表面、例えばユニフォーム、カーテン、または手術用の縫合糸などに適用する技術が現在存在している。Clinical Otolaryngology誌に報告された臨床試験では、ペット犬の中耳炎の獣医学的治療に成功している。
- SEPTIC菌検出・同定法
- この手法は、ファージ感染時のイオン放出とその動態を利用した高い特異性と検出速度を実現している。
- ファージディスプレイ
- これは、表面タンパク質に連結した可変ペプチドを有するファージのライブラリーに関わるファージの別の使用法である。各ファージゲノムは、その表面に発現しているタンパク質の変異体をコードし(その名の由来)、変異ペプチドとそのエンコード遺伝子との間のリンクを提供する。ライブラリーからの変異ファージは、固定化された分子(例えば、ボツリヌス毒素)を中和するために、その結合親和性を通じて選抜される。結合し、選抜されたファージは、感受性のある細菌株を再感染させて増殖することができ、それにより、さらなる研究のためにファージにコードされたペプチドを回収することができる。
- 抗菌薬の発見
- ファージタンパク質はしばしば抗菌活性を持ち、ペプチドミメティック、すなわちペプチドを模倣する薬剤のリードとなる可能性がある。ファージリガンド技術は、細菌や細菌成分(エンドトキシンなど)の結合や細菌の溶解など、さまざまな用途にファージタンパク質を利用する。
- 基礎研究
- バクテリオファージは遺伝子数が他の生物に比べて少なく、また増殖が容易なことから、進化と生態学の原理を研究するための重要なモデル生物である。
- 遺伝子工学
- テンペレートファージを利用して宿主の細菌に任意の遺伝子を導入する技術も開発された。この技術は形質導入と呼ばれ、ラムダファージによる大腸菌への形質導入が、分子生物学分野で繁用されている。
- ファージ型別
- ファージは種類によって宿主とする細菌が異なり、しかもその選択性が高い。このため同じ種に属する細菌であっても、株によって特定のファージに感染するものとしないものがある。この現象を利用して同種の細菌をさらに細かく判別することが可能であり、この方法をファージ型別と呼ぶ。ファージ型別による分類は黄色ブドウ球菌やサルモネラに用いられており、これらの菌の中でも特に病原性の高いものであるかどうかを識別することが可能である。
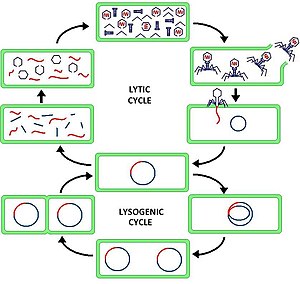
複製
バクテリオファージは「溶菌サイクル」と「溶原サイクル」を持っている。
T4ファージのような溶菌性ファージ (ビルレントファージ、英: virulent phage)で見られる溶菌サイクル(lytic cycle)では、ウイルスが即時に複製された後、細菌細胞は破壊され(溶解して)死滅する。細胞が破壊されるとすぐに、ファージの子孫は新しい宿主を見つけて感染できる。溶菌性ファージは、ファージセラピー用としてより適している。一部の溶菌性ファージは、細胞外のファージ濃度が高い場合には、完成したファージ子孫がすぐに細胞外に溶解しないという、溶菌阻害(英: lysis inhibition)として知られる現象を起こす。この機構は、次に述べる溶原性ファージ(プロファージ)が休眠状態になる機構とは異なり、通常は一時的なものである。
対照的に、溶原サイクル(lysogenic cycle)は、宿主細胞の即時溶解をもたらさない。溶原性を受けることができるそれらのファージは溶原性ファージ (テンペレートファージ、英: temperate phages) として知られている。それらのウイルスゲノムは、宿主のDNAと統合され、宿主DNAと一緒に比較的無害に複製されるか、あるいはプラスミドとして宿主細胞内に独立して存在することもある。ウイルスは、(おそらく栄養分の枯渇が原因で)宿主の状態が悪化するまで休眠状態のままで、その後、内在性ファージ(プロファージとして知られている)は活動的になる。この時点で、プロファージは生殖サイクルを開始し、宿主細胞の溶解をもたらす。溶原サイクルが宿主細胞の生存と繁殖を可能にするので、ウイルスはその細胞のすべての子孫に複製される。この現象は溶原化と呼ばれ、プロファージを保有する細菌を溶原菌と呼ぶ。溶原サイクルと溶菌サイクルに従うことが知られているバクテリオファージの例には、大腸菌のラムダファージがある。
テンペレートファージの中には抗生物質への耐性遺伝子や毒素の遺伝子を持っているものがあり、細菌ゲノムに新しい機能を追加することによってその遺伝形質を細菌が獲得することがある。これは、溶原変換(英: lysogenic conversion)と呼ばれる現象であり、これによって薬剤耐性や強毒性の細菌が出現することは、医学上重要な問題と考えられている。このような実例としてO157のベロ毒素が挙げられる。ベロ毒素は一部の赤痢菌が産生する志賀毒素と同じものであり、それらの赤痢菌に感染していた毒素遺伝子を含むファージが大腸菌に感染してベロ毒素産生大腸菌が出現したと考えられている。同様の例として、バクテリオファージによって、無害なコリネバクテリウム・ジフテリアエ(Corynebacterium diphtheriae)やビブリオ・コレラエ(Vibrio cholerae)の菌株の、それぞれジフテリアやコレラを引き起こす強毒性の菌株への変換がある。これらの毒素をコードするプロファージを標的とした特定の細菌感染症と闘う戦略が提案されている。
付着と浸透

細菌細胞は、多糖類の細胞壁によって保護されている。多糖類は、免疫宿主防御と抗生物質の両方から細菌細胞を保護する重要な病原性因子である。バクテリオファージは、宿主細胞に侵入するために、リポ多糖類、タイコ酸、タンパク質、あるいは鞭毛(べんもう)など、細菌表面にある特定の受容体に結合する。この特異性は、バクテリオファージが、結合可能な受容体を持つ特定の細菌のみに感染することを意味し、これがファージの宿主範囲を決定する。エンドリシンのような多糖類分解酵素は、厳密にプログラムされたファージ感染プロセスの初期段階で、宿主の莢膜(きょうまく)外層を酵素的に分解するビリオン関連タンパク質である。宿主の増殖条件はまた、ファージが宿主に付着して侵入する能力に影響を与える。ファージビリオンは独立して移動しないので、血液、リンパ循環、灌漑(かんがい)、土壌水などの溶液中にある場合、正しい受容体とのランダムな遭遇に頼らなければならない。
ミオウイルス・バクテリオファージは、皮下注射器のような動きを利用して、その遺伝物質を細胞内に注入する。適切な受容体に接触した後、尾部繊維が屈曲して基盤を細胞表面に近づける。これは可逆的結合として知られている。一度完全に付着すると、不可逆的結合が開始され、おそらく尾の中に存在するATPの助けを借りて、尾が収縮し、細菌膜を介して遺伝物質を注入する。注入は、細胞の近くで収縮する側に移動し、押し戻すことによる、シャフトの一種の曲げ運動によって行われる。ポドウイルスは、ミオウイルスのような細長い尾鞘を持たないので、代わりに、小さな歯のような尾部繊維を酵素的に使って、細胞膜の一部を分解してから遺伝物質を注入する。
タンパク質と核酸の合成
数分以内に、細菌のリボソームがウイルスのmRNAをタンパク質に翻訳し始める。RNAベースのファージの場合、RNA複製酵素はプロセスの初期に合成される。タンパク質は、細菌のRNAポリメラーゼを修飾するので、ウイルスのmRNAを優先的に転写する。宿主のタンパク質と核酸の正常な合成は阻害され、代わりにウイルス産物の産生を余儀なくされる。これらの産物は、細胞内の新しいウイルスの一部となり、新しいウイルスの組み立てに寄与するヘルパータンパク質、または細胞溶解に関与するタンパク質となる。Walter Fiers(ベルギー、ゲント大学)は、1972年、遺伝子の完全なヌクレオチド配列を初めて確立し、1976年にはバクテリオファージMS2のウイルスゲノムを確立した。いくつかのdsDNAバクテリオファージはリボソームタンパク質をコードしており、ファージ感染時にタンパク質の翻訳を調節していると考えられている。
ウイルス組み立て
T4ファージの場合、新しいウイルス粒子の組み立てには、ファージの形態形成中に触媒的に作用するヘルパータンパク質の助けが必要である。最初に基盤が組み立てられ、その後、尾部がその上に構築される。別々に組み立てられた頭部カプシドは、自発的に尾部と一緒に組み立てられる。ファージT4ビリオンの組み立ての際には、ファージ遺伝子がコードする形態形成タンパク質が特徴的な配列で相互作用する。ウイルス感染時に産生されるこれらのタンパク質のそれぞれの量を適切なバランスで維持することが、正常なファージT4の形態形成に重要であると考えられている。DNAは頭部内に効率的に充填される。全体のプロセスは約15分で終了する。
ウイルスの放出
ファージは、細胞溶解、押し出し、または場合によっては、出芽によって放出される。尾を持ったファージによる細胞溶解は、エンドライシンと呼ばれる酵素によって行われ、細胞壁ペプチドグリカンを攻撃して破壊する。まったく異なるタイプのファージである繊維状ファージは、宿主細胞に新しいウイルス粒子を継続的に分泌させる。放出されたウイルスは遊離したものとして説明されており、欠陥がない限りは、新しい細菌に感染する可能性がある。出芽は、特定のマイコプラズマ(Mycoplasma)ファージと関連している。ウイルス放出とは対照的に、溶原サイクルを示すファージは、宿主を殺すのではなく、むしろプロファージとして長期滞在者となる。
コミュニケーション
2017年の研究では、バクテリオファージΦ3Tが短いウイルス性タンパク質を作り、宿主細菌を殺す代わりに休眠状態にある他のバクテリオファージにシグナルを送ることが明らかになった。アービトリウムは、このタンパク質を発見した研究者がつけた名前である。
ゲノム構造
環境中に数百万種類のファージが存在することから、ファージのゲノムはさまざまな形と大きさを持っていると考えられる。MS2のようなRNAファージは、わずか数1,000塩基の最小のゲノムを持っている。しかし、T4のようなDNAファージの中には、数100個の遺伝子を持つ大きなゲノムを持つものもあり、カプシドの大きさや形状は、ゲノムの大きさとともに変化する。最大のバクテリオファージのゲノムは735 kbの大きさにもなる。
バクテリオファージのゲノムは、高度にモザイク化されていることがある。すなわち、多くのファージ種のゲノムは、多数の個別のモジュールで構成されているように見える。これらのモジュールは、異なる配列で他のファージ種に見られることがある。マイコバクテリオファージや、マイコバクテリア宿主を持つバクテリオファージは、このモザイク性の優れた例を提供してきた。これらのマイコバクテリオファージでは、遺伝子の品ぞろえは、部位特異的組換え(一定の配列相同性を持ったセグメント間でのDNA鎖交換)および非正統的組換え(細菌宿主の遺伝子配列のファージゲノム獲得の結果)を繰り返した結果である可能性がある。細菌ウイルスのゲノムを形成する進化の機構は、ファミリー間で異なり、核酸の種類、ウイルス構造の特徴、ウイルスのライフサイクルのモードに依存している。
システム生物学
ファージはしばしば宿主に劇的な影響をおよぼす。その結果として、感染した細菌の転写パターンが大きく変化することがある。例えば、溶原性ファージPaP3による緑膿菌(Pseudomonas aeruginosa)の感染は、その宿主の遺伝子の38% (2160/5633) の発現を変化させた。これらの効果の多くはおそらく間接的なものであるため、細菌とファージの間の直接的な相互作用を特定することが課題となっている。
ファージとその宿主の間のタンパク質間相互作用をマッピングするために、いくつかの試みがなされてきた。例えば、バクテリオファージラムダは、31種の相互作用によって、その宿主である大腸菌(E. coli)と相互作用することがわかった。しかし、大規模な研究では62種の相互作用が明らかになり、そのほとんどが新しかった。繰り返しになるが、これらの相互作用の多くの重要性は明らかになっておらず、これらの研究は、いくつかの重要な相互作用と、その役割が明らかにされていない多くの間接的な相互作用が存在する可能性があることを示唆している。
環境中
メタゲノミクスにより、以前は不可能だったバクテリオファージの水中での検出を可能にした。
また、バクテリオファージは、河川水系、特に地表水と地下水の相互作用が発生する場所での水文学的トレースやモデリングにも使用されている。ファージの使用は、地下水を通過する際の吸収が著しく少なく、非常に低い濃度で容易に検出できるため、従来の染料マーカーよりも好まれている。汚染されていない水には、1 mlあたり約2×108個のバクテリオファージが含まれている可能性がある。
バクテリオファージは、主に形質導入を介してだけでなく、形質転換を介して、自然環境における遺伝子の水平伝播に広く寄与していると考えられている。メタゲノミクスに基づく研究はまた、さまざまな環境からのウイルス叢(virome)が、多剤耐性をもたらす可能性のある遺伝子を含め、抗生物質耐性遺伝子を保有していることを明らかにした。
モデルバクテリオファージ
次のバクテリオファージが広範囲に研究されている。
参照項目
- ヴィロファージ - 他のウイルスに寄生するウイルス
- 細菌食性生物
- CRISPR
- DNAウイルス
- RNAウイルス
- ファージディスプレイ
- 形質導入
- ハーシーとチェイスの実験 - ファージにおける遺伝物質がDNAであることを確定した一連の実験
- ファージ生態学
- ファージ関連の研究論文 - ファージおよびファージ関連の研究論文の包括的なリスト、1921年から現在まで
- ポリファージ
- Viriome
- crAssphage
- ファージミド
脚注
参考書目
- Hauser, AR (2016). “Beyond Antibiotics: New Therapeutic Approaches for Bacterial Infections”. Clinical Infectious Diseases 63 (1): 89–95. doi:10.1093/cid/ciw200. PMC 4901866. PMID 27025826. https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4901866/.
- Strathdee, Steffanie; Patterson, Tom (2019). The Perfect Predator. Hachette Books. ISBN 978-0316418089
- Takemura, Masaharu; 武村政春. (2019). ヒトがいまあるのはウイルスのおかげ! ―役に立つウイルス・かわいいウイルス・創造主のウイルス. Tōkyō: さくら舎. ISBN 978-4-86581-179-7. OCLC 1082187420. https://www.worldcat.org/oclc/1082187420
外部リンク
- T4ファージの微細構造と感染のメカニズム at the Wayback Machine (archived 2017-12-22)
- Häusler, T. (2006) "Viruses vs. Superbugs", Macmillan
- Animation of bacteriophage targeting E. coli bacteria
- Phage.org general information on bacteriophages
- bacteriophages illustrations and genomics
- Bacteriophages get a foothold on their prey
- NPR Science Friday podcast, "Using 'Phage' Viruses to Help Fight Infection", April 2008
- Animation of a scientifically correct T4 bacteriophage targeting E. coli bacteria
- Animation by Hybrid Animation Medical for a T4 Bacteriophage targeting E. coli bacteria
- Bacteriophages: What are they. Presentation by Professor Graham Hatfull, University of Pittsburgh - YouTube
- 『バクテリオファージ』 - コトバンク