ヘモゾイン
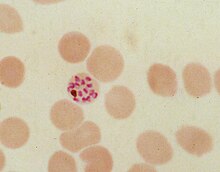
ヘモゾイン (hemozoin, haemozoin) は、いくつかの吸血性寄生虫によって血液の消化物から形成される廃棄物である。マラリア原虫、住血吸虫、一部のサシガメといった吸血動物は、ヘモグロビンを消化して大量の遊離ヘムを放出する。ヘムはヘモグロビンの補欠分子族で、ポルフィリン環の中央に鉄原子を含んでいる。遊離ヘムは細胞に対して毒性があるため、寄生虫はそれをヘモゾインと呼ばれる不溶性結晶へと変換する。マラリア原虫では、ヘモゾインはしばしば「マラリア色素」(malaria pigment)と呼ばれる。
ヘモゾインの形成はこれらの寄生虫の生存に不可欠であるため薬剤開発の魅力的な標的であり、マラリアの治療薬を発見する手段としてマラリア原虫でよく研究されている。現在用いられている抗マラリア剤のいくつか (クロロキンやメフロキンなど) は、ヘモゾインの生体内結晶化 (biocrystallization) を阻害することでマラリア原虫を殺していると考えられている。
発見
1847年にJohann Heinrich Meckelによって、精神異常の人物の血液と脾臓に暗褐色の色素が観察された。しかし、この色素の存在とマラリアへの感染が関連付けられたのは1849年になってからであった。当初、この色素は感染への反応として体内で合成されると考えられていたが、1880年にシャルル・ルイ・アルフォンス・ラヴランは、「マラリア色素」は寄生虫が赤血球内で増殖するときに、寄生虫によって合成されることを示した。色素とマラリアの寄生虫との関連性は、ロナルド・ロスがマラリア原虫の生活環に蚊の体内の段階が存在することを示すのにも利用された。寄生虫の見た目は血中の段階のものとは異なっていたが、それらは微量の色素を含んでいたのである。
その後、T. Carbone (1891) とW. H. Brown (1911) は、ヘモグロビンの分解と色素の産生を関連付ける論文を発表してマラリア色素がヘマチンの一形態であることを記載し、メラニンと関係があるという広く信じられていた考えを反証した。Brownは、すべてのメラニンが過マンガン酸カリウムによって迅速に漂白されることを観察したが、マラリア色素はこの試薬では漂白反応の徴候すら示さなかった。「ヘモゾイン」という名称は、Louis Westenra Sambonによって提唱された。1930年代には、ヘモゾインがα-ヘマチンの純粋な結晶形態であることが同定され、結晶中にはタンパク質成分が含まれないことが示されたが、マラリア色素とα-ヘマチン結晶との溶解度の違いについては説明がつかなかった。
形成
赤血球内での無性生殖サイクルの間、マラリア原虫 Plasmodium falciparum は宿主細胞のヘモグロビンの最大80%を消費する。ヘモグロビンの消化によって、単量体のα-ヘマチン (フェリプロトポルフィリンIX) が放出される。この化合物には毒性があり、酸化促進剤として活性酸素種の産生を触媒する。酸化ストレスはヘム (フェロプロトポルフィリン) からヘマチン (フェリプロトポルフィリン) への変換によって発生すると考えられている。また、遊離ヘマチンは細胞膜へ結合して破壊し、細胞構造に損傷を与えて宿主の赤血球の溶解を引き起こす。この分子の独特な反応性は、いくつかのin vitroとin vivoの実験条件で示されている。

マラリア原虫は、生体内結晶化によってヘマチンを不溶性で化学的に不活性なβ-ヘマチン結晶 (ヘモゾイン) へ変換することで解毒を行っている。マラリア原虫の食胞(food vacuole) はヘモゾインの結晶で満ちており、直径 100–200 nmの食胞の中には約8万個のヘム分子が含まれている。生体内結晶化という解毒法は、哺乳類のものとは異なっている。哺乳類では、ヘムオキシゲナーゼと呼ばれる酵素が余剰ヘムをビリベルジン、鉄、一酸化炭素へ分解している。
マラリア原虫におけるヘモゾインの産生に関しては、いくつかのメカニズムが提唱されているものの、きわめて議論の多い領域である。膜の脂質、ヒスチジンに富むタンパク質、そしてその両者の組み合わせ、などがヘモゾインの形成を触媒すると提唱されている。他には、ヘム解毒タンパク質 (heme detoxification protein) がそれらよりも有力であるという主張がなされている。ヘモゾインの形成には多くの過程が寄与している可能性もある。
他の吸血生物でのヘモゾインの形成は、マラリア原虫ほどには研究されていない。しかし、マンソン住血吸虫 Schistosoma mansoni はヒトの血流中での成長の間、多量のヘモゾインを産生することが明らかにされている。結晶の形状はマラリア原虫が産生するものとは異なるが、色素の化学的分析によってそれらがヘモゾインで構成されていることが示されている。同様に、サシガメの1種 Rhodnius prolixus の腸管において血液の消化によって形成される結晶も、ヘモゾインで構成されている。R. prolixus の中腸でのヘモゾインの形成は生理的条件に相当する物理化学的条件下で起こり、ヘムの生体内結晶化には脂質が重要な役割を果たす。ヘムからヘモゾインへの自己触媒的な結晶化は非効率的過程であることが明らかにされており、この変換はヘモゾインの濃度が上がるほど減少する。
さまざまな種類の吸血動物が、遊離ヘムの毒性から保護するための他の機構を発達させている。蚊は血液の消化を細胞外で行い、ヘモゾインを産生しない。ヘムは囲食膜 (peritrophic matrix, pertirophic membrane) と呼ばれる中腸を覆うタンパク質と多糖からなる層に保持され、腸の細胞は血液の塊から分離されている。
β-ヘマチンは低pHでは自発的に産生されるものの、ヘモゾインの産生を測定する簡便で信頼性の高いアッセイの開発は難航している。どの分子がヘモゾインの産生に関与しているかが未だ不確実であること、凝集・沈殿したヘムと本物のヘモゾインとの差異を測定するのが難しいことなどがその理由である。現在のアッセイは感度も精度も高いものであるが、複数の洗浄段階が必要であるため時間がかかり、ハイスループットスクリーニングに理想的なものとは言い難い。しかしながら、このアッセイを用いていくつかのスクリーニングが行われている。
構造
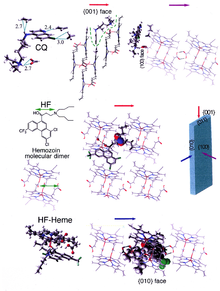
β-ヘマチンの結晶はヘマチン分子の二量体から構成され、二量体どうしが水素結合することで巨大な構造が形成されている。これらの二量体内では、一方の分子のカルボキシル基側鎖の酸素が、他方の分子の中央の鉄へ配位結合している。この相互的な鉄-酸素間結合は極めて珍しいもので、他のポルフィリン二量体では見られないものである。β-ヘマチンは環状の二量体を形成するか、直鎖状の多量体を形成することが可能であるが、多量体型はヘモゾイン中では決して観察されない。このことはヘモゾインがヘムポリメラーゼによって合成されるという広く信じられていた考えの反証となった。
ヘモゾインの結晶は三斜晶系で弱い磁性を持つ。低スピン状態のオキシヘモグロビンの反磁性、ヘモゾインの常磁性という差異は、単離の際に利用される。ヘモゾインは光学的二色性を示す。このことは短辺方向よりも長辺方向の光がより強く吸収されることを意味し、マラリアの自動化検出に利用される。ヘモゾインは、磁場の印加によって濃度依存的な光学的二色性の増大を示し、この誘導的二色性の正確な測定がマラリア感染のレベルの決定に利用できる可能性がある。
阻害剤
ヘモゾインの形成は、マラリア原虫の生存には必須で、宿主であるヒトには存在しない過程であるため、優れた薬剤標的となる。薬剤の標的であるヘマチンは宿主に由来し、寄生虫による遺伝的制御の外にあるため、薬剤耐性の獲得はより困難なものとなる。臨床で用いられている薬剤の多くが、食胞におけるヘモゾインの形成を阻害することで機能すると考えられている。食胞に放出されたヘムの解毒が阻害され、寄生虫は死に至る。
このようなヘマチン生体内結晶化阻害剤として最もよく知られている例は、クロロキンやメフロキンといったキノリン系の薬剤である。これらの薬剤は遊離ヘムとヘモゾイン結晶の双方に結合し、成長中の結晶に新たなヘムが付加されるのを防ぐ。小さな、最も速く成長する面が、阻害剤の結合する面であると考えられている。
病態生理学的機能
ヘモゾインは再感染に伴って循環系へ放出されて宿主の食細胞へ食作用によって取り込まれ、これらの細胞の重要な機能を変化させる。変化のほとんどは食作用後に長期的な影響を与えるものであり、in vitroでは赤血球生成が阻害されることが示されている。対照的に、ヘモゾインの食作用後には単球による酸化バースト (oxidative burst) が短期的に強力に刺激されることも示されている。