補助人工心臓
| 補助人工心臓 | |
|---|---|
| 治療法 | |

| |
| ICD-9-CM | 37.6 |
補助人工心臓(ほじょじんこうしんぞう、英: ventricular assist device: VAD または 英: ventricular assist system: VAS)とは、重症心不全患者の心臓の左室または右室、あるいは両心室の働きを補助する人工臓器である。空気駆動ないし電気駆動によって動作するポンプ、ポンプによって心臓から血液を吸引する脱血管、吸引した血液を動脈に送り出す送血管、そしてポンプの動力源となる電源供給部などから構成される。完全置換型人工心臓(total artificial heart: TAH)とは異なり自己の心臓を温存した形で心機能を補助する目的で使用され、大動脈内バルーンパンピング(IABP)や経皮的心肺補助(PCPS)と同じく、心機能の一部を代替する働きを持つ補助循環の一種である。
開発の歴史と現況
完全置換型の問題点とVADへの移行
人工心臓開発の歴史は、1935年にチャールズ・リンドバーグとアレクシス・カレルにより試作され後の人工心臓の原型となった、世界初の完全置換型人工心臓(TAH)である「カレル・リンドバーグポンプ」に始まる。その後1957〜1958年にかけてクリーブランド・クリニックにて阿久津哲造とウィレム・コルフにより完全置換型人工心臓の初の動物実験が行われ、イヌに対して植込み実験を行い約1.5時間の生存に成功した。1960年代から人工心臓開発が米国の国家プロジェクトとして、マイケル・ドベイキーおよびプロジェクトの作成に携わった能勢之彦らにより開始され、同じく1960年代より始まった心移植の代替治療となることを目指して研究が進められた。しかし長期耐久性や血栓形成などの問題で当時の完全置換型人工心臓には限界があり、人工心臓開発の目標は完全置換型から、並行して開発が進められていた補助人工心臓へ移っていくこととなった。
VADの開発と臨床応用
補助人工心臓(VAD)は1963年にドベイキーがドミンゴ・リオッタおよびスタンリー・クロフォードの開発した左室補助人工心臓(リオッタ・クロフォード型LVAD)を42歳の患者に使用したのが初の臨床応用例である。リオッタは完全置換型人工心臓の研究と並行してVADの臨床応用に向けた研究開発を1961年よりベイラー医科大学にて行っており、その他1969年にリオッタ・クーリー型TAHが初めて臨床応用されている。
その後世界で研究開発が進められてきたが、当初は体外設置型VADが短期使用を目的として用いられてきた。しかし免疫抑制剤のサイクロスポリンの登場により心移植が急速に普及するとともにドナー不足の問題が顕在化し、心移植を待つ重症心不全患者が移植待機の期間中を如何にして乗り切るかが問題となった。そこで心移植までの「つなぎ」として、患者に適合するドナーが現れるまでの期間の循環補助としてVADを用いる移植への橋渡しとしての使用法(ブリッジ使用)が発展してきた。そして1990年代に在宅治療可能な第1世代拍動流植込型VADが臨床導入され、重症心不全に対して標準的に用いられるようになった。
心移植代替治療としての永久使用(DT: destination therapy)の適応に関しては、2002年に第1世代植込型VADのHeartMate VEが、2010年に第2世代植込型VADのHeartMate IIがアメリカ食品医薬品局(FDA)により永久使用の適応として承認された(ただし長期耐久性に限界がある点を考慮し、高齢や悪性腫瘍の合併など心移植適応とされない症例が適応とされている)。その後植込型VADの欠点を改善すべく開発が進められ、第2世代植込型VADは接触軸受で定常流ポンプの回転羽根車を支えるのに対し、新たに開発された第3世代植込型VADは磁気浮上や動圧浮上といった非接触軸受の機構を持つようになった。第3世代植込型VADの非接触軸受は接触軸受と比べて、軸受部の熱の発生による血栓形成や摩耗を軽減することによって、耐久性に優れる特徴を持つ。
日本における展開
一方日本では、急性心不全に対する1ヶ月程度の使用を目的として、1980年に東大・ゼオン型VADの、1982年に国循・東洋紡型VAD(後のニプロVAD)の臨床使用が始まった。これら2機種の体外設置型拍動流VADはいずれも1990年に製造販売承認を受け、1994年より保険適用となり、以来多くの施設で用いられてきた。その後2004年にNovacor LVADが一時的に保険償還されたが、日本での販売時点で既に旧式となっておりわずかの症例で保険診療として使用されたのみで2年で市場から撤退、いわゆる「デバイスラグ」の典型例となった。厚生労働省に設けられた「医療ニーズの高い医療機器等の早期導入に関する検討会」にて、2007年に「医療ニーズの高い医療機器」として指定されたHeartMate XVEは2009年に製造販売承認されたが、やはり承認時すでに時代遅れとなり保険償還申請は行われなかった。そのため同検討会ではこのような経緯を教訓に審査・承認を迅速化する方向で検討が進められた。その後、第2・第3世代定常流植込型VADであるDuraHeartとEVAHEARTが臨床試験開始からそれぞれ5年半、2年で製造販売承認が得られ、いずれも2011年より保険償還された。続いてHeartMate XVEの後継機であるHeartMate IIが2013年4月に、Jarvik 2000が2014年1月に製造販売承認に至り、ようやく日本の重症心不全治療機器の選択肢が欧米と同等水準にまで達した。
また2010年に臓器移植法が改正され小児ドナーからの心移植が可能となり、小児心移植への橋渡しとして小児用VADの役割が今後日本でも重要となるが、小児に使用可能で欧米で既に市販されているベルリンハートEXCORの医師主導臨床試験が2012年に日本でも開始され、東京大学医学部附属病院で初のEXCOR植込み手術が行われた。欧州でJarvik乳児用ポンプの臨床試験が2012年に開始されたが、日本でもNEDO(新エネルギー・産業技術総合開発機構)のプロジェクトとして小児用第3世代軸流型定常流植込型VADの開発が進んでいる。
今後の開発の課題
今後の開発の課題として、短期使用VAD・小児用VAD・遠心ポンプ植込型VADの小型化が挙げられる。米国では救命目的の1週間から1ヶ月程度の短期補助(後述のBTD: bridge to decision)に使用可能なデバイスとして、体外設置型第3世代遠心ポンプCentriMagや経皮的VADであるImpella、TandemHeartが普及してきており、特にImpellaとTandemHeartは血管内治療の手技を用いた経皮的VADとして循環器内科や救急領域に広がっており、日本では2017年よりImpellaの臨床使用が開始された。日本でも、国産の遠心ポンプ型植込型VAD(DuraHeart、EVAHEART)の小型モデル化に向けた開発が進んでいる。
種類
VADにはポンプ本体を体外に置く体外設置型(paracorporeal VAD, extracorporeal VAD)、植込型(implantable VAD)、経皮型(catheter based VAD)がある。また、完全置換型人工心臓(TAH)は通常左心ポンプと右心ポンプが一体となっているが、VADは左室補助人工心臓(LVAD)と右室補助人工心臓(RVAD)の2種類がある。LVADの場合は胸部大動脈に直接接続した送血管と、左室または左房に挿入した脱血管をポンプ本体に接続し、RVADの場合は肺動脈に接続した送血管と、右室または右房に挿入した脱血管をポンプ本体に接続する。LVADとRVADを同時に装着する場合を両心補助人工心臓(BiVAD または BVAD)と呼ぶ。またポンプが生じる血流が心臓の拍出と同じ生理的な拍動流であるか、あるいは軸流ポンプや遠心ポンプを用いた定常流(連続流)であるかによっても分類される。
主要な機種を下表に示す。太字は日本で使用症例がある機種である。2012年9月時点までの集計で日本では1477例のVAD装着が行われており、そのうち症例数が最も多いのはニプロVADである(902例)。ただし2011年からは植込型VADの症例が増加し、2010年以降の集計で症例の7割以上が植込型となっている。
| 種類 | 機種 | 開発・製造 | 保険収載(日本) | |
|---|---|---|---|---|
| 体外設置型VAD | ニプロVAD(旧TOYOBO型) | 国循センター型(東洋紡・ニプロ) | 1994年 | |
| ゼオンVAD | 東大型(日本ゼオン) | 1994年 | ||
| BVS 5000 | アビオメッド(ABIOMED) | 2001年 | ||
| AB5000 | アビオメッド | 2001年 | ||
| CentriMag | ソラテック(Thoratec) | |||
| EXCOR | ベルリンハート | (2012年治験開始) | ||
| 植込型VAD | 第1世代拍動流VAD | Novacor | ワールドハート(WorldHeart) | 2004年 |
| HeartMate IP / VE / XVE | ソラテック | |||
| 第2・第3世代定常流VAD | Jarvik 2000 | ジャービック・ハート(Jarvik Heart) | (2013年製造販売承認) | |
| HeartMate II | ソラテック(Thoratec Corporation) | 2013年 | ||
| HeartMate3 | ソラテック(Thoratec Corporation) | 2021年 | ||
| EVAHEART | サンメディカル技術研究所 | 2011年 | ||
| DuraHeart | テルモ | 2011年 | ||
| HeartWare HVAD | ハートウェア(HeartWare) | |||
| 小児用VAD | PediPump | クリーブランド・クリニック(Cleveland Clinic) | ||
| infant Jarvik | ジャービック・ハート | |||
| PediaFlow VAD | ワールドハート | |||
| 経皮型VAD | Impella | アビオメッド | 2017年 | |
| Tandem Heart | カーディアックアシスト | |||
構造と動作原理
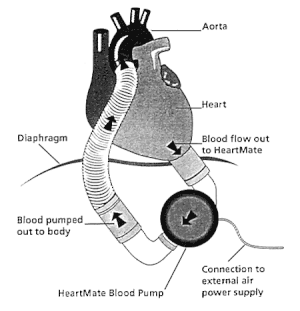
VADはその主な構成要素としてポンプ、脱血管、送血管、その他動作を制御するコントロールユニットや電源供給部から成り、ポンプの動作により心臓から脱血管を通じて吸引された血液が、送血管を通じて大動脈(右心補助の場合は肺動脈)に駆出される。送血管・脱血管は体外設置型VADではそれぞれ皮膚を貫通して体外のポンプと接続されるが、植込型VADではポンプと共に体内に植え込まれ、代わりにポンプの電力供給および制御を担うドライブラインが皮膚を貫通して体外のコントロールユニットに接続する。また植込型では電源供給はAC/DC電源とバッテリーの両方でできるようになっていることが多い。ポンプの駆動方式としては、空気圧によりダイアフラムポンプを駆動する空気圧駆動式や、モーターの回転により駆動する電磁力駆動式がある。またポンプの駆出機構の違いにより、駆出される血流は拍動流および定常流(連続流)の2種類のタイプが存在する。動作機構は各機種により大きく異なるが、以下に代表的な機種について概説する。
拍動流VAD
拍動流VADにはニプロVADやThoratec PVADなどの体外設置型と、HeartMateやNovacorなどの植込型があるが、拍動流植込型VADは小型化が難しく現在の植込型の主流は定常流VADに移行している。
拍動流体外設置型のニプロVADは空気圧によりダイアフラムポンプを駆動する空気駆動式である。ポンプ内部がポリウレタン膜(ダイアフラム)で空気室と血液室に分割され、血液室の流入部と流出部には人工弁が組み込まれていて、逆流を防止して血液が一方向へ流れるようになっている。空気室は空気駆動チューブと連結されており、空気室に陰圧をかけるとダイアフラムが空気室へ引き込まれ、血液が心臓から脱血される。陽圧がかかればダイアフラムが血液室に押されて、血液が大動脈へ駆出される。左心補助の場合は左室心尖部脱血・上行大動脈送血で行うことが最も多い。右心補助の場合は右房脱血・肺動脈送血が一般的である。Thoratec PVADやベルリンハートEXCORなども同様の空気駆動ダイアフラムポンプである。
定常流VAD
定常流VADのポンプ駆動方式には遠心ポンプ型と軸流ポンプ型の2種類がある。遠心ポンプ型はポンプ内部の羽根車(Impeller、インペラ)が回転することにより生じる遠心力で血液を吸引・駆出する機構を持つ。代表的な機種には第2世代定常流植込型のEVAHEARTや、磁気浮上による非接触軸受の機構を持つ第3世代定常流植込型のDuraHeartなどがある。DuraHeartは世界初の磁気浮上遠心ポンプを用いたVADで、インペラをポンプ内壁のどこにも接触させずに浮上させて回転させることにより、長期耐久性・抗血栓性を備えているという特徴がある。体外設置型でも、磁気浮上式の遠心ポンプを用いたCentriMagが米国で使用されている。一方軸流ポンプ型では回転するインペラ軸の前後に発生する揚力により血液を駆出する機構を持つ。軸流ポンプはインペラの高速な回転を要するものの、小型化には遠心ポンプ型より有利である。代表的な機種はHeartMate IIやJarvik 2000などがある。経皮的VADのインペラはカテーテル内に羽根車とモーターを備える軸流ポンプの定常流である。
適応
左心補助(LVAD)・右心補助(RVAD)・両心補助(BiVAD)
臨床において実施されるVADの大半は左心補助(LVAD)であり、本稿では以下断りのない限り単にVADと表記する。両心補助(BiVAD)は右心不全・左心不全が合併している症例に対して行うが、左心補助が強力な機器であれば左心補助単独で安定した循環動態が得られることも多い。また高度両心不全の症例では呼吸不全が合併していることが多く、通常の両心補助では動脈血の十分な酸素化が得られないため体外式膜型人工肺(ECMO、エクモ)を併用しなければならないこともあり、その場合左心補助に加えて右心補助(RVAD)として遠心ポンプに膜型人工肺を接続して右心補助を行う(RVAD-ECMOと呼ばれる)。呼吸不全が改善されればRVAD離脱可能となりLVADのみで血行動態を安定させることが可能となることが多いが、呼吸不全が改善しても右心不全が強い場合は、その時点で体外設置型VADに切り替え長期のRVAD補助を行うことになる。経皮的VADであるインペラは、2016年に日本で薬事承認を取得し、2019年現在、心原性ショック等の薬物療法抵抗性の急性心不全に対して適応される。
適応病態
VADの適応病態としては、開心術後の心不全症例、心筋梗塞後、心移植までのブリッジ(BTT: bridge to transplant、心移植までのつなぎのための使用)、心移植の代替としての永久使用(DT: destination therapy)などがある。日本においては、1997年に心移植が再開されるまでは開心術後の体外循環離脱困難や低心拍出量症候群、劇症型心筋炎などが主流であったが、心移植再開後は日本でもブリッジとしての使用が主流となっている。主な適応疾患としては心筋症(拡張型心筋症、肥大型心筋症、その他の特発性心筋症、二次性心筋症、虚血性心筋症など)、致死的不整脈による血行動態破綻、また単心室症、大血管転位症、右室流出路狭窄疾患などの先天性心疾患が挙げられる。
目的別の分類
VADの使用形態は、その使用目的に応じて以下のように分類される。
BTT: bridge to transplant
心移植までのつなぎ(ブリッジ/bridge)としての使用をBTT(bridge to transplant)と呼ぶ。2014年現在、日本で植込型VADの保険償還基準とされているのはBTTとしての使用だけであり、長期にわたる移植待機期間を乗り切るために使用されることが多い。日本臓器移植ネットワークに登録済であることが望ましいが、未登録の状態で植込み手術を行うこともあり、その場合は術後可及的速やかに適応判定を受け、臓器移植ネットワークに登録することになる。
BTC: bridge to candidacy
VAD植込みに際して心移植の適応判定が直ちに下せない場合もありうる。重症心不全症例で血行動態が破綻しかけている場合、しばしば腎不全や肝不全など他の臓器不全の合併が問題となる。しかし多くの場合、VAD植込み後に臓器不全が改善することが報告されている。そこで将来的に移植申請可能な状態に到達したら移植適応の判定をするという目的で、当面の移植適応の判断を保留してVAD植込みを行うことをBTC(bridge to candidacy)と呼ぶ。
DT: destination therapy
重症心不全で移植登録の可能性が全くない場合でも、内科的治療に加えてVAD治療を行うことで予後が改善することが報告されており、そのような症例に対する半永久的使用としてのVAD治療をDT(destination therapy)と呼び、長期在宅治療とも訳される。日本では2021年4月30日にHeartMate3がDT適用となり保険収載された。それに伴い、2021年3月19日に策定された植込型補助人工心臓DT実施基準に従い治療が開始されることとなった。欧米ではDTとしてのVAD植込みの普及が急速に進んでおり、長期予後も年々向上している。
BTB: bridge to bridge
体外設置型VADで全身状態が回復した後に植込型VADへの植替えを行うことをBTB(bridge to bridge)と呼ぶ。脱血用心尖部カフが同一サイズの場合(ニプロVAD → DuraHeart の場合など)は心尖部カフを付け替える必要はないが、心尖部カフを外した後に再度脱血カニューレ(Cannula)を装着する必要がある場合もあり(ニプロVAD → EVAHEART の場合など)、それぞれ手技が異なる。また、体外設置型VADで脱血管の出口部の感染を起こした場合はBTBは困難である。
BTD: bridge to decision
BTD(bridge to decision)とは、広義には心原性ショックとなった重症心不全症例で、心移植の適応判断ができるまでの救命手段としての体外設置型VADの装着を指す。しかし狭義には、体外設置型VADの適応も不明な症例に対する装着を指すことが多い。日本では未導入であるが、欧米ではTandemHeart、Impella、CentriMagなどがBTD用のVADとして使用可能である。
BTR: bridge to recovery
重症心不全患者で自己の心機能が回復することを期待してVADを装着することをBTR(bridge to recovery)と呼ぶ。ただし、心機能が回復してVADから離脱できる割合は全植込み症例の数%〜10%程度であり、必ずしも植込み当初から回復することを目標にするわけではない。なお、劇症型心筋炎や周産期心筋症で心原性ショックとなった場合に救命目的に体外設置型VADを装着し、その後回復する場合もBTRと呼ばれる。
適応基準
重症度によるVADの適応基準は、下の表に示すINTERMACS Profile 1〜7で、日本ではINTERMACS Profileをモデルに作成したJ-MACSレベル(基本的にINTERMACSと同等)にて規定されている。原則として、Profile 1は体外設置型VADの適応、Profile 2〜3は植込型VADの適応とされる。Profile 4に属する症例は、薬物治療が困難な不整脈や、強心薬に対するアレルギーなどの特殊な理由がある症例に限り植込型VADの適応とされている。なお、個々の病態に対する日本の植込型VADの適応は、関連学会が2010年に厚生労働省に提言した「植込型補助人工心臓」実施基準(2010.11.16案)に集約されており、症例の選択基準・除外基準、施設基準、実施医基準がそれぞれまとめられている。
| Profile | INTERMACS | J-MACS | INTERMACSのニックネーム | VAD適応決定までの時間 |
|---|---|---|---|---|
| 1 | Critical cardiogenic shock | 重度の心原性ショック | Crash and burn | hours(時間単位) |
| 2 | Progressive decline | 進行性の衰弱 | Sliding fast | days(日単位) |
| 3 | Stable but inotrope dependent | 安定した強心薬依存 | Dependent stability | few weeks(週単位) |
| 4 | Resting symptoms | 安静時症状 | Frequent flyer | months(月単位) |
| 5 | Extertion intolerant | 運動不耐容 | House-bound | |
| 6 | Exertion limited | 軽労作可能状態 | Walking wounded | |
| 7 | Advanced NYHA III | 安定状態 |
体外設置型と植込型の相違点
体外設置型VADと植込型VADはそれぞれにメリット・デメリットがあり、状況・病態に応じていずれの適応かを考慮する必要がある。植込型と比較した体外設置型の欠点と利点を以下に挙げる。
- 体外設置型の欠点
- 体外設置型では血液ポンプが体外に設置されることから、何らかの原因による血液ポンプの牽引によって送脱血管の抜去事故や屈曲の危険があり、慎重な管理が要求される。このため、VAD装着患者の行動が制限されるという欠点があり、特に日本では入院加療が原則となっている。また体内と血液ポンプを太い送脱血管で繋いでいるため、植込型より感染症のリスクは大きい。
- 体外設置型の利点
- 逆に体外設置型の利点として、植込みのための部品が不要であり、耐久性の保障もより短期でよいため、低コストで機器の作製が可能な点がある。またもう一つの利点として、植込型VADと異なりポンプポケットを作成する必要がないため、小柄な体格の患者にも使用可能である。また血液ポンプに故障や血栓形成が生じた場合に体外部品の交換だけで対処が可能であることも、トラブル発生時の利点として挙げられる。
植込み手術
手術実施時期
VAD装着手術は腎機能・肝機能や肺血管抵抗上昇などの臓器障害が進行する前に行うことが望ましい。VAD装着のタイミングを考慮する際には前述のINTERMACS Profileが有用であるが、初回手術の場合Profile 3が最も良い植込み時期であり、遅くともProfile 2の段階で植込みを行うことが好ましいとされる。
手術手技
手術手技(ニプロVAD)
ここでは日本で使用されている体外設置型VADであるニプロVADについて、植え込み手術の手技を述べる(左室心尖脱血方式)。
体外循環確立までの手順は通常の開心術と概ね同様である。まず全身麻酔下に開胸後、ヘパリン投与前に送血・脱血カニューレの皮下トンネルを作成しておき、その後人工心肺による体外循環を開始する。上行大動脈にパーシャルクランプをかけて切開し、切開部に送血カニューレを吻合する。次に脱血カニューレの装着は、左室心尖部への脱血カフの装着、パンチャーによる左室心尖部の切除、脱血カニューレの心尖部カフへの挿入の順に行い、最後に脱血カフを結紮固定する。最後に、皮下トンネルを通じて体外に出した送血・脱血カニューレを十分に空気抜きを行った後血液ポンプに接続し、空気の混入がないことを確認した後にVADの血液ポンプを駆動、体外循環からの離脱を行う。
手術手技(植込型VAD)
植込型VADの装着手術の一般的な手術手技について述べる。
全身麻酔下に開胸後、血液ポンプをポンプポケットに収納する場合はヘパリン投与前に作成しておく。ただしJarvik 2000などポンプ自体が左室内に埋め込まれる機種ではポンプポケットを作成する必要がない。その後ヘパリン投与、体外循環を開始し、体外設置型VADと同様に上行大動脈にパーシャルクランプをかけて切開し、送血カニューレを吻合。続いて脱血カニューレの心尖部への装着も同様に行う。そしてドライブラインを皮膚を貫通させて体外に導出する。血液ポンプを接続し十分な空気抜きを行った後に、体外循環から離脱、VADを駆動させる。
術後管理
術後管理は通常の開心術と大きくは変わらない。カテコラミンによる循環補助の減量は右心機能や左室径を心エコーでモニターしながら慎重に行う。人工呼吸器からの離脱は通常の開心術と同様である。VAD装着術後に注意すべき主なポイントは、心タンポナーデ、右心不全、カニューレのサッキングの3点である。
- 心タンポナーデ
- ドレーン排液の出血が落ち着いた後に、中心静脈圧が十分であるにもかかわらずVADのポンプ流量が低下してきた場合は心タンポナーデの合併をまず疑う。心エコーでタンポナーデを確認したら、躊躇せずに血腫除去手術を決断する必要がある。
- 右心不全
- 右心不全はVAD装着を受けた患者の25%程度に起こる。血行動態は心タンポナーデと類似した血行動態になり、ドレーン出血が少ないにもかかわらず、あるいは心エコーで心嚢液貯留を認めないにも関わらず、VAD流量が低下し中心静脈圧が上昇してくる。多くの場合、心エコーで右室の拡大と左室の狭小化が見られ、肺動脈圧は正常か軽度上昇にとどまる。
- サッキング
- サッキングを起こす場合は左室内腔の狭小化か、脱血カニューレの位置不良が原因となる。左室狭小化の原因としては循環血液量の不足、右心不全、肺高血圧、心タンポナーデ、過剰なVAD補助などが挙げられる。
ドレーン出血が落ち着いてから抗凝固療法を行う(術後48〜72時間は不要である)。内服では、機種によって多少の違いはあるがPT-INR 2.0-3.0を目標にワーファリンを投与し、数日後にアスピリンを追加投与する。経口摂取ができなければ、ACT 140秒程度を目標にヘパリンを静脈投与する。
術後合併症対策
装置の不具合
VAD術後早期のポンプの機能不全の原因としては、ポンプ本体の異常、送血・脱血管の位置不良や折れ(kinking)による脱血障害、血液ポンプ停止などがあり、これらの状況に対しては緊急手術を要する。血液ポンプ以外の機能不全の場合は各パーツの交換で改善することもあるが、それでも解決しない場合は血液ポンプも含めた全システムの交換が必要になる。
感染症
VAD植込み患者は術前から肝機能障害や腎機能障害、低栄養状態などを合併していることが多く、通常の開心術より術後感染症を合併するリスクが高い。また中心静脈カテーテルや肺動脈カテーテル、大動脈内バルーンパンピングが留置されている場合もあり、カテーテル関連血流感染症のリスクも高い。術後に発熱や炎症反応(白血球やCRPなど)の再上昇を認めた場合は、血流感染のハイリスク群であることを考慮し、抜去可能なカテーテル類は早期に抜去するとともに、血液培養も積極的に行う。抗生剤は最初は広域抗生物質を開始した後、起炎菌が同定されたら感受性をもとに抗菌スペクトルを絞った薬剤への見直しを行うことが望ましい。
神経機能障害
術後に何らかの神経学的異常所見を認める場合は、頭部CTを施行して脳出血やクモ膜下出血などの出血性病変か、あるいは一過性脳虚血発作や脳梗塞などの虚血性病変か、などの鑑別を行う。 出血性病変の場合には頭蓋内出血に対する一般的治療を行うと同時に、新鮮凍結血漿(FFP)や第IX因子製剤、濃厚血小板などの使用を検討する。開頭血腫除去術を含む外科的治療についても検討を行う。虚血性病変の場合は、一過性脳虚血発作や脳梗塞に対する治療に加えて適切な抗凝固療法を継続する。
在宅管理
体外設置型VADを装着している患者は退院することができず原則として長期の入院が必要になるが、植込型VADでは状況により外出・外泊ができ、退院も可能である。本節では植込型VAD装着患者の在宅管理および日常生活について述べる。
在宅機器管理
在宅療養中の機器の日常点検は患者自身(患者が不可能な場合は介護者)が行い、医療従事者は定期外来受診の際に点検を行う。定期的に交換をする部品がある場合は、外来受診に合わせて交換作業を行う。また機器に不具合が発生した場合、患者は医療施設に連絡し、医療従事者の指示により必要に応じて外来受診し駆動状態の確認を行う。一方植込型VADを管理する施設は、常に緊急対応ができる体制を構築しておく必要がある。
抗血栓療法
在宅管理中の抗血栓療法は、抗凝固療法としてのワーファリンと抗血小板薬の併用が基本となる。抗血栓療法は特に生命予後、日常生活活動(ADL)の維持に直結する重要な事項となるため、患者および家族がその重要性を理解し適切な内服管理が継続されるとともに、定期的な外来通院による内服量の調整が必要である。
ワーファリンの投与量はPT-INRを測定しながら各機種ごとの目標値の範囲におさまるように管理する。植込型VADの主な機種について、PT-INR値の目標値を下表に示す。医療施設のみならず在宅においても自己検査用血液凝固分析器を用いてPT-INRの測定を行うことが可能であり、必要に応じて行う。抗血小板薬はアスピリン(バイアスピリン)の使用が一般的であり、抗血栓療法の効果と出血などの合併症のリスクを検討しつつ必要に応じてクロピドグレルへの変更または併用を検討する。
| 植込み機種 | 目標PT-INR |
|---|---|
| DuraHeart | 2.0 - 3.0 |
| EVAHEART | 2.5 - 3.5 |
| HeartMate II | 1.5 - 2.5 |
| Jarvik 2000 | 2.5 - 3.5 |
ドライブライン・創部の管理
ドライブラインはVADの駆動や制御に必要な配線であり、これは皮膚を貫通して体外へと伸びている。このドライブライン皮膚貫通部を消毒する際は、まず清潔を保ちながら観察を行い、疼痛、発赤、出血、滲出液、不良肉芽の形成、臭気の有無などを確認する。また周囲の皮膚についても、保湿状態、皮膚剥離、発赤の有無を確認する。またシャワー浴では、身体の清潔を保つこと、ドライブラインの皮膚貫通部を清潔にすることが重要である。シャワー終了後は水分をよく拭き取り乾燥させる。
その他の日常生活
- 旅行
- 旅行に際しては、非常時に備えて機種に応じた電源、バックアップ機器の携帯を行う。宿泊を要する旅行の場合は宿泊先に接地極付きの3つ穴のコンセント(3Pコンセント)が設置されているかを確認しておく。航空機に搭乗する場合は、機器をX線検査に通すのではなく手による検査を受けられるように保安検査に関しての取り決めが必要になるため、事前に担当医と十分に相談しておく。
- 性生活
- 植込型VADを装着して退院できた患者の多くが性生活に興味を持つようになり、30〜40%で性生活を行うことができたとの報告もある。通常の安定した夫婦間での性生活は運動強度1.3〜1.8METs(安静時の1.3〜1.8倍)程度であり、術後の安定した時期には十分可能と考えられるが、ドライブライン刺入部への接触やドライブラインを引っ張ったり、無理な力がかかったりしないよう注意を要する。また、性生活により心不全症状の増悪の可能性があるため、事前に担当医とよく相談しておく。
- なお、妊娠は禁忌である。胎児の成長による血液ポンプの損傷の可能性があることと、抗凝固薬は催奇性や習慣性流産をきたす可能性が指摘されているためである。よって、VADを装着した女性が性生活を行う際は、必ず避妊する必要がある。
- スポーツ
- 継続した運動は心肺機能を高める上でも重要であり、可能な範囲での活動拡大は推奨される。ただし、相手との接触の多いスポーツ(例えばバスケットボールやラグビーなど)は機器の故障や出血の危険性が考えられるため避ける必要がある。
在宅療養中の患者および機器の駆動状態のチェック項目について、下表にまとめて示す。
| 実施者 | 頻度 | 内容 | |
|---|---|---|---|
| 自己管理 | 患者 | 毎日 | 体温、体重、血圧、抗凝固療法、皮膚貫通部の状態、服薬内容、機器の駆動状態 |
| 診察 | VAD管理チーム | 月に1回 | 全身状態、血行動態、抗凝固療法、感染の有無、皮膚貫通部の状態、投薬内容・服薬状況、機器の駆動状態 |
| 治療成績評価 | VAD管理チーム | 6 - 12ヶ月に1回 | 運動能力(6分間歩行検査、心肺運動負荷試験など)、血行動態(心エコー)、QOL(SF-36・EuroQolなど)・精神神経機能評価(ミニメンタルステート検査、トレイルメイキングテストなど)、その他の検査(頭部CT検査、胸部CT検査) |
遠隔期手術
ブリッジ症例からの心移植
心移植についての詳細は同項目に譲るが、VAD装着中の患者はVAD植込み手術を含めて1回または複数回の開胸術を受けているため、VAD装着状態からの心移植では癒着剥離に時間を要することを十分に念頭に置いた手術計画を立てることが重要である。癒着剥離にはニプロVADやDuraHeart、Jarvik 2000の場合2〜2.5時間、EVAHEARTの場合は癒着が強固であると3時間以上かかることがある。原則的には、ドナー第3次評価で心臓が移植可能であることを確認してからレシピエントの全身麻酔を導入する。また、最終評価でドナーの心臓に問題がないことを確認してから皮膚切開を行うことが一般的である。これまでの日本における摘出手術の実績から、ドナー心の最終評価から心臓摘出完了まで60〜75分、ドナー大動脈遮断から摘出完了まで10〜15分である。臓器提供病院から移植病院までの搬送時間は移植コーディネーターが概算してくれるので参考にする。レシピエント手術は、ドナー心が手術室に到着する予定時刻までに摘出準備が完了しているか、心臓摘出が完了していることが望ましい。
VAD離脱
患者の心機能が回復して自己心の拍動のみで循環を保つことが可能となった場合は、VADを心臓から取り外す(離脱)ことができる。離脱の可否の判断は、ヘパリン投与後にVADポンプの駆動を停止して心エコーや肺動脈カテーテルで心機能を見る検査(オフテスト、off-pump test)による。離脱基準としてはベルリングループの基準が一般的で、心エコー上左室駆出率(EF)≧45%、左室拡張末期径(LVDd)≦55mmで離脱可能と判断する。ただしこの基準を満たさなくても、EF≧30%、LVDd≦65mmに加えて、VADのポンプ停止下にEFの低下や肺動脈楔入圧の上昇を認めないという拡大基準も提唱されている。また、ベルリングループのようにVAD管理に精通したスタッフが多くいる施設の基準を経験の乏しい施設でそのまま適用するのは困難な場合もあり、それを考慮したより詳細なフローチャートがピッツバーグのグループから提案されている。
離脱手術の際には、術中に改めてポンプ停止状態での心機能に問題ないことを確認してから、送脱血カニューレを除去しポンプを摘出する。心尖部カフは柔らかければカフを残して心尖部を縫合閉鎖する。カフが固くて閉鎖できない場合は人工心肺による体外循環下にカフを摘出するか、あるいはカフにフェルト製プラグを挿入して閉鎖する方法もある。カフを縫合せずプラグを挿入して閉鎖した場合は、再度心不全が増悪した場合にカフを再使用できる。
非心臓手術におけるVADの管理
VADによっては、電気メスの使用などによって生ずる電気的干渉が、VADの電気回路を障害する可能性がある。時間設定回路が外部コントローラーに内蔵されている機種は電気的干渉から保護されているものの、回路が装置内にある場合は完全に防御されるわけではない。その場合は時間設定回路を非接続とし、固定レートにする。電気メスは1回あたりの使用時間を短くし、使用間隔を長めに取る。
また、VAD装着患者は日常的に抗血小板薬や抗凝固薬が投与されているため、緊急手術を行った場合は出血性合併症の発生する頻度が高く、血液成分の頻繁な輸血が必要となることが多いが、そのような状況における抗線溶薬の有用性は確立されていない。緊急性の低い手術では、術前に経口の抗血小板薬や抗凝固薬を一時的に中止し、凝固機能が正常化するまで十分な時間をとるべきである。
臨床成績
2005年の報告ではVAD治療による2年生存率は60%程度であるが、2014年の日本での統計では1年生存率88%、2年生存率でも8割以上と年々改善しており、将来的に心移植の成績に匹敵する可能性が期待されている。また心移植へのブリッジ治療では、欧米でFDA認可を得ているHeartMate LVAD、Novacor LVAD、Thoratec PVADを用いた症例の平均補助期間は45〜148日である。一方日本では1992年から2006年の14年間・850例(内302例が心筋症症例)の集計で、全症例の平均補助期間は284日、体外設置型のニプロ(東洋紡)VADを用いた症例の平均補助期間は356日、最長補助期間は1444日であり、欧米の同様の体外設置型VADであるThoratec PVADに比較しても長期の補助に成功している。心筋症に対するVAD治療の補助継続中も含めた生存率が50%(152症例)という成績であり、日本におけるVAD治療は欧米先進国と比較するとより重症例に対する適応となっていることを考慮すると極めて優れた成績を挙げていると言える。
日本では心移植症例数は未だ制限された状況にあり、2010年の改正臓器移植法により心移植の脳死ドナーが増加したとはいえ、依然として2年以上の長期にわたる移植待機期間が必要である。そのため代替治療としてのVAD治療の重要性は大きく、今後のさらなる治療成績の向上が望まれる。
完全埋込型植込型VAD
植込型VADが心移植の完全なる代替治療となるためには、術後遠隔期の感染症の原因となっている皮膚を貫通するドライブラインをなくす必要がある。これまでに完全埋込みを実現した機器として空気駆動式のLion Heart(アロー社、ペンシルバニア州立大学)が臨床導入されたが、治験事務局の段階で長期成績が得られずに中止となっている。またソラテック社はコントローラー・バッテリー・エネルギー伝送装置が一体となったモジュールを開発中でおり、次世代型の植込型VADにおいて完全埋込みを実現しようとしている。将来的に完全埋込型の植込型VADが完成した暁には、心移植の完全な代替治療となる可能性が期待されている。
脚注
注釈
参考文献
- 日本循環器学会. 循環器病の診断と治療に関するガイドライン2013, 2011-2012年度合同研究班報告 - 「重症心不全に対する植込み型補助人工心臓ガイドライン」. ISSN 2186-5973
- 高本眞一 監修・許俊鋭 編集. 心臓外科 Knack & Pitfalls 心不全外科治療の要点と盲点. 文光堂. ISBN 978-4-8306-2334-9.
関連項目
外部リンク