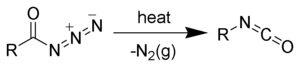アジ化物
アジ化物(アジかぶつ、azide)とは −N3 原子団を持つ化合物の総称である。アジ化物イオン (N3−) の塩も、置換基であるアジ基 (−N3) が共有結合した化合物もアジド (azide) と呼ばれる。特にアシル基にアジ基が置換した化合物を酸アジドと呼ぶ。
アジ化物塩は爆発性を示すものが多く、重金属塩は爆発物の信管に利用される(アジ化鉛に詳しい)。金属のアジ化物は消防法第2条第7項及び別表第一第5類10号、危険物の規制に関する政令第1条により危険物第5類に指定されている。アジ基を持つ有機化合物の大半は爆発性を示さないが、常圧蒸留等で過熱した際に爆発するものも一部存在する。
アジ化物イオンもアジ基も直線構造ではなく、僅かに曲がっている(約172度)。
有機アジ化物の合成、反応
合成
アジ化物イオンは求核性が高いために、ハロゲン化アルキルやスルホン酸エステルなどに対する SN2 反応で有機アジ化物が合成される。
光延反応によって調製することもできる。
反応
有機アジ化物に水素化アルミニウムリチウムなどの還元剤あるいはリン化合物を作用させることでアミンとすることができ、これはガブリエル合成と並ぶ有力な一級アミンの合成法となっている。
有機アジ化物は光または熱で分解すると、相当するニトレンが発生する。
カルボン酸アジドはクルチウス転位を経由してイソシアナートに変わる。イソシアナートにアルコールが付加するとウレタン(カルバマート)に、加水分解によりアミンとなる。
またアミンと反応してアミド結合を作る。
アジドは1,3-双極子であるので、各種不飽和結合と [3+2]型の付加環化反応を起こす。例えばニトリルに付加してテトラゾール環を与える。またアルキンとも反応し、1,2,3-トリアゾールを形成する。この反応は銅イオンの存在下で加速され、水や各種官能基の存在に影響を受けず極めて収率よく進行する。バリー・シャープレスらが推進するクリックケミストリーの中心的な反応として注目を浴びている。例を図示する。
この付加環化反応は、最初の報告者ロルフ・フーズゲンにちなみフーズゲン環化とも呼ばれる。
主なアジ化物
- アジ化水素
- アジ化ナトリウム(毒劇法・毒物)
- アジ化鉛
- ジフェニルリン酸アジド (DPPA)
- 5-アジド-1-(ジアジドメチレンアミノ)-1H-テトラゾール - 別名:アジドアジドアジド
危険性について
一般にアジ化物には爆発性があり、取り扱いに注意を要する。これを安全に取り扱うため、経験的に以下のことが知られている(ただし例外もあり、絶対ではないので注意)。
- 重金属のアジドは一般に爆発性が強い。このため例えばアジ化ナトリウムをステンレスのスパーテルですくうだけで爆発を起こすことがある。アジ化ナトリウムの計量にはプラスチックか、シリコンコーティングされたスパーテルを用いるのが無難である。
- ハロゲン系溶媒、たとえばジクロロメタンは、アジ化ナトリウムと反応して爆発性の強いジアジ化メタンを生成するため、アジ化物イオンを含む水層からの抽出溶媒には不適である。また、濃縮後に残存した微量のハロゲン系溶媒にも注意が必要である。
- 有機アジ化物は、アジ基1つに対して6つ以上の重原子(水素を除く、炭素・酸素・窒素など)が分子内に含まれている場合、その爆発力が「希釈」されて安全に取り扱えることが多い。これはニトロ基やジアゾ化合物など、他の爆発性官能基の場合でも同様である。この経験則を「6炭素則」や"rule of six"と呼ぶことがある。
- アジ基が、芳香環・オレフィン・カルボニルなどsp2炭素に結合している場合、ほぼ同じ条件のアルキルアジドに比べて爆発性が高い。




![{\displaystyle {\ce {{R-N3}+->[{\mathit {heat\ or\ light}}]R-N}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b54c6195c086e94d54878907a91bc45ce935018c)