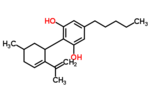
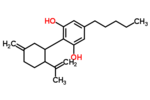
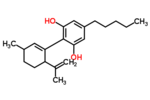
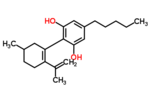
カンナビジオール

| |

| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 販売名 | Epidiolex |
| Drugs.com |
国別販売名(英語) International Drug Names |
| 法的規制 |
|
| 薬物動態データ | |
| 生物学的利用能 | 13–19% (oral), 11–45% (mean 31%; inhaled) |
| 半減期 | 9 h |
| 識別 | |
|
CAS番号 |
13956-29-1 |
| ATCコード | None |
| PubChem | CID: 644019 |
| IUPHAR/BPS | 4150 |
| ChemSpider |
24593618 |
| UNII |
19GBJ60SN5 |
| KEGG | D10915 |
| ChEBI |
CHEBI:69478 |
| 化学的データ | |
| 化学式 | C21H30O2 |
| 分子量 | 314.4636 |
| |
| 物理的データ | |
| 融点 | 66 °C (151 °F) |
| 沸点 | 180 °C (356 °F) (range: 160–180 °C) |
カンナビジオール(国際一般名:Cannabidiol)、略称CBDは、麻に(薬用の大麻以外にも)含まれる、少なくとも113あるカンナビノイドのひとつ。主なフィトカンナビノイドで、麻の抽出物の計40%までの割合を占めることもある。商品名エピディオレックスとして、アメリカで2018年に医薬品に承認、欧州では2019年に承認。
多くの試験から良好な安全性の特徴、忍容性があり、テトラヒドロカンナビノール (∆9-THC、以下THCと表記) のような典型的な効果(精神作用)はなく、乱用、依存、身体依存、耐性はみられない。CBDは広く医療への応用の可能性があるとみなされている―臨床報告によると、副作用が少なく、特に向精神作用がなく、精神運動学習や心理的な機能に影響がない事などがその理由である。医薬品としての治験が完了しているものがあり、また規制を緩和した国が見られる。
薬物規制に関する国際条約による規制はない。健康食品や化粧品成分としても流通している。日本で流通しているものは規制対象ではない麻の茎と種から抽出されている。健康食品としてのCBDは、オイルやバーム、キャンディーなどに加えられ摂取される。日本では2020年頃から、既成の輸入食品ではなく、CBDを輸入し国内で食品を加工する国産ブランドが台頭してきた。
アメリカ政府が所有する特許「抗酸化物質、神経保護物質としてのカンナビノイド」特許番号:6630507にリストされている物質である。
医薬品製剤
ナビキシモルス(USAN、商品名サティベックス)は、CBDとTHCとの比率が1:1に近い経口投与用スプレーである。 この薬は、多発性硬化症に伴う疼痛を緩和するために、2005年にカナダ当局に承認された。
エピディオレックスは、難治性てんかんの臨床試験を実施した、大麻から抽出されたCBDの油脂配合物である。エピディオレックスは、2015年7月にアメリカにおいてドラベ症候群などの治療薬としての希少疾病用医薬品の指定を受け、治験は完了し、2018年に承認された。
エピディオレックスは、欧州医薬品庁 (EMA) からも、2017年にレノックス・ガストー症候群など治療抵抗性のてんかんの希少病用医薬品の指定、2018年に結節性硬化症の同指定とまた治験が進行している。続いて、欧州では2019年9月にドラベ症候群とレノックス・ガストー症候群に対して医薬品として承認された。
日本では2019年に臨床試験という位置づけで、エピディオレックスの使用が許可され、聖マリアンナ医科大学が治験の申請準備を開始した。これに対し、日本てんかん学会、日本てんかん協会、日本小児神経学会、ドラベ症候群患者家族会は連名で早期承認を要望した。
オランダではエコー製薬による、Arvisolという経口錠剤の治験第I相(初期段階を意味する)が進行しており、対象はてんかんと統合失調症である。
また、FDAとEMAは、新生児の窒息に伴う脳障害の治療に用いる希少疾病用医薬品としてカンナビジオールを指定したが、これに対する既存の医薬品はなかった。
研究
2018年には、世界保健機関がカンナビジオールに関する科学的根拠の調査が完了し、治療の可能性を示すための初期的な科学的根拠があり、乱用や依存の報告はないとした。
てんかん
ドラべ症候群は治療の難しい稀なてんかんである。壊滅的な難治性てんかんで、乳児期に始まる。初期の発作は通常、長時間にわたる発作で、2歳の頃には他の様々な症状が現れてくる。
GWファーマシューティカルズが、大麻から抽出した液体状のCBDを、ドラべ症候群の治療薬として商品名エピディオレックス(カンナビジオール99%・THC0.10%以下)としてアメリカ食品医薬品局 (FDA) の医薬品の承認を申請した。 エピディオレックスは通常よりも迅速な承認の手続きを経ており、初期の良好な治験結果を踏まえてきた。 2018年6月にアメリカで医薬品として承認された。
またCNNの番組など、メディアなどに取り上げられ、ドラべ症候群の治療にカンナビジオールを使用する事に関心が高まった。CBDを含有する抽出物は栄養補助食品として販売されておりドラべ症候群への効果が報告されている。その一つがシャーロッツウェブの名前で販売されているものである。
精神病
CBDに抗精神病作用があるとする暫定的な証拠があるが、この分野での調査は、まだ限られているとする2013年と2016年のレビューがある。2017年12月に発表された統合失調症に対する88人での多施設のランダム化比較試験では、1日1000mgのCBDの投与で6週間後には陽性症状(幻覚・妄想)が少なく、またドーパミン受容体への拮抗作用ではない新しい治療法の可能性を示した。
社交不安障害
2011年に行われた二重盲検のランダム化比較試験では、それまで治療を受けた事がない24人の社交不安障害(SAD)患者と、同数の健常者を12人ずつの4グループに分け、一方に600mgのCBDを、もう一方には偽薬を投与して、人前でのスピーチを行なったところ、CBDを摂取したグループでは、偽薬のグループと比較して、不安と認知行動が有意に改善し、健常者のグループと比較して、評価に違いが見られなかった。
皮膚
2018年には、CBDを含有するスキンケア製品も様々に登場しているが、人間での研究は初期の段階であり炎症性の皮膚病に可能性がある。
副作用
多くの試験から良好な安全性の特徴、忍容性がある。ヒトにおけるCBDの安全性に関して行われてきた複数の小規模での研究では、1500 mg/日(経口摂取)か、30 mg(点滴)までの摂取量ならば、十分な忍容性が認められている。毒性は、極めて高い投与量でない限り生理、生化学的に重要な効果を持たないといったことは判明しており、すべての潜在的な作用が判明しているものではないが、比較的低い毒性である。
THCのような典型的な効果やドーパミン遊離作用はなく、動物研究およびヒトで乱用、依存、身体依存、耐性はみられない。
カンナビジオールはときに倦怠感、下痢、食欲の変化を生ずる。エピディオレックスの添付文書では、眠気、不眠、睡眠の質の低下、食欲低下、下痢、倦怠感などが注意喚起されている。
薬理
カンナビジオールはカンナビノイド受容体のCB1とCB2に対し、非常に低い親和性を示すが、間接的な拮抗剤として機能している。このことから、CBDがTHCの効果を減少させるのではないかと考えられるが、逆に、CB1受容体の密度を上げたり、CB1受容体に関連した経路でTHCの効果を上昇させる可能性もある。
カンナビジオールは、尾状核や線条体に発現するカンナビノイド受容体とみられる GPR55、G蛋白質共役型受容体の拮抗剤である。また、CBDは、5-HT1A 受容体の部分アゴニストで、この性質が抗うつ、抗不安、神経細胞保護などのCBDの作用に関わっている可能性がある。CBDは μ および δオピオイド受容体の間接的な作動薬でもある。CBDの薬理効果はPPARyのアゴニスト、細胞内カルシウムの放出に起因する。
CBDは、脂肪酸アミド加水分解酵素 (FAAH)を抑制する事で、体内で生成されているアナンダミドなどの内因性カンナビノイドの濃度を上げる事によって、薬理作用を生じさせているようである。CBDの代謝物にも薬理作用があり、CBDの生理作用に貢献していると推測される。
薬物動態相互作用
カンナビジオールは、THCのクリアランスを減少させ、THCの血漿濃度を適度に上昇させ、受容体に利用可能なTHCの量を増加させ、用量依存的にTHCの効果を助長するという前臨床的な証拠がある。それにもかかわらず、ヒトに関する証拠では、THC血漿レベルに対するCBDの有意な効果を示唆していない。
カンナビシオールは、シトクロムP450のCYP3AとCYP2C酵素を阻害する事によって、THCの効果持続時間を伸ばす可能性もある。カンナビジオールの製品であるエピディオレックスの治験では、他の抗てんかん薬との相互作用は、クロバザムを除き血中濃度の変化は許容範囲内であった。
カンナビジオールを代謝できる酵素は、CYP1A1、CYP1A2、CYP2C9、CYP2C19、CYP2D6、CYP3A4、CYP3A5である。
化学
カンナビジオールは水溶性ではないが、ペンタンなどの有機溶媒には溶ける。室温では、透明な結晶の固体である。 強塩基性媒体および空気中では、キノンに酸化される。カンナビジオールの合成は、いくつかの研究グループによって達成されている。
生合成
麻は、CBDAシンターゼがTHCAシンターゼの代わりに触媒作用を行う最終段階まで、THCと同じ代謝経路を介してCBD-カルボン酸を生成する。
異性
社会と文化
以前はTHCの量が多ければいいと考えられていたが、2008年にアメリカで成分検査のためのラボが誕生し、2009年にはCBDがTHCに比べて比較的多い品種が見つかった。中には痛みに効いたが陶酔しなかったという声もあり、2010年には大麻薬局に持ち込まれるようになった。そしてCBDオイルが登場することとなり、それはリック・シンプソン・オイルの名でまだTHCの多い初の製品が出回った。
2018年よりカンナビジオールは世界ドーピング防止規程の禁止薬物から除外されるが、一部のアスリートは鎮痛を目的としてカンナビジオールを利用している。THCは禁止であるため、THCも多く含有する製品の検査前の使用は薬物検査で違反となるおそれがある。
自然からの調達
これまで米国の栽培者による品種の選択的な栽培は、大麻のCBD含量を劇的に低下させてきた。顧客が、より高いTHC、より低いCBD含有量によって得られる、より精神作用の強い品種を好んだためである。現在、患者らの需要により、栽培者達は、CBDが多く含まれる品種を栽培している。
法的位置付け
カンナビジオールは、向精神薬に関する条約によって規制されておらず、2018年の審査にても国際規制下に置かないことを決定した。CBDは、マリファナのTHCに関連する「高揚感」を引き起こさない。 医学的カンナビノイドとの違いに関する理解と法整備が進展するにつれ、「医療マリファナ」(様々な精神的効果と判断機能の障害が指摘される)を「医療CBD」と区別することがますます重要になるだろう。
様々な品種/系統の「医療大麻」は、CBDとTHCの比に大きな多様性があり、他の向精神性のないカンナビノイドを含むことが知られている。CBDを抽出する目的で使用される植物材料が麻と考えられているのか、マリファナと考えられているのかを化学的に判断する材料は、植物の形態ではなくTHCの量である。
あらゆる精神活性マリファナは、そのCBD含量にかかわらず、麻の花(または花穂)に由来する。 米国での基準として、精神作用のない麻(一般に産業用大麻とも呼ばれる)は、そのCBD含量にかかわらず、成長しているか否かにかかわらず、乾燥重量比で0.3%以下のΔ-9テトラヒドロカンナビノール濃度しか含有しない麻である。麻の合法的な栽培と生産には一定の基準が必要で、コロラド州産業麻プログラム (Colorado Industrial Hemp Program) は、工業用麻およびサンプル作物の生産者を登録して、THC濃度が乾燥重量基準で0.3%を超えないことを確認している。
日本
日本では種子や茎から抽出されたCBDは規制対象ではない。CBDは日本法における規制対象物質には含まれておらず、大麻取締法の第1条は、葉と花穂、その製品を規制しており、種子と茎、その製品を除外しているためである。健康食品として扱われているが、含有量の少ない部位から抽出しているため製品は高額となり、健康保険も適用されない。
2020年時点で、THCを含有する製品については、大麻由来か確認できないため大麻研究者などの許可がなければ原則輸入できないとしている。
アメリカ
2013年にシャーロッツウェブを特集したCNNの番組は、米国内のCBDの含有量が多い麻の需要を増加させた。ケンタッキー州では2013年に法律が制定され、農作物の市場を失っているタバコ農家を支援する経済開発プログラムとして、その州で麻農業を促進した。 2014年農業法の条項に同意し、ケンタッキー州などの麻生産を合法化した。
2015年までに、カリフォルニア、コロラド州、インディアナ州、メイン州、モンタナ州、ノースカロライナ州、ノースダコタ州、オレゴン州、サウスカロライナ州、テネシー州、バーモント州、ウェストバージニア州を含む、少なくとも12州が産業用大麻の生産を合法化した。コネチカット州、デラウェア州、ハワイ州、イリノイ州、ケンタッキー州、ネブラスカ州、ユタ州を含む、パイロットプロジェクトや研究のための産業用大麻の栽培を認可する法律が、他の多くの州で成立した。さらに、全米州農務省協会 (National Association of State Departments of Agriculture) および全米州議員協議会は、産業用大麻の商業生産を許可する連邦規則および規制の改正を支持する決議を採択した。
スウェーデン
カンナビジオールは医薬品に分類される。
オーストラリア
大麻に含まれる他のカンナビノイド(THCなど)の2%(2.0%)以下を含有する治療用医薬品(スケジュール4)。
ニュージーランド
2017年に規制が変更され、医師による処方薬となった。
カナダ
カンナビジオールはスケジュールIIに分類される。そのため処方箋でのみ利用可能。
イギリス
カンナビジオールは、処方薬(サティベックス)に含まれ、これはTHCと組み合わせた経口粘膜噴霧製剤で、多発性硬化症(他の抗痙攣薬が有効でない場合)による重度の痙攣の軽減に利用できる。
2016年12月31日現在、「医療目的で使用されている」カンナビジオールを含む製品は、英国の規制機関である医薬品およびヘルスケア製品規制機関(MHRA)によって医薬品に分類されている。したがって、CBD含有製品が「医療目的で使用」されている場合(例えば、その広告が薬効を謳う場合)、販売される前に製品ライセンスをとる必要がある。
欧州
欧州連合司法裁判所は2020年11月に、カンナビジオールは規制の範囲ではないとの見解を示した。大麻の繊維と種子のみを許可するフランスで大麻草全体から抽出されたカンナビジオールを扱った裁判がきっかけとなった判決である。大麻草全体から抽出したカンナビジオールはもはや農産物(植物そのもの)ではないため、(植物を規制する)麻薬に関する単一条約の規制する範囲ではなく、また現在の科学的知見から健康に有害ではないため、科学的データを欠いたまま規制を課せば「人類の健康と福祉」を保護するという条約の目的に反することになるとの見解を示した。
カンナビジオールは、EU新規食品カタログ (EU Novel Food Catalog)、EU化粧品成分データベース (EU Cosmetics Ingredient Database) に掲載されている。これは、単離または合成のCBDにのみ適用され、CBDを含有する粗製の麻抽出物やチンキには適用されない。
ヨーロッパ産業用大麻協会は、EUにおける規制枠組みを示唆するポジションペーパーを発行した。いくつかの品種の産業用大麻は、西ヨーロッパで合法的に栽培することができる。Fedora 17 などの品種は、1%以下のカンナビジオール(CBD)と約0.1%未満のTHCを含むカンナビノイドプロファイルを有する。
参考文献
- 世界保健機関「カンナビジオール(CBD)批判的審査報告書」(PDF)、2018年6月。世界保健機関 (2020年9月21日). “カンナビジオール(CBD)の批判的審査報告書とWHO勧告”. 日本臨床カンナビノイド学会. 2021年1月17日閲覧。
CBDを取り上げた一般向け資料
単行本
- 「CBDエッセンシャルガイド」ProjectCBD著,三木直子訳 晶文社 2022年1月27日刊 ISBN 4794972946
雑誌記事等
- 「奇跡の大麻が重度自閉症児を救う」『ニューズウィーク日本版』2018年3月13日号、p50-53。イスラエルでの研究を紹介。自閉症やてんかんに効果があるとの報告。
- 「新し物好きの誰かにあげるなら大麻成分入りは?」『ニューズウィーク日本版』2019年1月15日号、p64。CBDを配合したスキンケア、湿布、マスカラ、オイル、ガムドロップ、炭酸水などを紹介。
- 「グリーンラッシュがやってくる」『週刊ダイヤモンド』2019年11月30日号、p134-143。CBDの今後予想されるマーケット(薬品、食品、化粧品など)などについての詳しい紹介。
- 「ストレス緩和にCBDはいかが」『ニューズウィーク日本版』2020年6月16日号、p50-53。筆者が多数のCBD含有商品を試し、おすすめのものを紹介している。
- 「魅惑のCBD大全」『週刊SPA!』2023年3月14日号、p52-55。グミやオイルなどの多種の商品を紹介。編集部員がいろいろなCBDの商品を試している。
関連項目
外部リンク
- Project CBD 日本語版 - カンナビジオールの医学的有用性の研究の促進と宣伝に特化した非営利の教育サービス。マーティン・A・リーによる。
-
日本臨床カンナビノイド学会 - カンナビノイド、特にカンナビジオールの医療効果を研究する学会。
- 欧州のCBD製品に関する報告書「欧州の低THC大麻製品」が発行 日本臨床カンナビノイド学会
- CBD製品の大麻非該当性の確認について(麻薬取締部)