脂肪酸の合成
脂肪酸の合成(しぼうさんのごうせい、英:Fatty acid synthesis)は、アセチルCoAとマロニルCoAを出発物質として、飽和脂肪酸(特にパルミチン酸)や不飽和脂肪酸(オレイン酸など)などが生合成される過程をいう。脂肪酸の合成という場合、長鎖脂肪酸の一つであるパルミチン酸の合成、およびそこからさらに続く炭素鎖の伸長反応や不飽和結合の導入などの過程を指す場合が多い。対して短鎖・中鎖脂肪酸は、より長い炭素鎖の脂肪酸のβ酸化や炭水化物の発酵などによって生じるため、「脂肪酸の合成」という言葉には通常含めない。飽和脂肪酸の合成は脂肪酸合成酵素(fatty acid synthase; FAS)によって触媒され、I型およびII型の2種類が知られている(FAS IとFAS II)。一方、不飽和脂肪酸の合成には嫌気性および好気性の2つの経路が知られている。大部分の細菌が嫌気性経路を保持しており、好気性経路はシアノバクテリアおよび真核生物に分布している。
脂肪酸はバクテリアおよび真核生物では細胞膜の主要構成物質であるため普遍的に合成されている。対して古細菌では一部の種にしか脂肪酸は見つかっておらず、その役割もよく分かっていない。
直鎖型の飽和脂肪酸合成
天然に存在する飽和および不飽和脂肪酸は、多くが偶数炭素数で分岐のない直鎖型の脂肪酸(even-chain fatty acid)である。ただし、種によって分岐脂肪酸で細胞膜の大部分が構成されている場合もある。
プライマー合成
脂肪酸合成の出発物質(プライマー)はアセチルCoA(炭素数2)とマロニルCoA(炭素数3)である。ヒトにおいては、炭水化物が解糖系を経てピルビン酸に変換され、さらにミトコンドリアにおいてピルビン酸デヒドロゲナーゼ複合体によりピルビン酸からアセチルCoAが生成する。ミトコンドリアで生産されるアセチルCoAは、オキサロ酢酸と共にクエン酸の形で濃縮されて細胞質基質へ輸送され、ATP-クエン酸リアーゼによってアセチルCoAとオキサロ酢酸に分解される。その後の脂肪酸合成は細胞質基質で行われる。
マロニルCoAはアセチルCoAカルボキシラーゼによってアセチルCoAから合成される。アセチルCoAおよびマロニルCoAはまずアシルキャリアータンパク質 (acyl career protein; ACP) と結合して活性化される。したがって、実際の脂肪酸合成反応はアセチルACPおよびマロニルACPが担う。
- アセチルCoA(C2) + CO2 + ATP → マロニルCoA(C3) + ADP + Pi
- アセチルCoA + ACP → アセチルACP(C2) + SH-CoA
- マロニルCoA + ACP → マロニルACP(C3) + SH-CoA
炭素鎖の伸長(パルミチン酸の合成)
飽和脂肪酸の伸長反応は4つの段階に分かれ、アセチルACP(炭素数2)を出発物質としてマロニルACP(炭素数3)が逐次縮合(クライゼン縮合)していく循環回路を構成する。縮合にあたって1分子のCO2が放出されるため、1サイクル(下の4つの反応)ごとに炭素数は2個ずつ増加していく。
| 段階 | 記述 | 図 | 酵素 |
|---|---|---|---|
| 縮合反応 | 最初のステップはアセチルACPとマロニルACPの縮合反応である。この結果アセトアセチルACPが生成する。この反応は熱力学的に不利であるが、二酸化炭素の放出によって反応が進行される。 |

|
β-ケトアシル-ACPシンターゼ |
| アセトアセチルACPの還元 | このステップでは、アセトアセチルACPがNADPHによってD-3-ヒドロキシブチリルACPに還元される。二重結合はヒドロキシル基に還元され、D体のみが生成する。 |

|
β-ケトアシルACPレダクターゼ |
| 脱水 | この段階ではD-3-ヒドロキシブチリルACPが脱水され、クロトニルACPとなる。 |

|
3-ヒドロキシアシルACPデヒドラーゼ |
| クロトニルACPの還元 | このステップでは、クロトニルACPがNADPHによって還元され、ブチリルACPが生成する。 |

|
エノイルACPレダクターゼ |
反応式で書くと以下のようになる。
- アセチルACP + マロニルACP → アセトアセチルACP(C4) + CO2 + ACP
- アセトアセチルACP + NADPH → 3-ヒドロキシブチリルACP(C4) + NADP+
- 3-ヒドロキシブチリルACP → クロトニルACP(C4) + H2O
- クロトニルACP + NADPH → ブチリルACP(C4) + NADP+
- ブチリルACP + マロニルACP → カプリルACP(C6) + ACP + CO2
反応5は反応1と同じで、生成したC4ブチリルACPに次のマロニルACPが縮合する。炭素鎖の伸長は炭素数16のパルミトイルACPまで継続する(反応1-4が繰り返される)。パルミトイルACPは、チオエステラーゼによってC16パルミチン酸とACPに加水分解される。アセチルCoAとマロニルCoAを出発物質とする場合、偶数炭素数の脂肪酸しか合成されない。ただし、種によってアセチルCoAやマロニルCoA以外のプライマーを基に脂肪酸を合成することもできる。これにより奇数炭素数の脂肪酸や分岐のある脂肪酸が合成される。
パルミチン酸に至るまでの中間物質について、より一般的には炭素数によらない以下の表記を用いる。
- 3-オキソアシルACP: 伸長サイクルのうち、縮合反応で生じる中間物質(アセトアセチルACPが最小の炭素数)
- 3-ヒドロキシアシルACP: 1番目の還元反応で生じる中間物質(3-ヒドロキシブチリルACP)
- エノイルACP: 脱水反応で生じる中間物質(クロトニルACP)
- アシルACP: 2番目の還元反応で生じる中間物質(ブチリルACP)
脂肪酸合成酵素(FAS)
アセチルCoAおよびマロニルCoAの生成以降の合成経路は脂肪酸合成酵素(FAS)によって触媒される。FASにはI型およびII型の2種類が知られている(FAS IとFAS II)。動物、一部の菌類(酵母など)、そして一部の細菌(マイコバクテリアなど、CMNグループ)がFAS Iをもつ一方、それ以外の生物(大部分の細菌、真核生物および古細菌)はFAS IIをもつ。どちらも電子供与体にはNADPHが利用される。2つのFASは進化的に関連しており、さらにポリケチド合成酵素(polyketide synthase; PKS)とも関連している。上述の反応過程はFAS IおよびFAS IIで共通である。FAS IはFAS IIより効率が下がる分、炭素数16以下の脂肪酸も副産物として一部生成する(C12ラウリン酸やC14ミリスチン酸)。
FAS Iは単一の巨大なタンパク質で、ACPによる活性化、伸長反応、および最後の加水分解に必要な酵素機能をすべてもっている(下リスト参照)。各機能を担当するドメインがタンパク質内に分散しており、基質はドメインの間で順次受け渡される。ATとMTはFAS Iでは同一のドメインが担う(MATドメイン)。また、ACP自身もFAS Iの中に含まれており、FAS Iは合計で7つのドメインからなる(ACP, MAT, KS, KR, DH, ER, TE)。一方、FAS IIはFAS Iの各ドメインが個別の酵素としてあくまで独立しつつ、それらが集合した複合体を形成している。
ACPによる活性化
- アセチルトランスフェラーゼ(AT)
- マロニルトランスフェラーゼ(MT)
伸長反応(番号は上の反応式と対応している)
- 3-ケトアシルシンターゼ(KS)
- 3-ケトアシルレダクターゼ(KR)
- 3-ヒドロキシアシルデヒドラターゼ(DH)
- エノイルレダクターゼ(ER)
加水分解
- チオエステラーゼ(TE)
FAS Iの各ドメインとFAS IIを構成する個々の酵素はそれぞれ相同である。また、進化的に関連するPKSも類似のドメイン構造と反応機構を持っており、さらにI型とII型に分かれる(PKS IとPKS II)。したがって、FASとPKSの進化的起源は一つである。動物のFAS Iは菌類のPKS Iから、また菌類およびCMNグループ細菌のFAS Iは、細菌のFAS IIからそれぞれ別個に進化したと推測されている。
FASの基質特異性は必ずしも高くない。例えば大腸菌(Escherichia coli)のもつFAS IIは、プロピオニルCoAをプライマーとして使用すると奇数炭素数の脂肪酸(C11, C13, C15)を合成することができる。
パルミチン酸以降
パルミチン酸以降は、さらなる伸長反応(例えばC18ステアリン酸合成)や、不飽和脂肪酸の合成に移行する。炭素数16以上の伸長反応は基本的にはFAS IIが行うものと同じである。細胞質基質ではなく、主に小胞体で行われる。一方、C14以下の短鎖・中鎖飽和脂肪酸(偶数炭素数)は、パルミチン酸などの長鎖飽和脂肪酸のβ酸化、もしくは炭水化物の発酵などで生成する。
奇数炭素数の飽和脂肪酸
奇数炭素数の脂肪酸(odd-chain fatty acid; OCFA)は、FASにより偶数炭素数の飽和脂肪酸と同様の機構で合成される。一部の反芻動物や植物に見つかっているが、自然界における分布は少ない。プライマーにアセチルCoA(C2)ではなくプロピオニルCoA(C3)を用いることで、奇数炭素数の飽和脂肪酸が合成される(主にC15ペンタデカン酸とC17ヘプタデカン酸)。プロピオニルCoA自体は、すでにある奇数炭素数の脂肪酸のβ酸化、もしくはいくつかのアミノ酸(メチオニン、バリン、イソロイシン、トレオニン)の分解、コレステロールの分解によって生成する。
その他の飽和脂肪酸の合成
分岐のある飽和脂肪酸
FASによる合成
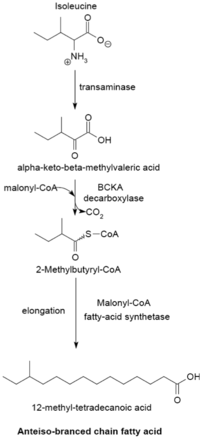
分岐脂肪酸(branched-chain fatty acid)は細菌によって合成され、種によっては合成する脂肪酸の大半を占める(〜98%)。イソプレノイド由来の脂肪酸を除き、直鎖型の飽和脂肪酸と同じ反応機構で合成される。分岐の位置は、イソ型(iso)およびアンテイソ型(anteiso)が大部分を占めるが、それ以外の分岐も存在する(例えばツベルクロステアリン酸)。大きく2つの酵素グループに分かれるが、反応機構はどちらもFASと同じである。1つのグループは、プライマーとしてアミノ酸由来のα-ケト酸が用いられる。すなわち、バリンから2-メチルプロパニルCoA、ロイシンから3-メチルブチリルCoA、イソロイシンから2-メチルブチリルCoAがプライマーとして生成する。α-ケト酸の合成は、アミノ基転移と脱炭酸反応により進行する。それぞれのプライマーから、異なる分岐をもつ飽和脂肪酸が合成される。炭素数は通常12-17個程度で、生成する分岐脂肪酸の組成は個々の細菌に固有な場合が多い。
- バリン -> 2-メチルプロパニルCoA ->
偶数炭素数のイソ型脂肪酸(例えば14-メチルペンタデカン酸)
- ロイシン -> 3-メチルブチリルCoA ->
奇数炭素数のイソ型脂肪酸(13-メチルテトラデカン酸)
- イソロイシン -> 2-メチルブチリルCoA ->
奇数炭素数のアンテイソ型脂肪酸(12-メチルテトラデカン酸)
2つ目のグループでは、プライマーとして分岐のある短鎖脂肪酸を用いる。例えば、3-メチルブタン酸(イソ吉草酸)、2-メチルブタン酸、2-メチルプロパン酸(イソ酪酸)などが用いられる。例えば2-メチルプロパン酸からはイソパルミチン酸が生成する。3-メチルブタン酸はヘミテルペノイドであり、テルペン生合成経路で合成される。
イソプレノイド由来の分岐脂肪酸
一部の分岐脂肪酸はFASによって合成される脂肪酸とは異なる由来をもつ。例えば、C20フィタン酸のアシル基は長鎖イソプレノイドであり、直鎖型脂肪酸とは異なる生合成経路で合成される(テルペン生合成)。そのためイソプレノイド由来のカルボン酸は脂肪酸に含めない場合も多い。フィタン酸は植物がもつクロロフィルが起源である。動物が食物として取り込んだ植物中のクロロフィルは腸内で細菌の発酵により分解されてフィトールを生成し、それがさらにフィタン酸に変換される。フィタン酸はC-3位にメチル基があるためβ酸化による分解ができず、代わりにα酸化により分解される。フィタン酸から1分子の炭素が除去されるとC19プリスタン酸となる。プリスタン酸はβ酸化による分解が可能である。
環状飽和脂肪酸
炭化水素環をもつ脂肪酸は一部の植物や細菌に見られる。シクロプロパン環をもつ脂肪酸は、不飽和脂肪酸中の不飽和結合にメチル基を導入することで合成される(植物、大腸菌など)。一方、嫌気的アンモニア酸化(アナモックス; Anammox)を行うプランクトミケス門の細菌(Brocadiales)は、シクロブタン環が複数縮合したラデラン酸(Ladderaneを参照)と呼ばれる特殊な脂肪酸と、ラデラン酸から構成されるグリセロ脂質をもつ。ラデラン酸の生合成経路は現在も判明していないが、人工的な化学合成方法は知られている。
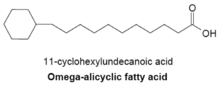
シクロブタン以上の炭素数の環をもつ脂肪酸も知られている。ω-アリシクロ脂肪酸(ω-alicyclic fatty acid)は、炭素数4−7の炭化水素環をω末端にもつ脂肪酸である。多くの場合、シクロヘキサン環(炭素数6)をもちω-シクロへキシル脂肪酸(ω-cyclohexyl fatty acid)と呼ばれる。右図は、直鎖部分の炭素数が11のω-シクロへキシル脂肪酸である。ω-アリシクロ脂肪酸の生合成はFASによる分岐脂肪酸の合成と同じで、プライマーに環状構造をもつ化合物が使用されている。
不飽和脂肪酸の合成
天然に見つかっている不飽和脂肪酸はほとんどが偶数炭素数で直鎖のcis型である。不飽和結合の位置は、脂肪酸のカルボニル基から数えた(Δ)、もしくはメチル基末端から数えた(ω)炭素の個数で表す。また、不飽和結合の個数を総炭素数の後ろにつけて表す。例えば炭素数18の脂肪酸の直鎖中に2重結合を1つもつ場合、18:1と表す(オレイン酸)。
嫌気性合成
多くの細菌は嫌気性の(酸素分子を必要としない)不飽和脂肪酸合成経路をもっている。例えば、大腸菌(Escherichia coli)では、飽和脂肪酸合成の中間物質であるC10飽和脂肪酸(ヒドロキシデカノイルACP)に不飽和結合が導入される。導入後は再び炭素鎖の伸長反応に戻り、C16およびC18の不飽和脂肪酸が合成される(16:1ω7および18:1ω7)。反応はFabAおよびFabBの2つの酵素によって触媒される。嫌気性の合成経路は大部分の細菌に分布しており、好気性の経路より起源が古いと推測される。
好気性合成
シアノバクテリアなど一部の好気性細菌および真核生物は好気性の(酸素分子を必要とする)不飽和脂肪酸合成経路をもっている。不飽和結合の導入はデサチュレーゼと呼ばれる酵素群により触媒され、この酵素反応に酸素が必要となる。炭素鎖のうち不飽和化する部位に応じてそれぞれ異なるデサチュレーゼが存在する。例えば、哺乳類にはΔ9デサチュラーゼ、Δ6デサチュラーゼ、Δ5デサチュラーゼの3種類が存在する。実際には哺乳類では、デサチュレーゼを含む酵素複合体(NADH-シトクロームb5 レダクターゼ、シトクロームb5、およびデサチュレーゼ)が不飽和化反応を進行させる。
一価不飽和脂肪酸
不飽和結合を1つもつ脂肪酸をいう。ヒトの体内では、ステアロイルCoA 9-デサチュラーゼ(Δ9-脂肪酸デサチュラーゼ)によりステアリン酸(18:0)のΔ9位(ω9位でもある)に二重結合が付加されて18:1のオレイン酸となる。オレイン酸はω9位に不飽和結合をもつため、ω-9脂肪酸に分類される。
多価不飽和脂肪酸
哺乳類の場合、対応するデサチュレーゼを持たないためΔ9以降の位置に不飽和結合を導入することができない。さらに2つ以上の不飽和結合を導入することもできない。したがって、リノール酸(18:2(Δ9,12))やα-リノレン酸(18:3(Δ9,12,15))、アラキドン酸(20:4(Δ5,8,11,14))などは食べ物の形で外部から摂取する必要があり、(哺乳類にとって)必須脂肪酸と呼ばれる。一方、植物および細菌は、Δ12-脂肪酸デサチュラーゼ によりオレイン酸のΔ12位(ω6位でもある)に二重結合を形成してリノール酸を合成することができる。さらにΔ15-脂肪酸デサチュラーゼ によりリノール酸のΔ15位(ω3位)に二重結合を形成してα-リノレン酸を生成することもできる。リノール酸はω6位に不飽和結合をもつため、ω-6脂肪酸に分類される。また、α-リノレン酸はω-3脂肪酸に分類される。
ω-6脂肪酸の変換
ヒトを含めた動物の体内では、ω-6脂肪酸であるリノール酸から出発してリノレオイルCoAデサチュラーゼ(Δ6-脂肪酸デサチュラーゼ)によりγ-リノレン酸(18:3)が生成され、さらにアラキドン酸(20:4)へ変換される。さらに、アラキドン酸からプロスタグランジン、n-6ロイコトリエン等のオータコイド類が生成する。
ω-3脂肪酸の変換
ヒトを含めた動物の体内では、Δ6-脂肪酸デサチュラーゼによりα-リノレン酸(18:3)からエイコサテトラエン酸(20:4)を生成し、さらにΔ5-脂肪酸デサチュラーゼによりエイコサペンタエン酸(20:5)を生成する。エイコサペンタエン酸からさらに22:6のドコサヘキサエン酸が生成される。α-リノレン酸のうちこれらの変換に使われる割合は10-15%程度である。
trans型の不飽和脂肪酸(トランス脂肪酸)
トランス脂肪酸は天然にはほとんど存在しない。牛や羊などの反芻動物が少量のトランス脂肪酸をもつが、これは反芻動物の体内にいる細菌の発酵によって生成する。
奇数炭素数の不飽和脂肪酸
天然に見つかっている奇数炭素数の脂肪酸はほとんどが飽和脂肪酸だが、例えばC17ヘプタデセン酸(17:1)やC17ヘプタデカディエン酸(17:2)など不飽和脂肪酸も知られている。これらは反芻動物や、一部の植物から見つかっている。
古細菌の脂肪酸合成
長鎖脂肪酸はバクテリアおよび真核生物では細胞膜の構成物質であるため普遍的に合成されているが、古細菌では細胞膜に脂肪酸を使用せず、長鎖のイソプレノイドを使用している。そのため、大部分の古細菌は長鎖脂肪酸の合成経路を持たない。ただし、ハロアーキアの一部は脂肪酸を合成することが知られている。しかしバクテリア・真核生物のもつ経路とは完全には一致しない。特にアシルキャリアータンパク質が一切存在しないため、反応の出発点となるプライマーの活性化ができない。そのため、ハロアーキアなど脂肪酸を合成することが知られている種では、バクテリア・真核生物とは異なる機構でプライマーの活性化がなされている可能性がある。イソプレノイド合成と脂肪酸合成の間に酵素的な共通点は存在しないが、基質が繰り返し縮合して鎖が伸長するという仕組みは同じである。
無機的な脂肪酸合成
中・長鎖脂肪酸は無機的な反応によっても生成する。そのため生命発生の初期段階において、最初の細胞膜は無機的に合成され蓄積していた脂肪酸からできたのではないかとする説が有力視されている。無機的な脂肪酸合成経路としてよく知られているのはフィッシャー・トロプシュ合成である。ただし、実際の太古の地球環境で同様の化学反応が本当に起きていたのかについて確定的な証拠はなく、推測の域を出ていない。
脚注
関連項目
|
代謝マップ
| ||
|---|---|---|
| ||