遺伝子組み換え作物
遺伝子組み換え作物(いでんしくみかえさくもつ)は、遺伝子組換え技術を用いて遺伝的性質の改変が行われた作物である。
日本語では、いくつかの表記が混在している。遺伝子組換作物反対派は遺伝子組み換え作物、厚生労働省が遺伝子組換え作物、食品衛生法では組換えDNA技術応用作物、農林水産省では遺伝子組換え農産物 を使う。
英語の genetically modified organism からGM作物、GMOとも呼ばれることがある。なお、GMOは通常はトランスジェニック動物なども含む遺伝子組換え生物を指し、作物に限らない。
概要
遺伝子組換え作物は、商業的に栽培されている植物(作物)に遺伝子操作を行い、新たな遺伝子を導入し発現させたり、内在性の遺伝子の発現を促進・抑制したりすることにより、新たな形質が付与された作物である。食用の遺伝子組換え作物では、除草剤耐性、病害虫耐性、貯蔵性増大などの生産者や流通業者にとっての利点を重視した遺伝子組換え作物の開発が先行し、こうして生み出された食品を第一世代遺伝子組換え食品と呼ぶ。これに対し、食物の成分を改変することによって栄養価を高めたり、有害物質を減少させたり、医薬品として利用できたりするなど、消費者にとっての直接的な利益を重視した遺伝子組み換え作物の開発も近年活発となり、こうして生み出された食品を第二世代組み換え食品という。
遺伝子組換え作物の作製には、開発過程の高効率化や安全性に関する懸念の払拭のためにさまざまな手法が取り入れられている。たとえば、遺伝子の組み換わった細胞(形質転換細胞)だけを選択するプロセスにおいて、かつては医療用、畜産用としても用いられる抗生物質と選択マーカー遺伝子としてその抗生物質耐性遺伝子が用いられていた。現在ではそのような抗生物質耐性遺伝子が遺伝子組換え作物に残っていることが規制される場合もあり、それ以外の選択マーカー遺伝子を利用したり、選択マーカー遺伝子を除去したりといった技術が開発された。
遺伝子組換え作物の栽培国と作付面積は年々増加している。2015年時点、全世界の大豆(ダイズ)作付け面積の83%、トウモロコシの29%、ワタの75%、カノーラの24%がGM作物である(ISAAA調査)。遺伝子組換え作物が商業的に本格的に栽培された1996年から2014年までは年々栽培面積が増えてきたが2015年になって初めて前年に比べ栽培面積が1%減少した。
2020年10月、アルゼンチンは世界で初めて遺伝子組換え小麦を承認した。ヒマワリ由来で、すでに大豆への組み込み実績がある遺伝子HB4により、旱魃でも従来品種より平均20%多収である。アルゼンチンとフランスの企業が開発した。
日本については、限定的ではあるが、青いバラ (サントリーフラワーズ)の商業栽培により2009年には遺伝子組換え作物の商業栽培国となった。
日本の輸入穀類の半量以上は既に遺伝子組換え作物であるという推定もある。
遺伝子組換え作物の開発・利用について、賛成派と反対派の間に激しい論争がある。主な論点は、生態系などへの影響、経済問題、倫理面、食品としての安全性などである。生態系などへの影響、経済問題に関しては、単一の作物や品種を大規模に栽培すること(モノカルチャー)に伴う諸問題を遺伝子組み換え作物特有の問題と混同して議論されることが多い。食品としての安全性に関して、特定の遺伝子組換え作物ではなく遺伝子組み換え操作自体が食品としての安全性を損なっているという主張がある。そのような主張の論拠となっている研究に対し、実験設計の不備やデータ解釈上の誤りを多数指摘したうえで科学的根拠が充分に伴っていないとする反論もある。
日本では、厚生労働省および内閣府食品安全委員会によって、ジャガイモ、ダイズ、テンサイ、トウモロコシ、ナタネ、ワタ、アルファルファおよびパパイアの8作物318種類について、2018年(平成30年)2月23日時点、食品の安全性が確認されている。
起源
従来の育種学の延長で導入された、1973年以降の遺伝子組換えの手法としては、放射線照射、重イオン粒子線照射、変異原性薬品などの処理で、胚の染色体に変異を導入した母本を多数作成し、そこから有用な形質を持つ個体を選抜する作業を重ねるという手順で行われた。
最初のGMOが作成されたあとに、科学者は自発的なモラトリアムを、組換えDNA実験に求めて観測した。モラトリアムの一つの目標は、新技術の状態、および危険性を評価するアシロマ会議のための時間を提供することだった。生化学者の参入と新たなバイオテクノロジーの開発、遺伝子地図の作成などにより、作物となる植物に対して、「目的とする」形質をコードする遺伝子を導入したり、「問題がある」形質の遺伝子をノックアウトしたりすることができるようになった。
アメリカ合衆国では、研究の進展とともに厳しいガイドラインが設けられた。そのようなガイドラインは、のちにアメリカ国立衛生研究所や他国でも相当する機関により公表された。これらのガイドラインは、GMOが今日まで規制される基礎を成している。
初めて市場に登場した遺伝子組換え作物と言われるのは、アンチセンスRNA法(mRNAと相補的なRNAを作らせることで、標的となるタンパク質の生合成を抑える手法でRNAi法の一種)を用いて、ペクチンを分解する酵素ポリガラクツロナーゼの産生を抑制したトマト "Flavr Savr" である。ほかのトマトと比較して、熟しても果皮や果肉が柔らかくなりにくいという特徴を持つ。
分類
遺伝子組換え「植物」として開発されているものは、植物自体の研究に用いられるモデル植物として利用されているものと、産業的に利用されている、もしくは産業的利用を目指して研究されている遺伝子組換え「作物」に分けることができる。さらに、遺伝子組換え作物は、非食用作物、食用作物(遺伝子組換え食品)、飼料用作物などに分類可能である。なお、食用作物と飼料用作物との境界は明確ではないため、食用作物と飼料用作物の双方を遺伝子組換え食品の範疇に含めて説明する。また、食用作物と飼料用作物はエタノール生産や燃料用油生産に利用されることもある。
非食用遺伝子組換え作物
非食用の遺伝子組換え作物としては、園芸作物と林木が主である。園芸作物としては花卉が主体である。たとえば、青い花色のカーネーション「ムーンダスト」は、一般の消費者に花屋で売られている遺伝子組換え作物である。また、2009年11月に国内で市販が開始された青いバラも遺伝子組換え作物である。そのほか、菊のカロテノイド含量を変化させたり、トレニアのアントシアニン生合成系をオーロン生合成系へ変化させて黄色いトレニアの花を作ったりする試みがある。林木の例としては製紙用にリグニンの構造や含量を改変されたポプラやヤマナラシ、ユーカリ、テーダマツ、ラジアータマツが多く、セルロース含量を高めたギンドロなどもある。
なお、食用作物と飼料用作物がエタノール生産や燃料用油生産に利用されることもあるが、バイオエタノールやバイオディーゼル用にスイッチグラスやナンヨウアブラギリなどの非食用植物を分子育種する研究も進んでいる。たとえば、スプラウトとして食用とされることもあるアルファルファにおいては、反芻動物の飼料用としてタンニン含量を増加させたものが開発されているとともに、リグニン生合成を抑制してリグニン含量を低下させたものが上市されている。
遺伝子組換え食品の分類
遺伝子組換え食品の分類としてはさまざまなものがあるが、一例として以下のように分類されることがある。本項目においては、この分類に従って解説する。なお、第三世代に関してはまだ明確ではない。
- 第一世代
- 除草剤耐性、病害虫耐性、貯蔵性増大など
- 第二世代
- 成分改変食品で消費者の利益が強調されたもの。
- 第三世代
- 過酷な環境でも成育できたり、収量が高かったりするような作物か?
日本において第一種使用(食用または飼料用に供するための使用、栽培、加工、保管、運搬および廃棄ならびにこれらに付随する行為)を認められている組換え品種には、たとえば、選択マーカー遺伝子以外に1品種に6種類の害虫抵抗性と2種類の除草剤耐性の計8種類の外来遺伝子が導入されたものや、1品種に7種類の害虫抵抗性と3種類の除草剤耐性の計10種類の外来遺伝子が導入されたもの、除草剤耐性と改変された脂肪酸残基組成の貯蔵脂質の双方を持つという、世代をまたいでいるといえるものもある。このように、異なった形質を持つ組換え品種をかけ合わせて、複数の形質 (stacked traits) を導入された組換え品種をスタック(ド)品種 (stacked GM line (variety, cultivar)) ということがある。
なお、前述の通り、まだ第三世代については確たる定説がないため、ストレス耐性作物に関しては「第一世代組換え食品の開発状況」において説明する。
第一世代組換え食品の開発状況
概説
第一世代組換え食品は、作物に除草剤耐性、病害虫耐性、貯蔵性増大などの形質が導入されたものである。これらの特質は、生産者や流通業者にとっての利点となるだけでなく、安価で安全な食品の安定供給につながるという点で消費者にとっても大きなメリットとなる。また、農薬使用量の減少や不耕起栽培の利用可能性などにより環境面での負荷の減少を図れることや、収穫量が多かったり、損耗が少なかったりという性質を持つことは持続的農業を進めていく上でも有用である。
以下に、除草剤耐性作物、害虫抵抗性作物、耐病性作物、保存性を増大させた作物、雄性不稔形質の付与と雄性不稔からの稔性の回復、耐熱性α-アミラーゼ生産トウモロコシ、乾燥耐性トウモロコシなどに関して、それぞれの種類と原理について説明する。
除草剤耐性作物
概説
第一世代組換え作物としては、ラウンドアップやビアラホス (bialaphos) など特定の除草剤に耐性を持つ品種を作成し、その除草剤による雑草防除を利用するような作物も開発されている。これは農作業の効率化だけではなく、土壌流出による環境破壊を防ぐ不耕起栽培を適用できる。ダイズの主要生産地である南北アメリカ諸国では表土流出が大問題となっている。前作の植物残渣を放置できるため、植物残渣がマルチ(マルチング)となって風雨から土壌流出を防ぎ、土壌を耕すことによって土壌が流亡しやすくなることを不耕起栽培によって防ぐことができる。そのほか、有毒雑草の収穫物への混入を減らせるとの主張もある。
単一の除草剤と除草剤耐性作物の組み合わせで長年栽培を続けると、その除草剤に対する耐性雑草が出現する。この現象自体は一般的なものであり、すでに除草剤ラウンドアップに対する耐性雑草の出現が報告されている。このような事態を避けるための方策として、複数の除草剤に対して耐性を持つ作物と複数の除草剤の混用、異なる除草剤とその除草剤耐性作物の複数の組み合わせを用いた定期的な輪作などが推奨されている。
除草剤を含めた薬剤に対する耐性化機構として次のものが挙げられる。
- 薬剤とその標的との親和性の低下
- 標的の過剰発現
- 薬剤の分解・修飾による無毒化
- 薬剤の移行・吸収の阻害
- 薬剤が阻害しない別経路の誘導
- もともとは活性を持たない薬剤を活性を有する物質に変換する経路の抑制
除草剤に対しても、これらの機構を単独もしくは複数組み合わせて植物を耐性化している。
以下に除草剤の種類ごとの耐性作物について説明する。
ラウンドアップ耐性作物
ビアラホス耐性作物
ビアラホス (bialaphos)は放線菌 Streptomyces hygroscopicus, S. viridochromogenes などが生産する抗生物質であり、窒素代謝においてアンモニウムイオンの同化に関与するグルタミン合成酵素の阻害剤として作用する。グルタミン合成酵素が阻害されると毒性の高いアンモニウムイオンが植物体内に蓄積して、植物体を枯死させると考えられている。
ビアラホス生産菌は、ビアラホスが自身のグルタミン合成酵素を阻害する事態に対処するため、ビアラホスを無毒化する酵素ホスフィノスリシン N-アセチル基転移酵素の遺伝子 bar を持っている。そこで bar を植物内で発現できるように改変して導入することでビアラホス耐性作物を開発した(薬剤の分解・修飾による無毒化)。
ブロモキシニル耐性作物
ブロモキシニルやアイオキシニルはオキシニル (oxynil) 系除草剤であり、光合成系の電子伝達系を阻害することで除草活性を示す。肺炎桿菌クレブシエラ・ニューモニエKlebsiella pneumoniae subsp. ozaenae由来のブロモキシニル・ニトリラーゼは、ブロモキシニルを3,5-ジブロモ 4-ヒドロキシ安息香酸 (3,5-dibromo 4-hydroxybenzoate) とアンモニアに、アイオキシニルを3,5-ジヨード 4-ヒドロキシ安息香酸 (3,5-diiodo 4-hydroxybenzoate) とアンモニアに加水分解できる。そこで、このニトリラーゼの遺伝子oxyを植物に導入してブロモキシニル耐性にしている(薬剤の分解・修飾による無毒化)。バイエルクロップサイエンス株式会社の西洋ナタネ・カノーラ OXY-23については、「除草剤ブロモキシニル耐性セイヨウナタネ (oxy, Brassica napus L.) (OXY-235, OECD UI: ACS-BNØ11-5) の生物多様性影響評価書の概要」などで公表されている。
スルホニルウレア系除草剤耐性作物
スルホニルウレア (sulfonylurea) 系除草剤(SU剤)には多数の薬剤が登録されている。SU剤は後述の「ALS遺伝子の特異的置換」の小節で述べているbispyribacと同様にALS/AHASの阻害剤で分岐鎖アミノ酸の生合成系を阻害する。ALS/AHASのSU剤に対する感受性の低下した耐性変異が知られており、耐性型のALS遺伝子を導入して発現させることによりSU剤耐性作物が分子育種されている(薬剤とその標的との親和性の低下による耐性化)。そのほか、ヒトの肝臓で発現しているシトクロムP450 (cytochrome P450) の分子種のうち、CYP2C9やCYP2C19をイネで発現させてSU剤であるクロルスルフロンとイマゾスルフロン (imazosulfuron) に対してそれぞれ耐性化させた例もある。ヒトの肝臓でクロルスルフロンがCYP2C9によって、イマゾスルフロンがCYP2C19によってそれぞれ水酸化されて代謝されるという知見から応用されたものである(薬剤の分解・修飾による無毒化)。
イミダゾリノン系除草剤耐性作物
イミダゾリノン (imidazolinone) 系除草剤はスルホニルウレア系除草剤と同様にALSを阻害する。そこで、イミダゾリノン系除草剤に対して感受性の低下したALSの遺伝子を導入して耐性作物を育種した(薬剤とその標的との親和性の低下による耐性化)。その例として、BASFアグロ株式会社のイミダゾリノン系除草剤耐性ダイズがあり、「イミダゾリノン系除草剤耐性ダイズ(改変csr1-2, Glycine max (L.) Merr.)(CV127, OECD UI: BPS-CV127-9) 申請書等の概要」などで公表されている。
2,4-D耐性作物
2,4-Dは植物ホルモン・オーキシン様の生理活性を示し、高濃度では植物を枯死させる作用を持つ。2,4-Dを2,4-ジクロロフェノールへ変換する酵素2,4-D モノオキシゲナーゼ(タンパク質名: TfdA)を利用して2,4-D耐性のタバコやワタなどの作物が作られた(薬剤の分解・修飾による無毒化)。TfdAはグラム陰性細菌Alcaligenes eutrophusのプラスミドpJP5上の遺伝子tfdA由来のものである。なお、グラム陰性桿菌Sphingobium herbicidovoransの同様の酵素の遺伝子aad-1が改変されて導入された2,4-D耐性トウモロコシは、ダウ・ケミカルにより開発されている。複数の系統が開発されており、「アリルオキシアルカノエート系除草剤耐性トウモロコシ(改変aad-1, Zea mays subsp. mays (L.)Iltis.)(DAS40278, OECD UI:DAS-4Ø278-9) 申請書等の概要」などで公表されている。また、グラム陰性桿菌デルフチア・アシドボランス由来の同様の酵素遺伝子aad-12の改変型によっても2,4-D耐性ダイズやワタが開発されている。
ジカンバ耐性作物
ジカンバ(dicamba: 3,6-dichloro-2-methoxybenzoic acid, 3,6-ジクロロ-2-メトキシ安息香酸, CAS No. 1918-00-9)は、2,4-Dと同様にオーキシン様の生理活性を示す除草剤である。ジカンバを3,6-ジクロロサリチル酸 (3,6-dichlorosalicylic acid) へ変換する酵素ジカンバ モノオキシゲナーゼ(DMO)を利用してジカンバ耐性のダイズが作られた(薬剤の分解・修飾による無毒化)。グラム陰性細菌Stenotrophomonas maltophilia DI-6株由来の改変dmo遺伝子が利用され、ダイズに導入されている。改変DMOのアミノ末端側にはプラスチドへの移行ペプチド (transit peptide) が融合されている。ジカンバ耐性ダイズに関しては、「除草剤ジカンバ耐性ダイズ(改変dmo, Glycine max (L.) Merr.)(MON87708, OECD UI : MON-877Ø8-9) 申請書等の概要」などで公表されている。
イソキサフルトール耐性作物
4-ヒドロキシフェニルピルビン酸ジオキシゲナーゼ(HPPD)は、4-ヒドロキシフェニルピルビン酸をホモゲンチジン酸に変換する反応を触媒する。ホモゲンチジン酸はいくつかの段階を経て、光合成やカロテノイド生合成に重要なプラストキノン、トコフェロール類の前駆体である2-メチル-6-フィトキノールへ変換される。
イソキサゾール系除草剤であるイソキサフルトール (isoxaflutole: 5-cyclopropyl-4- (2-methylsulfonyl-4-trifluoromethylbenzoyl) isoxazole, CAS No. 141112-29-0) は、その代謝産物2-シアノ-3-シクロプロピル-1-(2-メチルスルホニル-4-トリフルオロメチルフェニル)プロパン-1,3-ジオン(DKN)がHPPDの基質である4-ヒドロキシフェニルピルビン酸と競合してHPPD活性を阻害することにより除草活性を示す。
植物にイソキサフルトール耐性を付与するために、シュードモナス属細菌Pseudomonas protegens Pf-5株のhppd遺伝子から1塩基置換されたものが用いられている。この遺伝子は、1塩基置換によるミスセンス変異によって本来のアミノ酸配列 (GenBank:AAY92656.1) から1アミノ酸置換されたHPPDをコードしている。この変異型HPPDはDKNによって阻害されにくいためホモゲンチジン酸が合成される(薬剤とその標的との親和性の低下による耐性化)。なお、植物のHPPDはプラスチドに局在しているが、バクテリアであるP. protegenes由来の変異型HPPDはそのままではプラスチドへ移行できない。そこで、変異型HPPDのアミノ末端側にはプラスチドへ移行できるように移行ペプチドが融合されている。なお、P. protegenes Pf-5株はかつてP. fluorescensに分類されていたため、P. fluorescens Pf-5株と記載されている場合がある。バイエルクロップサイエンス社のイソキサフルトール耐性ダイズに関しては、「除草剤グリホサート及びイソキサフルトール耐性ダイズ(2mepsps, 改変hppd, Glycine max (L.) Merr.)(FG72,OECD UI: MST-FG072-3) 申請書等の概要」などで公表されている。
メソトリオン耐性作物
メソトリオンは、トリケトン系除草剤である。メソトリオンも上記のイソキサフルトールと同様にHPPDの阻害剤である。そこで、エンバク (Avena sativa) 由来のメソトリオンに感受性の低下した変異型のhppd遺伝子の導入により、メソトリオン耐性ダイズが育種された(薬剤とその標的との親和性の低下による耐性化)。シンジェンタ社のメソトリオン耐性ダイズに関しては、「除草剤メソトリオン耐性ダイズ(改変avhppd, Glycine max (L.) Merr.)(SYHT04R, OECD UI: SYN-∅∅∅4R-8) 申請書等の概要」などで公表されている。
害虫抵抗性作物
概説
害虫に対して毒性を有するタンパク質や害虫の天敵を誘引する物質を生産させることで、害虫の発生を抑える害虫耐性のものも存在する。その機構としては、
- グラム陽性桿菌Bacillus thuringiensisの結晶性タンパク質の遺伝子導入
- マメ科植物由来のトリプシン阻害剤(タンパク質)の遺伝子導入(摂食したタンパク質を消化・吸収しにくくなる)
- インゲン豆由来のα-アミラーゼ阻害剤(タンパク質)の遺伝子導入(摂食したデンプンを消化・吸収しにくくなる)
- 昆虫の外骨格の成分であるキチン (chitin) を分解するキチナーゼ(chitinase, EC 3.2.1.14, 反応)の遺伝子導入
- 殺虫性の線虫(ネマトーダ)の誘因物質の合成遺伝子の導入
が挙げられるが、特にBacillus thuringiensisの結晶性タンパク質 (Bt toxin) 遺伝子導入による害虫抵抗性作物が成功している。
Bt toxin生産作物
概説
Bt toxinのBは属名Bacillusの頭文字に、tは種小名thuringiensisの頭文字に由来する。B. thuringiensisの性質として、
- 土壌細菌で芽胞を形成するときに結晶性タンパク質(δ-内毒素: δ-endotoxin, Bt toxin)を蓄積する。
- 結晶性タンパク質が昆虫の腸に達すると部分消化され、殺虫性毒素ペプチドが遊離する。
- 哺乳類には殺虫性毒素ペプチドと結合する特異的な受容体がないため、毒性を発揮できない。
- 菌株によって生産する結晶性タンパク質が作用する昆虫の種類が異なる。
というものがある。Bt toxinは哺乳類には毒性を持たないため、Bt toxinを生産する植物を人間が食べても害はない。そこでBt toxinを生産する害虫耐性組換え作物の開発につながった。日本においては市民団体などによって人体への害が喧伝されているが、現時点において人体への有害性は確認されていない。Bt toxinをそのまま植物に生産される場合もあるが、多くの場合、部分消化の際に取り除かれる配列を除去して、殺虫性毒素ペプチドを含む部分を主体とした、もっと小型のタンパク質として植物に生産させている。生産株の違いによりBt toxinにはさまざまな種類がある。その種類により、殺虫スペクトルが異なってくる。そのため、作物に導入されたBt toxin遺伝子の種類により、殺虫活性を示す昆虫が異なる。
Bt生産作物の導入により、
- 殺虫剤使用量の大幅削減
- 組織内へ侵入済みの害虫にも作用
- 害虫以外への殺虫剤による影響の大幅低下
- 虫害による傷口からの糸状菌感染症が著しく低下し、また収量増加の効用。
- その結果としてカビ毒 (mycotoxin) の含量(フモニシン: fumonisin、アフラトキシン: aflatoxinなどの総量)の低下(「害虫抵抗性トウモロコシにおけるカビ毒含有量の低下」の小節参照)
- Bt生産作物の殺虫対象害虫の減少に伴う、同じ害虫による他の作物の被害の減少
という結果が得られている。
その他の重要な利点は、ある種の作物の連作を可能にするということである。米国中西部におけるトウモロコシ栽培の例が挙げられる。トウモロコシは肥料をコントロールすれば連作障害の出にくい作物である。しかし、かつては米国中西部のコーンベルトにおいて連作できなかった。その原因は、ウェスタンコーンルートワーム (western corn rootworm: Diabrotica virgifera virgifera LeConte) などの数種類のネクイハムシによる被害であった。これらのネクイハムシの成虫はトウモロコシ畑で羽化し、地中に産卵する。そして、翌春、播種されたトウモロコシの種子が発芽するころに孵化する。幼虫は生育初期の幼根を加害するためトウモロコシの被害は大きかった。これらのネクイハムシの幼虫はトウモロコシの幼根がないと成育できないため、生産者はトウモロコシ栽培のあとに別の作物を輪作して虫害を防除してきた。ところが、ほかの作物が栽培されている間は孵化せず、トウモロコシが播種されると孵化するネクイハムシの系統が各地で出現したため、輪作も無効になりつつあった。そのような状況下に、根においてBt toxinを生産する組換えトウモロコシ品種が上市され、連作可能となった。
Btスイートコーン品種
トウモロコシの栽培面積は、圧倒的にデントコーン品種が多くを占めているため、トウモロコシの組換え品種の大部分はデントコーンのものである。組換えスイートコーン品種は遺伝子組換えトウモロコシ品種開発の初期から少数ではあるが存在していたが、近年、相次いで複数の組換えスイートコーン品種が上市されている。スイートコーンは、茹でトウモロコシや焼きトウモロコシや缶詰として利用されるため、害虫の食害痕があると大きく商品価値を下げる。そのため、加工されることが多いデントコーンの場合、収量が重要であるが、スイートコーンの場合、収量よりも食害痕がなく商品となるかどうかの商品化率の方が大きな意味を持ち、栽培には殺虫剤が重要な役割を果たしている。アメリカにおいてスイートコーンの主要害虫はアメリカタバコガ (Heliocoverpa zea) である。そこで、アメリカタバコガに抵抗性を持つBtスイートコーンとその母本の大規模な栽培試験が行われ、その商品化率が調べられた。その結果、Btスイートコーン品種の商品化率は安定的に高かったが、一方、その母本の商品化率はBt品種に比べ低くその値の変動幅も大きかった。そこで、Btスイートコーン品種の栽培は殺虫剤の使用を大幅に減少させるとともに、大量の殺虫剤使用に伴う職業上や環境上の危険を減少させることになろうと結論づけている。
Bt toxin生産作物の改善すべき点と益虫の増加
作物の主要害虫に対する殺虫活性を持つBt toxinの遺伝子が選択されて導入されている。その結果、主要害虫の被害は低減するため、殺虫剤の散布が減少する。その結果、Bt toxin自体の殺虫スペクトルが狭いため、副次的な害虫が主要害虫に作用するBt toxinに非感受性であれば、増加して主要害虫に代わって新たな被害を与えることがある。また、主要害虫が複数あって、それぞれ別のBt toxin感受性の場合も同様である。そのほか、ある作物の主要害虫を減少させることができたために、農薬散布量が減って副次的な害虫が増加してその作物だけでなく他の作物に被害を与えることがある。これは前述の同じ主要害虫の減少による他の作物に対する被害の減少とは逆に副次的な害虫による他の作物に対する被害の増大である。その例として、中国においてBtワタの導入によって殺虫剤散布が減った結果、殺虫対象外のカスミカメムシ類が増え、ワタ以外の果樹園にも被害をもたらしていることが報告されている。そのための対策として、
- 新たな害虫に作用する別のBt toxinの遺伝子も導入する。
- 広範囲の害虫にも作用するBt toxinの遺伝子を導入する。
- 別の原理の抵抗性遺伝子を導入する。
ことが考えられる。そのため、広範囲の害虫に抵抗性を持たせるためには複数の異なる殺虫スペクトルのBt toxin遺伝子を導入された作物が開発されている。
一方、上記とは逆にBt toxin生産作物の栽培により害虫を食べる益虫が増加し、周辺の非組換え作物にも天敵による害虫コントロールが及ぶ利点を示唆する報告も存在する[23]。Bt toxin生産作物が害虫と益虫の両者とも殺す殺虫剤処理を必要としないため、Btワタはオオタバコガ (Helicoverpa armigera) などによる被害を予防するだけでなく、この害虫を食べる益虫の数を増やすことを発見した。
なお、ほかの殺虫剤と同様にBt toxin抵抗性害虫の発生も報告されている。そこで、Bt toxin 耐性害虫の出現管理対策として、
- Bt toxinを高濃度に生産する系統を用いる。
- Bt toxin抵抗性害虫はある遺伝子座の劣性ホモ接合で出現するため、感受性個体の供給源として、周辺に非Bt品種を栽培する(緩衝帯の設置)。
- 定期的に害虫を採集して、抵抗性の発達程度をモニタリングする。
ことが推奨されている。
Bt toxin生産作物の自家採種と抵抗性害虫の出現
Bt toxin生産作物で害虫の抵抗性発達を抑える対策の基本は、上記のように高濃度のBt toxinを生産する品種を用い、非Bt toxin生産作物を緩衝区として栽培することであり、さらに複数のBt toxinを生産する品種を用いることも有効とされている。高濃度Bt toxin生産作物においては害虫を幼虫段階で死亡させ、次世代に生き残る個体を大幅に減らせる。しかし、不正増殖種子や自家採種によるBt toxin濃度が不十分な作物の栽培面積が広がるとBt toxin抵抗性害虫の出現を助長することになり、不正増殖種子や組換え作物種子の自家採種が重大な問題となってくる。そのため、栽培農家による正規の種子の購入と害虫出現のモニタリングは重要である。
天敵誘引物質生産作物
殺虫性の線虫の誘因剤の合成酵素遺伝子の導入による害虫防除の例が報告された。植物食の昆虫による食害が起きると、天敵を誘引する揮発性物質を植物は放出することがある。そこで、作物の害虫防除を改良するうえで、これらの揮発性物質の利用が提案されてきた。トウモロコシの重大な害虫であるウェスタンコーンルートワーム (D. virgifera virgifera) の食害は、多くのトウモロコシ品種の根から(E)-β-カリオフィレン ((E)-β-caryophyllene: EβC) を放出させる。EβCは殺虫性の線虫 (Heterorhabditis megidis) を誘引する。そして、殺虫性の線虫は根を食害する害虫に感染して殺す。しかし、大部分の北米のトウモロコシ品種はEβCの放出能を失っており、そのため線虫による防除をほとんど受けられない。それらのトウモロコシ品種のEβC生産能を回復させるために、オレガノ由来のEβC合成酵素((E)-β-caryophyllene synthase, EC 4.2.3.57, 反応)遺伝子を導入されたトウモロコシは、恒常的にEβCを放出できるようになった。その結果、ウェスタンコーンルートワームが発生している圃場に線虫を散布した試験では、EβC放出トウモロコシでは有意に根に対する被害が減少し、非形質転換の非放出系のトウモロコシに比べ60%少ない成虫しか羽化できなかった。
耐病性作物
概説
第一世代組換え作物として耐病性を有するものも作られている。病害抵抗性遺伝子や糸状菌の細胞壁成分であるキチンを加水分解するキチナーゼの遺伝子の導入(多数あるうちの一例)によるものであるが、その中でも植物ウイルス耐性のものが特に成功している。そのほか、糸状菌や細菌性の植物病原菌に耐性を与えるためにディフェンシンなどの抗菌ペプチドなどを作物で生産させる試みも進んでいる。
ウイルス抵抗性作物
ジャガイモやイチゴなどの栄養繁殖性作物や果樹などの永年性作物において植物ウイルスによる被害は大きく、それらに植物ウイルス抵抗性を付与することは農業上重要である。ただし、ウイルス抵抗性作物は特定のウイルスに対してのみ抵抗性であり、ウイルス一般に対して抵抗性を持つわけではない。ウイルス抵抗性作物は特定のウイルスに抵抗性であり、その特定のウイルスを媒介する害虫を防除する必要がなくなるため、その害虫への殺虫剤散布は不要となる。しかし、野菜や果物は外見や味のわずかな劣化でも商品価値に大きく影響するため、ほかの病害虫防除のために農薬散布は必要である。そのため、その特定のウイルス以外の被害が大きい地域では、生産者はウイルス抵抗性品種を採用する必要性を感じないと考えられる。
特にウイルス抵抗性作物の成功例としては、papaya ringspot virus(PRSV, パパイヤ・リングスポット・ウイルス)によってほぼ壊滅したハワイのパパイヤ栽培が遺伝子組換えパパイヤ品種(Rainbow:レインボー)によって復活できた事例が挙げられる。これについては後述する。なお、2011年2月以降に報道された、沖縄におけるレインボーとは異なる未承認遺伝子組換えパパイヤが栽培されていた事例についても記す。植物ウイルス耐性を与える手法としてはさまざまな機構が用いられているが、その手法は少なくとも4種類挙げられる。
- decoatingの阻害
- 植物ウイルスが植物細胞内に侵入してゲノムを複製させたり、ゲノムにコードされているタンパク質を生産させたりするためには外皮タンパク質 (coat protein) を脱ぐこと(decoating、脱殻)が必要である。もし、侵入した細胞内で外皮タンパク質が大量に存在している場合、decoating してもウイルスのゲノムがすぐに外皮タンパク質に覆われて (recoating)、植物ウイルスのゲノムはゲノムの複製やタンパク質の翻訳に必要な酵素やリボソームと接触できず、ゲノムの複製や翻訳が阻害される。そこで植物細胞に植物ウイルスの外皮タンパク質の遺伝子を導入し、細胞中で外皮タンパク質を大量に生産させてdecoatingを阻害する手法が用いられている。
- PTGS (post-transcriptional gene silencing) という機構の利用
- 多くの植物ウイルスのゲノムはRNAであり、その生活環の中で二本鎖RNAの形成が生じる。そのウイルスのRNAと相同性や相補性のあるRNAが発現されるように改変された形質転換植物は、対応するウイルスに対して、PTGSと同様の機構により、dicerやsiRNA (short interfering RNA) やRISC (RNA-induced silencing complex)などを通じてウイルスの二本鎖RNAの分解が行えるようになり、植物ウイルスに抵抗性になる。これはRNAiの一例といえる。
- 植物ウイルスのゲノムの複製に必要なreplicaseの変異型遺伝子の導入による耐性化の利用
- 植物由来のウイルス抵抗性遺伝子 (R gene) の導入および発現強化
レインボー・パパイヤ
ハワイのパパイヤ・リングスポット・ウイルス(PRSV)抵抗性のパパイヤはレインボー・パパイヤとしてすでにアメリカやカナダや日本などで市販されている。東南アジアにおいてもPRSVの別の株に耐性を示すパパイヤが開発されている。レインボー・パパイヤに関しては、「パパイヤリングスポットウイルス抵抗性パパイヤ(改変PRSV CP, uidA, nptII, Carica papaya L.)(55-1, OECD UI: CUH-CP551-8) 申請書等の概要」で公表されている。外皮タンパク質を大量にパパイヤ中で生産させることによってPRSV抵抗性が現れることが期待されたが、実際にはRNAiによってPRSV抵抗性が現れた。赤肉種のパパイヤ・サンセット (Sunset) に外皮タンパク質遺伝子が導入され、その自殖後代で外皮タンパク質の遺伝子をホモ接合で持つ赤肉種のPRSV抵抗性のサンアップ (SunUp) が選択された。サンアップと非形質転換体でPRSV感受性の黄肉種のカポホ (Kapoho) を交雑させたF1品種がレインボーである。レインボー・パパイヤの一種使用が日本でも2011年(平成23年)8月31日に認可され、同年12月1日より市販された。これは、未加工の生の遺伝子組換え植物体をそのまま食用とする日本における初めての例となった。レインボー・パパイヤの果実中の種子からは、メンデルの法則に基づきウイルス抵抗性と感受性の苗が3:1で得られる。ただし、レインボー・パパイヤはF1品種であるため、発芽した苗はF2世代であり、さまざまな形質を持つ雑多な集団になる。
沖縄における未承認のウイルス抵抗性遺伝子組換えパパイヤ栽培・市販事例
レインボーとは異なる未承認のウイルス抵抗性遺伝子組換えパパイヤが沖縄において市販および栽培されていたことが、2011年2月と4月に公表された。それらによると、市販・栽培されていたものは台湾で開発されたPRSV抵抗性の品種であり、台農5号として販売されていた。台農5号は本来、遺伝子組換え体ではない通常の品種として、交雑育種により1987年に開発されたものである。それにレインボーと同じ機構によるウイルス抵抗性が台湾で導入されたものが、台湾の種苗会社から輸入された種子に混入していたことが未承認の組換えパパイヤの栽培・市販事例の原因と考えられている。この組換え品種はカルタヘナ法に基づく承認を受けていないため、カルタヘナ法と食品衛生法に基づいて市販や栽培は規制され、販売されていた種苗や果実は回収・破棄され、台農5号の疑いのある植物体は抜き取りや伐採された。厚生労働省によると、この遺伝子組換えパパイヤの摂食による危害につながるような情報は今のところ確認されていない。更に、環境省と農林水産省の共同見解ではこの未承認の遺伝子組換えパパイヤによる生物多様性への影響は低いとされている。
ウイルス抵抗性品種のほかの病害虫被害
ウイルス抵抗性品種はウイルスによる被害は少なくなるが、害虫による食害や害虫によって媒介される細菌性の病害を受けやすくなるという報告がある。これはカボチャの仲間であるスクアッシュ (squash) をウイルス耐性にするとウイルスが広がった場合、当然のことながらウイルス抵抗性品種の方が生産性が高いが、害虫であるキューカンバー・ビートル (cucumber beetle) が健全な植物体であるウイルス抵抗性品種を好んで食害するため、キューカンバー・ビートルが媒介するErwinia属細菌などの病害が増すというものである。
ディフェンシン生産イネ
ディフェンシンとは、約80個のアミノ酸残基から構成されシステイン残基に富む構造を特徴とする抗菌ペプチドの総称である。さまざまなアブラナ科植物の種や葉がディフェンシンを含むが、これはカイコやカブトムシ、ウサギ、ヒトなどがもつディフェンシンとは構造・活性範囲および活性強度が異なる。
イネにはアブラナ科植物のディフェンシンと配列類似性の高いものは存在しない。そこで、アブラナ科植物のさまざまなディフェンシンをイネで生産させて、イネの重大な病害であるいもち病や白葉枯病に抵抗性を付与する研究が進められてきた。ディフェンシン遺伝子はイネの緑葉組織特異的発現をするプロモーターと連結されて、イネ(母本品種:どんとこい)に導入されている。同様の研究は多数有り、ワサビ由来のディフェンシンを生産するイネも病害抵抗性を示している。
ここで、アブラナ科植物のディフェンシンの組換えによりイネは大量のディフェンシンを恒常的に生産することになる。これにより抗生物質や農薬の乱用による多耐性病原菌の出現と同様にディフェンシン耐性を持つ細菌やウイルスの出現が必至と考えられている。さらに、組換えディフェンシン遺伝子を発現させるプロモーターが耐性遺伝子の水平移動を可能にして、種を越えたディフェンシン耐性の拡散が広く起こることを遺伝子組換え食品反対派は強く懸念している。しかし、アブラナ科のディフェンシンとヒトのディフェンシンとは構造が大きく異なる。ディフェンシンをもともと生産するアブラナ科作物は大量に栽培されてきたが、今までそのような報告はない。また、遺伝子組換え食品反対派はそのような懸念を示しておきながら一方で、アブラナ科作物の大量栽培にも、アブラナ科のディフェンシンよりもヒトのディフェンシンとはるかに類似したディフェンシンを生産する家畜の飼育にも、ディフェンシン耐性菌出現を阻止することを目的として反対してはいない。
これに対する反論として、「自然界ではディフェンシンは必要なときにのみ生産されるため耐性問題がないのであり、ちょうどペニシリンが医薬品として生産される前はペニシリン生産能力を持つアオカビが存在したにもかかわらず、ペニシリン耐性菌がいない状況と同じと解釈すべきである」というものがある。『自然界ではディフェンシンは必要なときにのみ生産されるため耐性問題がない』という仮説が出されているが、イネに導入されたカラシナ由来のディフェンシンは細菌感染がなくても種子表層で生産されるものであり、『必要なとき』とはどのようなときをさすのかも、この仮説の根拠自体も明らかにされていない。なお、ペニシリン耐性菌を例にした反論は、比喩として適切ではない。まず、抗生物質生産菌自体が耐性菌である。ペニシリンは細菌の細胞壁の成分であるペプチドグリカンの生合成を阻害することによって抗菌性を発揮する。しかし、真菌である青カビには、もともとペプチドグリカンがないため、自身には作用しない。一方、抗生物質生産菌自身にも本来は作用するようなカナマイシンやエリスロマイシンなどを生産する菌は、自身が生産する抗生物質が自身に作用しないようにするために、抗生物質や抗生物質の作用点を修飾する耐性遺伝子をもともと保持している。ペニシリンには、生産菌である青カビ以外にも多種多様のペニシリン耐性菌が自然界に当初より存在していた。ペプチドグリカンを持たない真菌類やマイコプラズマはもともとペニシリン耐性菌であり、ペプチドグリカンを持つ細菌の中でもシュードモナス属細菌のようにペニシリン感受性の低いものも多数存在し、ペニシリンのβ-ラクタム環を開裂する酵素β-ラクタマーゼなどによりペニシリン耐性となっている細菌も存在する。ペニシリンが医薬品として生産される以前に、これらの微生物が存在していたことを否定できない以上、「耐性菌がいない状況」というものを想定できない。
なお、カイコのディフェンシンであるcecropin B をイネで生産させて白葉枯病に抵抗性を与えた研究やいろいろな抗菌ペプチドの配列から設計された人工抗菌ペプチドMsrA1をジャガイモで生産させて病害抵抗性にした研究などもある。
果実の収穫適期の拡大と保存性の向上
果実等の中には収穫適期が非常に短いものがある。特に、生食用のトマトなどでは色づき始めたらすぐに収穫して流通に乗せる必要性が高い。そうしないと店頭に並ぶころには過熟状態になったり、ケチャップやピューレなどへの工業的加工過程に入る前に傷口から腐敗したりして商品価値が低下することが多くなるためである。そこで、熟しても果皮が柔らかくならないように細胞間を充填しているペクチン (pectin) の分解が抑制された遺伝子組換えトマトが開発された。また、ペクチンの分解は果実が熟するときに誘導されるため、ペクチンの分解抑制ではなく熟期を遅らせることで柔らかくならないようにされたトマトやメロンも開発された。それらの手法は3種類知られている。
- ペクチンを分解する酵素ポリガラクチュロナーゼの生産抑制
- ポリガラクチュロナーゼの生産をアンチセンスRNA法などのRNAiの技法で直接抑制したFlavr Savrなどのトマトが開発された。その結果、熟しても果皮などはあまり柔らかくならない。
- 果実の成熟の制御(エチレン生合成酵素の抑制)
- 果実が熟する過程でポリガラクチュロナーゼの発現が誘導されるため、果実の熟する過程を制御する方向の研究が進んでいる。果実の熟する過程には、植物ホルモンの一種であるエチレンが関与している。そこで、エチレンの生合成を抑制する研究が進んだ。エチレンの生合成系は、次の二過程からなる。
- ACC合成酵素の作用により、S-アデノシル-L-メチオニン (S-adenosyl-L-methionine: SAM) から、1-アミノシクロプロパン-1-カルボン酸 (1-amino cyclopropane-1-carbonic acid: ACC) が合成される。
- ACC酸化酵素(アミノシクロプロパンカルボン酸オキシダーゼ)によって、ACCがエチレンに変換される。
- そこで、この過程に関与するACC合成酵素やACC酸化酵素をアンチセンスRNA法やコサプレッション法などのRNAiの技法で抑制すれば、エチレンの生合成が抑制されるわけである。ACC合成酵素を抑制したトマト 1345-4がDNA Plant Technology Corporation社により開発された。
- 果実の成熟の制御(エチレン生合成中間体の分解)
-
- エチレン生合成中間体であるACCを分解することでエチレン生産を抑制する。土壌細菌Pseudomonas chlororaphis由来のACCデアミナーゼ遺伝子の導入によって、ACCを2-オキソ酪酸 (2-oxobutyrate) とアンモニアに加水分解することによってエチレン生合成が抑制されたトマトも開発されている。ACCデアミナーゼ遺伝子が導入されたトマトは室温で収穫後121日放置しても瑞々しい状態であった。モンサント社のトマト CGN-89322-3 (8338)はACCデアミナーゼ遺伝子が導入されたものである。
- エチレン生合成の出発物質であるSAMを加水分解して減少させ、結果としてエチレン合成量を減らす。SAM加水分解酵素遺伝子の導入によって達成された。Agritope Inc.の開発したトマト品種35 1 Nやメロン品種AとBの例がある。
エチレン生合成が抑制されたトマト果実は出荷前に倉庫でエチレン処理をすると正常に熟しはじめる。エチレンによる果実の追熟は多くの果実で取り入れられている。たとえばバナナやマンゴーなどの熱帯輸入果実は、害虫移入防止のため未熟果実を輸入しエチレンによって追熟されている。エチレン合成抑制による収穫適期拡大手法ではそのための設備を利用できる。
マイコトキシン分解酵素生産作物
植物体の傷口より進入した糸状菌の生産するマイコトキシンは食料や飼料の安全性を脅かす大問題である。Bt toxin生産作物では害虫による食害が減るために、マイコトキシン含量が減っている。それよりも生産されたマイコトキシンを分解する酵素を作物に生産させて、積極的にマイコトキシン含量を低減させる試みがある。
その一つが、マイコトキシンであるフモニシン分解酵素をトウモロコシに生産させてフモニシン含量を低減させようというものである。黒色酵母Exophiala spiniferaのフモニシン分解系の酵素はすでに解析されている。そこで、これらの酵素をトウモロコシで生産させようというものである。
次に、ゼアラレノン(Zearalenone) 分解酵素遺伝子の導入である。糸状菌Clonostachys roseaよりラクトン環解裂酵素遺伝子zhd101をトウモロコシに導入したところ、ゼアラレノンをほとんど分解してしまったという結果が得られた。
雄性不稔形質作物
概説
収量の増加、病虫害抵抗などの雑種強勢を目的に多くのF1(first filial generation:雑種第一代)作物が作られている。自家受粉可能な作物の固定された品種では多くの遺伝子座においてホモ接合状態になっているため、異なる品種をかけ合わせた雑種第一世代であるF1状態になれば多くの遺伝子座においてヘテロ接合状態になって雑種強勢の効果による収量の増加や品質の向上が期待される。F1種子を得ることはトウモロコシの様に雄花と雌花が別れている作物では比較的容易ではあるが、人手がかかる。さらに、自家受粉する作物に他家受粉させて安定的に均一なF1種子を得ることは困難である。そのため、花粉を形成しない、花粉に稔性がないという雄性不稔系統があればF1種子が得やすくなる。現在では、さまざまな作物で雄性不稔系統を用いてF1品種が開発されているが、それでも利用できる作物が限定されている。そこで、遺伝子組換え技術が雄性不稔系統の開発に応用されている。
組織特異的な除草剤感受性を利用した雄性不稔
花粉の成熟に関与しているタペート細胞では発現しないようなプロモーターを利用した除草剤耐性作物を用いた雄性不稔の付与である。公開されている「除草剤グリホサート誘発性雄性不稔及び除草剤グリホサート耐性トウモロコシ(改変 cp4 epsps, Zea mays subsp. mays (L.) Iltis)(MON87427, OECD UI: MON-87427-7) 申請書等の概要」を例とする。
除草剤グリホサート(ラウンドアップ)耐性化遺伝子(ラウンドアップの項を参照)をタペート細胞および小胞子においては発現しないかあるいは発現しても微量であるが、栄養組織および雌性生殖組織においてはグリホサート耐性を付与するのに十分な量を発現できるようなプロモーターに連結する。それが導入されたトウモロコシをグリホサート非存在下で自家受粉させ、導入遺伝子をホモ接合で持つ品種(BB)を種子親として育種する。一方、種子親とは別系統の品種で、全組織で耐性を示すような別のプロモーターで制御されているグリホサート耐性化遺伝子をホモ接合で持つ品種(AA)を花粉親とする。種子親と花粉親を隣接して栽培し、雄花が分化する8葉期頃および10葉期頃にグリホサートを散布して、種子親(BB)の花粉を不稔にする。タペート細胞でも耐性である花粉親(AA)の花粉は稔性があるため、種子親の雌花に受粉する。種子親のみから種子を採種すればそれはヘテロ接合(AB)のF1種子となる。F1植物体はAのゲノムも持つため、植物全組織はグリホサート耐性を示す。
葯特異的発現をするDNAメチル化酵素を利用した雄性不稔
プロモーターやエンハンサーのDNAがメチル化されることによりトランス転写因子がそれらを認識できなくなり、その結果、細胞の分化や生育に影響を与え死滅させることがある。そこで大腸菌の遺伝子damにコードされているDNA中のアデニン残基をメチル化する酵素を、トウモロコシの葯特異的に発現する遺伝子512delのプロモーターを用いてトウモロコシ中で生産させると葯や花粉を形成できず雄性不稔となった。Pioneer Hi-Bred International Inc.の開発したトウモロコシ 676、678、680の例がある。
BARNASEを用いた雄性不稔形質の付与とBARSTARを用いた雄性不稔からの回復
遺伝子組換え技術により花粉が成熟できなくなるような人為的な雄性不稔系統と雄性不稔からの稔性回復系統が作られた。その実現には次の四つのものが重要な役割を果たす。
- 葯に存在する、花粉の成熟に関与しているタペート細胞において特異的に発現しているタバコ (Nicotiana tabacum) 由来の遺伝子TA29(配列)のプロモーター
- グラム陽性細菌Bacillus amyloliquefaciens由来のRNase(リボヌクレアーゼ)であるBARNASEの遺伝子barnase(配列)
- BARNASEと特異的に結合して阻害する、同じくB. amyloliquefaciens由来のタンパク質であるBARSTARの遺伝子barstar(配列)
- 除草剤耐性遺伝子
TA29のプロモーターとbarnaseのキメラ遺伝子(配列)によって、葯のタペート細胞特異的にBARNASEが生産されると細胞内のRNAが分解されてタペート細胞は死滅し、花粉が成熟できなくなり、その結果、その植物は雄性不稔系統となる。
種子親となる雄性不稔系統の近傍に花粉親となる品種を栽培すれば、雄性不稔系統に結実する種子は両者のF1であることが期待される。しかし、その種子から得られたF1植物体も雄性不稔である確率が高く、ダイズ、トウモロコシ、イネ、菜種などの子実を収穫する作物においては自家受粉できることが望まれるため、F1植物体においては雄性不稔形質が出現しない方がよい。そこで、花粉親が雄性不稔からの稔性回復系統である必要がある。そのためには、花粉親として用いる植物が、TA29のプロモーターとbarstarのキメラ遺伝子(配列)によって葯のタペート細胞特異的にBARSTARが生産されるように導入された遺伝子をホモ接合で保有していればよい。
これらのBARNASEとBARSTARを利用した系を説明する。F1の親品種としたいそれぞれ純系のAとBの品種を用意する。Aにはbarnaseと除草剤耐性遺伝子の双方を含むカセットを導入する。導入されてできた雄性不稔品種をAsとする。Asに導入されたカセットが1コピーであるならAsの遺伝子型は (barnase / -) となる。Asは雄性不稔であり自家受粉できないため雄性不稔維持系統として親品種Aを用い、その花粉で受粉させて結実させ、種子を播種する。種子の遺伝子型はAと同一のものとAsと同一の (barnase / -) とが1:1で分離してくる。Asと同一の (barnase / -) のものだけをbarnaseと同じ導入遺伝子カセットに存在している除草剤耐性遺伝子によって除草剤耐性で選択できる。そのため、Asを大量に増殖できる。Bにbarstarと除草剤耐性遺伝子の双方を含むカセットを導入する。できた品種Brは自家受粉可能であるため、除草剤耐性の後代をとってその中からホモ接合となった遺伝子型 (barstar / barstar) の株Brrを選択して増殖する。Brrを稔性回復系統として用いる。Asの近傍にBrrを植えてAsに結実したF1種子のみを採種する。F1種子の遺伝子型はbarnaseとbarstarに関して (barnase / -, barstar / -) と (- / -, barstar / -) が1:1で分離し、それぞれの種子から育ったF1植物体は自家受粉可能となる。
この手法の適用例は多数あるが、その一例としてバイエルクロップサイエンス社のカノーラについて挙げると「除草剤グルホシネート耐性及び雄性不稔及び稔性回復性セイヨウナタネ(改変bar, barnase, barstar, Brassica napus L.)(MS8RF3, OECD UI: ACS-BNØØ5-8×ACS-BNØØ3-6) の生物多様性影響評価書の概要」で公表されている。
なお、F1品種に結実した種子(F2世代)は発芽可能で栽培できるが、遺伝的に不均一な集団であるため、次回の栽培には新たに種子を購入する必要がある。これは、F1品種を栽培する場合、非組換えのF1品種でも毎作ごとにF1品種の種子を購入しなくてはならないのと同じ理由である。
耐熱性α-アミラーゼ生産トウモロコシ
主としてトウモロコシを原料としたエタノール生産を効率的に行うために開発されたものである。従来、トウモロコシ穀粒の乾燥粉末からエタノールを生産する場合、加水・加熱するとともに微生物由来の耐熱性α-アミラーゼとグルコアミラーゼを添加して澱粉を可溶化と糖化してから、酵母でエタノール発酵させている。微生物由来のα-アミラーゼを添加する代わりに、トウモロコシ穀粒中に耐熱性α-アミラーゼを生産・貯蔵させて、作業工程の簡略化と低コスト化を狙ったものである。たとえば、公開させているシンジェンタシード株式会社の「耐熱性α-アミラーゼ産生並びにチョウ目及びコウチュウ目害虫抵抗性並びに除草剤グルホシネート及びグリホサート耐性トウモロコシ (耐熱性α-アミラーゼ産生並びにチョウ目及びコウチュウ目害虫抵抗性並びに除草剤グルホシネート及びグリホサート耐性トウモロコシ(改変amy797E, 改変cry1Ab, cry34Ab1, cry35Ab1, 改変cry3Aa2, cry1F, pat, mEPSPS, Zea mays subsp. mays (L.) Iltis)(3272×Bt11×B.t. Cry34/35Ab1 Event DAS-59122-7×MIR604×B.t. Cry1F maize line 1507×GA21, OECD UI:SYN-E3272-5×SYN-BTØ11-1×DAS-59122-7×SYN-IR6Ø4-5×DAS-Ø15Ø7-1×MON-ØØØ21-9) 並びに当該トウモロコシの分離系統に包含される組合せ(既に第一種使用規程の承認を受けたものを除く。)の申請書等の概要」によると、Thermococcales目の好熱古細菌由来のα-アミラーゼ遺伝子を改変した改変amy797E遺伝子をトウモロコシに導入して、耐熱性α-アミラーゼを穀粒で産生させている。トウモロコシ穀粒中で生産されるα-アミラーゼとして耐熱性のものが選ばれた理由は、デンプンの可溶化と糖化の促進と雑菌汚染の減少のためにトウモロコシ穀粒粉末に加水したものを加熱するため、その温度で失活してはならないからである。また、トウモロコシ穀粒中で生産されたα-アミラーゼが予期せぬ影響を及ぼさないようにするため、成熟中や保存中の穀粒中でデンプンを分解しないようにする必要がある。そのためには、細胞内でα-アミラーゼとデンプンを隔離すればよい。そこで、改変AMY797E α-アミラーゼのアミノ末端には、小胞体内腔へ輸送するためのシグナルペプチドが付加された。さらに、カルボキシル末端には、小胞体に局在化させるために小胞体残留シグナル配列(KDEL)が付加された。これらの付加配列により、生産された耐熱性α-アミラーゼは胚乳細胞の小胞体中に蓄積される。一方、α-アミラーゼの基質であるデンプンは穀粒中のプラスチドの一形態であるアミロプラスト中に澱粉粒として存在している。つまり、改変AMY797E α-アミラーゼと基質となるデンプンは、細胞内の異なる細胞内小器官にそれぞれ存在しているため、細胞が破壊されない限りは改変AMY797E α-アミラーゼによるデンプン分解は生じないと考えられる。
ストレス耐性作物
概説
植物が生育していくうえで様さまざまな環境ストレスがある。たとえば、低温ストレス、凍結ストレス、高温ストレス、乾燥ストレス、浸透圧ストレス(塩ストレス)、強光ストレス、冠水ストレスなどが代表的である。これらのストレスに強い作物が開発できれば未利用地が耕地として利用できるようになるため、さまざまな研究が進められている。たとえば、低温ストレスの感受性・抵抗性に関しては、プラスチドのチラコイド膜のホスファチジルグリセロール (phosphatidyl glycerol) の脂肪酸残基組成が関与しているため、ホスファチジルグリセロールの生合成系において取り込まれる脂肪酸残基の基質特異性に関わる酵素 acyl-(acyl-carrier protein): glycerol-3-phosphate acyltransferase (GPAT) を改変することによって低温耐性を付与する研究などがある。浸透圧ストレス(塩ストレス)に関しては、ナトリウムイオンの細胞からの排出促進するためにNa+/H+アンチポーターなどの利用の研究が進んでいる。そのほか、これらのストレスに共通に生じる障害を軽減するために、グリシンベタインやプロリンやトレハロースなどの適合溶質 (compatible solute) の合成遺伝子や蓄積させるための遺伝子の導入、ストレス応答性遺伝子を制御する DREB (Dehydration-Responsive Element Binding factor) などの転写因子の発現、熱ショックタンパク質などのストレス関連タンパク質、ストレスによって生じる活性酸素種を消去するアスコルビン酸ペルオキシダーゼやスーパーオキシドジスムターゼ(SOD)などの遺伝子を利用する研究も進んでいる。そのほか、タンパク質のユビキチン化に関わるE3 ユビキチン・リガーゼ (E3 ubiquitin ligase) であるOsSDIR1を過剰生産させることにより、イネを乾燥耐性にした例も存在する。
また、微量成分の欠乏や過剰も植物にとってはストレスとなる。たとえば、鉄は植物の微量栄養素であるが、比較的要求性は高く、不足すると生育遅滞やクロロシスなどが生じる。そこで、土壌中の不溶化している鉄を可溶化する能力を植物に付与したり、鉄を含むタンパク質を機能的に代替できるタンパク質を生産させたりして、鉄欠乏を緩和する育種が行われている。また、その他の微量成分に対しても研究が進められている。
RNAシャペロンを利用した乾燥耐性トウモロコシ
モンサント社の乾燥耐性トウモロコシ MON87460に関しては、「乾燥耐性トウモロコシ(改変cspB, Zea mays subsp. mays (L.) Iltis)(MON87460, OECD UI: MON-8746Ø-4) 申請書等の概要」によって公表されている。トウモロコシの後期栄養生長期から初期生殖生長期における乾燥ストレス条件下において収量の減少を抑制するために、改変低温ショックタンパク質B (cold shock protein B) 遺伝子(改変cspB遺伝子)を導入されたものである。改変cspB遺伝子の供与体は、納豆菌もその一部として含まれる枯草菌Bacillus subtilisである。CspBはRNAシャペロンとして機能して、RNAの二次構造を解消することが知られている。
グリシンベタイン蓄積によるストレス耐性
グリシンベタインは、テンサイ、ホウレンソウなどのアカザ科植物やコムギなど低温耐性の植物に多く含まれる適合溶質であるが、イネやトマトやアラビドプシスは蓄積しない。多量に含まれても細胞の生化学反応や細胞内小器官には悪影響を及ぼさずに浸透圧の調整、活性酸素から膜やタンパク質の保護を行うことが知られている。そこで、グリシンベタインを生合成しない植物にグリシンベタインを合成させてさまざまなストレス耐性を強化する試みがある。
グリシンベタインはコリンがベタインアルデヒド (betaine aldehyde) を経て酸化されて合成される。この反応を行う合成系にはいくつかの種類があることが知られている。植物ではプラスチドで合成される。コリンからベタインアルデヒドへ酸化する酵素、コリン一酸素添加酵素はフェレドキシン要求性の酵素である。次にベタインアルデヒドからグリシンベタインへ酸化する酵素、ベタインアルデヒド脱水素酵素によってグリシンベタインへと酸化される。一方、細菌Arthrobacter globiformisでは分子状酸素のみを要求する一種類の酵素、コリン酸化酵素によって合成されている。A. globiformisのコリン酸化酵素の遺伝子codAは、導入する遺伝子が1つで済むこととコードしている酵素がコリンと分子状酸素以外には必要としない性質のため、植物や大腸菌由来のグリシンベタイン生合成酵素遺伝子よりも植物に導入されている例が多い。
なお、コリン一酸素添加酵素遺伝子であるcodAを植物で発現させてもグリシンベタイン生成量が少ないのは、植物中のコリン含量が制限要因となっているからである。そこで豊富に存在するグリシンからグリシンベタインへ変換する別のグリシンベタイン合成経路を利用する試みがある。メタン生成古細菌Methanohalophilus portucalensis FDF1株由来のグリシン サルコシン N-メチル基転移酵素 (glycine sarcosine N-methyltransferase: GSMT) とサルコシン ジメチルグリシン N-メチル基転移酵素 (sarcosine dimethylglycine N-methyltransferase: SDMT) を植物で生産させた。GSMTはグリシン N-メチル基転移活性(グリシン N-メチルトランスフェラーゼ)とサルコシン N-メチル基転移活性を、SDMTはサルコシン N-メチル基転移活性とジメチルグリシン N-メチル基転移活性を持つ。つまり、GSMTとSDMTによりグリシンからサルコシンへ、サルコシンからN, N-ジメチルグリシンへ、N, N-ジメチルグリシンからグリシンベタインへ変換される。GSMTとSDMTが生産されているシロイヌナズナは塩耐性を示した。
グリシンベタインを生産するようになった形質転換植物は、低温ストレス、高温ストレス、乾燥ストレス、凍結ストレス、塩ストレスなどさまざまなストレスに抵抗性を示すようになる。合成されたグリシンベタインのモル濃度だけでは、そのストレス抵抗性を説明できない。そこで、グリシンベタインの細胞内局在による局所的高濃度、膜やタンパク質に対する保護作用、コリン酸化酵素の反応に伴い生じる過酸化水素による活性酸素消去系酵素の常時誘導など、ストレス耐性機構を説明するさまざまな説がある。
プロリン蓄積によるストレス耐性
アミノ酸のプロリンも同様に適合溶質である。プロリンを蓄積させる手法には2種類ある。一つは、プロリン合成を促進する方法であり、もう一つはプロリン分解を阻害する方法である。プロリンの生合成は高濃度のプロリンによってフィードバック阻害を受ける。そこで、プロリン生合成系のフィードバック阻害を受ける酵素、L-1-ピロリン-5-カルボン酸合成酵素 (L-1-Pyrroline-5-carboxylate synthetase) のフィードバック阻害が解除された変異酵素の遺伝子を導入すると大量のプロリンが合成された。もう一つは、プロリンを分解する酵素、プロリン脱水素酵素をRNAiなどの手法で阻害する方法である。プロリンを蓄積することにより形質転換植物はさまざまなストレスに抵抗性を示すようになった。
トレハロース蓄積によるストレス耐性
トレハロースは動植物、微生物に広く存在する、保水力の強い二糖である。これを植物に蓄積させて乾燥・強光ストレス耐性にした。グルコース-6-リン酸とUDP-グルコースからトレハロース-6-リン酸を合成する酵素、トレハロース-6-リン酸合成酵素とトレハロース-6-リン酸からトレハロースに変換する酵素、トレハロース-6-リン酸脱リン酸化酵素を導入することによって達成された。
活性酸素消去酵素によるストレス耐性
アスコルビン酸ペルオキシダーゼやグルタチオンペルオキシダーゼやカタラーゼやSODなどの活性酸素を除去する酵素を過剰生産することによって、さまざまなストレス耐性を付与する研究が進んでいる。
ムギネ酸類生産によるアルカリ土壌鉄欠乏耐性イネ
アルカリ土壌中において三価鉄は安定であり、植物の根から放出される有機酸で可溶化することは困難である。そのため、アルカリ土壌中では植物は鉄欠乏を起こして生育しにくい。イネ科植物の根はムギネ酸類とよばれるキレート能を持つ物質を放出して、アルカリ土壌中の三価鉄を吸収している。オオムギはその能力が高いため、アルカリ土壌中でもよく生育できるが、イネやトウモロコシの能力は低く、アルカリ土壌中での生育は困難である。そこで、アルカリ土壌中でも生育できるイネの開発を目的として、イネのムギネ酸生合成系を強化して鉄欠乏耐性イネが開発された。
ムギネ酸の生合成は、まず3分子のS-アデノシル-L-メチオニン (S-adenosyl-L-methionine: SAM)から1分子のニコチアナミン(nicotianamine) を合成する酵素であるニコチアナミン合成酵素によって始まり、ニコチアナミンから3"-デアミノ-3"-オキソニコチアナミン (3"-deamino-3"-oxonicotianamine) に変換する酵素であるニコチアナミン・アミノ基転移酵素や、3"-デアミノ-3"-オキソニコチアナミンから2'-デオキシムギネ酸 (2'-deoxymugineic acid) に還元する酵素である3"-デアミノ-3"-オキソニコチアナミン還元酵素や、2'-デオキシムギネ酸からムギネ酸へ変換する酵素である2'-デオキシムギネ酸-2'-ジオキシゲナーゼなどの酵素が関与している。これらの酵素遺伝子はオオムギより単離されている。これらの酵素遺伝子が導入されたイネはアルカリ土壌における鉄欠乏に耐性を示した。現在、さまざまな遺伝子が導入された形質転換イネが試験栽培されている。
フラボドキシン生産による鉄欠乏耐性植物
鉄は電子伝達系の電子伝達タンパク質であるフェレドキシンの構成成分であり、高等植物において鉄が欠乏すると結果としてフェレドキシンが不足し、電子伝達系が関与しているプラスチドの光合成系などに支障をきたす。ところが、ある種のラン藻や藻類においては、フェレドキシンが不足すると、フェレドキシンと類似した機能を持ち、多くの反応においてフェレドキシンの代替となるフラボドキシン (flavodoxin) が合成される。フラボドキシンはフラビンモノヌクレオチドを含む電子伝達タンパク質である。そこで、ラン藻由来のフラボドキシン遺伝子にプラスチドへの移行シグナル部分の塩基配列を融合したものを高等植物において発現させると鉄欠乏耐性が増強されることが確認されている。
組換え作物の収量
Roundup Ready2Yieldのように初めから収量を高めるように育種されたものでもなくても、除草剤耐性ダイズや害虫抵抗性トウモロコシの収量が在来種よりも高いことが報告されている。
- 除草剤耐性ダイズ
- 栽培技術の面で除草剤耐性ダイズを栽培する際に畝間を狭くすることでより高密度で種子をまいて、単位面積あたりの収量を増加させる栽培法が利用できるようになった。在来品種では1 haあたり60万株を栽培していた。それよりも高密度栽培をすると光条件が悪くなるため、1株あたりの莢数と種子数は減少したが、1つ1つの種子は大きくなり、最終的な収穫量は1haあたり80万株で最大となった。
- 害虫抵抗性トウモロコシ
- 害虫抵抗性の組換え品種は、害虫の加害による損失を減らすため、基礎収量の同じ非組換え品種と比べても、結果として高い収量が得られることになる。それだけではなく、高密度栽培によっても収量が増えている。害虫抵抗性トウモロコシの場合、茎に潜り込むアワノメイガなどの被害が減るため密植しても茎が倒れる被害が減るためである。
第二世代組換え食品の開発状況
概説
第二世代組換え食品とは、ワクチン等の有用タンパク質の工場として利用することができたり、栄養素を多く含ませたり、食品中の有害物質を低減させたり、消費者にとって利益が目に見えるものである。例えば、B型肝炎予防の食べるワクチンとしてB型肝炎ウイルスの表面抗原をバナナで発現させ経口免疫によってB型肝炎感染を防除する試みがある。油糧種子中の油脂の脂肪酸残基組成を改変することは、第二世代組換え食品開発の初期からの目標であった。また、日本においてはインスリンを分泌誘導して糖尿病になりにくくするコメや経口免疫寛容によるスギ花粉症を低減するコメの開発が先行している。また、鉄分を多く含むコメも開発中である。
オレイン酸高含有遺伝子組換えダイズ
一般的なダイズ油中の不飽和脂肪酸残基の組成はリノール酸(18:2)(約50%)、オレイン酸(18:1)(約20%)、リノレン酸(18:3)(約10%)である。一方、オレイン酸高含有遺伝子組換えダイズ油(高オレイン酸ダイズ油)には約85%のオレイン酸残基が含まれ、リノール酸やリノレン酸などの多価不飽和脂肪酸(polyunsaturated fatty acids : PUFAs)残基が少ない。オレイン酸のような一価不飽和脂肪酸(monounsaturated fatty acid)残基を多量に含む油脂は血中の高密度リポタンパク質(high density lipoprotein : HDL)の比率を増やして、動脈硬化を防止すると考えられている。更に、オレイン酸はPUFAsに比べ酸化に安定である。そのため、高オレイン酸ダイズ油は揚げ油などに適している。
これは、炭素数18の脂肪酸の不飽和化に関与している酵素の発現を制御することによって達成された。
ステアリン酸からリノール酸までの不飽和化酵素デサチュラーゼには、ステアリン酸(18:0)のCoAチオエステルであるステアロイルCoA (stearoyl-CoA)からオレイン酸のCoAチオエステルであるオレオイルCoA (oleoyl-CoA)への反応を触媒するΔ9-desaturase (ω9-desaturaseともとオレイン酸残基からリノール酸残基への不飽和化に関与している酵素ω6-desaturase (デサチュラーゼ, Δ12-desaturaseとも: FAD2)がある。このω6-desaturaseの遺伝子(FAD2)の発現を抑制することによってオレイン酸残基の含量を高めている。デュポン社のダイス 260-05系統に関しては、「高オレイン酸ダイズ(GmFad2-1, Glycine max (L.) Merr.)(260-05, OECD UI :DD- Ø26ØØ5-3) 申請書等の概要」により、公表されている。
更に、FAD2を抑制するだけではなくFATBも抑制することにより、飽和脂肪酸残基含量が少なくオレイン酸残基含量の多いダイズが開発されている。FATBとは、パルミトイル-ACP チオエステラーゼ(palmitoyl-ACP thioesterase, EC 3.1.2.14, ACP: acyl carrier protein、アシル輸送タンパク質)であり、炭素鎖14-18の飽和脂肪酸残基を持つアシル-ACPを加水分解でき、その中でも主にパルミトイル-ACP (16:0-ACP)を加水分解する。一方、FATAはオレオイル-ACPを加水分解する。FATBが抑制され、FATA活性が十分ある場合、飽和脂肪酸残基が減少し、不飽和脂肪酸残基が増加する。更に、多価不飽和脂肪酸残基への変換を触媒するFAD2が抑制されていれば、一価不飽和脂肪酸残基であるオレイン酸残基の含量は増加する。このような形質を持つモンサント社のMON87705系統に関しては、「低飽和脂肪酸・高オレイン酸及び除草剤グリホサート耐性ダイズ(GmFAD2-1A, GmFATB1A, 改変cp4 epsps, Glycine max (L.) Merr.)(MON87705, OECD UI: MON-877Ø5-6)申請書等の概要」により、公表されている。
ステアリドン酸含有遺伝子組換えダイズ
エイコサペンタエン酸(eicosapentaenoic acid(20:5): EPA)やドコサヘキサエン酸(docosahexaenoic acid(22:6): DHA) などの長鎖ω-3脂肪酸は、心臓発作のリスクを軽減することが知られている。これらの脂肪酸の前駆体であるステアリドン酸(stearidonic acid(18:4): SDA)の残基を含むダイズを育種した。ダイズにはSDAが含まれない。これは、炭素鎖18個の脂肪酸のカルボキシル基から数えて6番目と7番目の炭素の間を二重結合を導入するω12-desaturaseがダイズにないためである。そこでサクラソウの一種であるPrimula juliaeからω12-desaturaseに対応するコーディング領域が導入された。
また、ダイズのリノール酸残基からα-リノレン酸残基へ変換するω3-desaturase(Δ15-desaturase: FAD3)の活性を高めるために、アカパンカビ(Neurospora crassa)のΔ15-desaturaseの遺伝子も導入されている。その結果、リノール酸のCoAチオエステルであるリノレオイル-CoA (linoleoyl-CoA)からω12-desaturaseによってγ-リノレン酸のCoAチオエステルであるγ-リノレノイル-CoA (γ-linolenoyl-CoA)に、γ-リノレノイル-CoAからω3-desaturaseによってステアリドノイル-CoA(stearidonoyl-CoA)へと変換される。もしくは、リノレオイル-CoAからω3-desaturaseによってα-リノレン酸のCoAチオエステルであるα-リノレノイル-CoA (α-linolenoyl-CoA)へ、α-リノレノイルCoAからω12-desaturaseによってステアリドノイル-CoAへと変換される。
ステアリドン酸含有遺伝子組換えダイズに関してはモンサント社のMON87769が、「ステアリドン酸産生及び除草剤グリホサート耐性ダイズ(改変Pj.D6D, 改変Nc.Fad3, 改変cp4 epsps, Glycine max (L.) Merr.)(MON87769×MON89788, OECD UI:MON-87769-7×MON-89788-1)申請書等の概要」で公表されている。
リシン高含有トウモロコシ
L-リシン (L-lysine) は必須アミノ酸の一種である。しかし、イネ科の植物の貯蔵タンパク質ではその含有量が低いため、飼料として使う際にはリシンを添加している。このコストを低減するために、リシンを多く含むトウモロコシであるモンサントLY038が開発された。
現在、市販されているリシンは、微生物を用いたアミノ酸発酵によって工業生産されているものである。各アミノ酸生合成系では、それぞれのアミノ酸濃度が低下すると生合成が促進されるとともに、必要以上にアミノ酸濃度が上昇すると生合成が抑制されるようにフィードバック制御されている。微生物によるアミノ酸発酵においてはそのアミノ酸の生合成系の鍵酵素のフィードバック阻害が解除されたものを利用することが多い。あるアミノ酸の生合成系のフィードバック阻害解除株はそのアミノ酸のアナログに対する耐性株(アナログ耐性株)として得られる。リシン生合成の場合、フィードバック阻害は、リシン生合成系の酵素群の1つで鍵酵素でもあるジヒドロジピコリン酸合成酵素(DHDPS)の酵素活性の低下で生じる。最終産物であるリシンがネガティブ・エフェクターとしてアロステリック酵素であるDHDPSに作用する。
そこで、リシン・アナログ耐性のCorynebacterium glutamicumのDHDPS(リシンによるフィードバック阻害が解除されている変異型)をコードしている遺伝子cordapAが利用された。更に、植物の細胞質中で合成されたC. glutamicumの変異型DHDPSが植物のリシン生合成の場であるプラスチドへ移行できるように、トウモロコシのDHDPSの遺伝子mDHDPSのプラスチドへの移行配列(transit peptide)部分の塩基配列が、C. glutamicumのDHDPS遺伝子(cordapA)と連結された融合遺伝子がつくられた。それにトウモロコシの胚乳の貯蔵タンパク質であるグロブリン(globlin 1)の遺伝子のプロモーターと連結されたものがトウモロコシに導入された。導入されたC. glutamicumの変異型DHDPSはフィードバック阻害が解除されているため植物でもリシン生合成がフィードバック阻害されず、また、胚乳中で発現するグロブリン遺伝子のプロモーターによってトウモロコシ種子中のリシン含有量が増加した。モンサントLY038の「生物多様性影響評価書の概要」、「高リシン(lysine)トウモロコシ(cordapA, Zea mays subsp. mays (L.) Iltis)(LY038, OECD UI: REN-ØØØ38-3)の生物多様性影響評価書の概要」は、公開されている。形質転換における選択系・選択マーカー遺伝子の除去系として、後述の「選択マーカー遺伝子の除去系」のうちの「Cre-loxP system」が用いられている。
プロビタミンA強化作物
概説
ビタミンAの欠乏は、子供の失明や発育障害などを招き、慢性的に摂取量が少ない後進地域では将来の人口構成にまで影響を与える。このため、国際協力の一環として様々な研究機関や団体がビタミンAの摂取量を高めるための品種改良に取り組んでいる。植物のカロテノイドの一部はビタミンAの前駆体であるプロビタミンAである。1分子のβ-カロテン(β-carotene)から2分子のビタミンAに、1分子のα-カロテンやγ-カロテンやβ-クリプトキサンチンから1分子のビタミンAに変換される。そこで、作物中のプロビタミンA量を増やすための機構として次のものが挙げられる。
そこでイネ、トウモロコシ、コムギ、ジャガイモ、サツマイモなど様々な作物において、これらの機構が応用されてプロビタミンA強化作物が開発されている。
ゴールデンライス
多くの発展途上国において深刻な問題になっているビタミンA(vitamin A)欠乏の解決策として開発されたイネの品種である。ビタミンAの前駆体であるβ-カロテンを内胚乳に含有するため精米された米が黄金色を呈することから、このような名称がつけられた。
ゴールデンライスには植物由来のフィトエン合成酵素の遺伝子psyと細菌由来のフィトエン不飽和化酵素の遺伝子crtIが導入されており、リコペンを合成できる。細菌由来のフィトエン不飽和化酵素であるCrtIは植物のカロテノイド合成場所であるプラスチドへはそのままでは移行できないので、crtIにはプラスチドへの移行ペプチドをコードした塩基配列が融合されている。リコペンはイネの内胚乳中にもともと存在するリコペンβ-環化酵素によってβ-カロテンに変換される。
ゴールデンライス自体を主食としてもビタミンAの必要量を満たさないとの主張が遺伝子組換え食品反対派にあったが、2005年には、新たにゴールデンライス2が発表され、これだけを摂食することでビタミンAの必要量がまかなえるようになった。これはカロテノイド生合成系遺伝子としてゴールデンライスで用いられていたスイセン由来のpsyの代わりにトウモロコシ由来のpsyを利用することにより達成された。
ゴールデンライスは2015年にアメリカ合衆国特許商標庁の"Patents for Humanity Awards"を受賞し、2018年にはオーストラリア、ニュージーランド、カナダ、アメリカ合衆国で食品として承認され、そして2021年に世界で初めてフィリピンで洪水と乾燥の両方に耐性があるコメ品種「RC82」を遺伝子操作したゴールデンライスの商業栽培が認可された。
プロビタミンA強化ジャガイモ
ジャガイモにおいては様々な機構が適用されて塊茎中のプロビタミンAが強化されたジャガイモが開発されている。ゴールデンライスと同様にカロテノイド生合成を強化する目的で、Erwinia由来のフィトエン合成酵素(CrtB)とフィトエン不飽和化酵素(CrtI)とリコペンβ-環化酵素(CrtY)の遺伝子が導入されたものが開発された。また、プロビタミンAとしての効力の高いβ-カロテンの高比率化をはかるために、α-カロテンの合成に関与するリコペンε-環化酵素を抑制して、β-環を持つカロテノイドの含量を高めたものも開発されている。更に、β-カロテンからキサントフィルへの変換を抑制することにより、β-カロテン含量を高めたジャガイモも開発されている。β-カロテンのβ-環を水酸化する酵素、β-カロテン 3-水酸化酵素を抑制するものである。これらのプロビタミンAが強化されたジャガイモの塊茎の断面は黄色味を呈する。
ビタミンE強化ダイズ
トコフェロール類にはビタミンE活性があるが、分子種によってその活性の強弱は異なる。トコフェロール類はメチル化の程度やメチル基の位置によって、α-, β-, γ-, δ-トコフェロールと区別されている。これらの中では、α-トコフェロールが最もビタミンE活性が強い分子種であり、次がβ-トコフェロールである。ダイズ種子に由来するダイズ油中に存在するトコフェロール類の主要分子種はγ-トコフェロールであり、次がδ-トコフェロールである。これらはビタミンE活性が弱い。そこで、これらをα-トコフェロールやβ-トコフェロールに変換することによってビタミンE活性を増強することが試みられた。エゴマ(Perilla frutescens, シソと同種の植物)のγ-トコフェロール・メチル転移酵素の遺伝子をエンドウマメの種子特異的貯蔵タンパク質であるvicillinの遺伝子のプロモーターを用いてダイズの種子中で発現させた。その結果、γ-トコフェロールやδ-トコフェロールの含量は大幅に減る一方、α-トコフェロール含量は10倍強、β-トコフェロール含量は15倍弱まで増えた。その結果、ビタミンE活性が4.8倍強化されたダイズ種子が得られた。
アントシアニン高含有果実
アントシアニンはフラボノイド系のポリフェノールであり、植物の重要な色素である。アントシアニンには抗酸化活性とともに様々な生理活性があり、健康食品としても注目されている。このアントシアニンをトマトで大量に蓄積させることに成功した。キンギョソウ由来のアントシアニンの合成を誘導する2種類の転写因子の遺伝子Delila (Del)(ACCESSION M84913塩基配列)とRosea1 (Ros1)(ACCESSION DQ275529塩基配列)をトマトに導入し、過剰発現させたところ、デルフィニジン系のアントシアニンを大量に蓄積した紫色のトマトの果実ができた。このアントシアニンが大量に蓄積して果実が紫色になる形質は、トマトの他の品種と交配させると、交雑品種にも遺伝することが示されている。
スギ花粉米
スギ花粉米とは、摂食によりスギ花粉症を緩和させることを目的に、スギ花粉が持つ抗原タンパク質が種子に蓄積するように遺伝子組換えによって作出されたイネである。2005年に農業生物資源研究所の高木英典らによってマウスでスギ花粉へのアレルギー症状の緩和が報告され、ヒトへの応用に向け研究開発が進められている。
鉄分豊富なコメ
上記にあるゴールデンライスと同様に、多くの発展途上国において深刻な問題になっている鉄欠乏とそれによる貧血の解決策として鉄分豊富なコメが開発されている。大きく分けて二つの方法がある。一つは、鉄を貯蔵するダイズ由来のタンパク質であるフェリチン(ferritin)の分子種H1やH2をイネの種子中に多量に蓄積させることで種子中の鉄貯蔵能力を高め、鉄含有量を増加させる方法であり、こちらは"フェリチン米"とも呼ばれている。もう一つは、植物にとって鉄イオン吸収に関わるムギネ酸合成の前駆体であるとともに鉄イオンの体内輸送に係るニコチアナミンを合成する酵素の遺伝子の発現量を高める方法である。オオムギ由来の高発現のニコチアナミン合成酵素遺伝子をイネに導入して植物体中のニコチアナミンを増やすことで鉄の種子への輸送能力を高めている。こちらの方法では白米中の鉄濃度が3倍に増加していた。ニコチアナミン合成酵素遺伝子は、アルカリ性土壌でも鉄イオンを吸収して生育できるイネやトウモロコシの開発にも利用されている。
フィターゼ生産作物
フィチン酸(phytateは種子などの多くの植物組織に存在する植物における主要なリン酸の貯蔵形態である。フィチン酸はキレート作用が強く、多くの金属イオンを強く結合し、特にフィチン (phytin: 不溶性のフィチン酸の金属塩)の形で多く存在する。フィチン酸のリン酸残基は、非反芻動物ではフィチン酸加水分解酵素であるフィターゼがほとんどないため、消化・吸収されにくい。非反芻動物由来の糞便中から未分解のフィチン酸が環境に放出されると環境中で分解されてリン酸が遊離して水圏の富栄養化を招くこととなる。一方、ウシなどの反芻動物はルーメン(反芻胃)内の微生物によって作られるフィターゼが加水分解するためフィチン酸由来のリン酸を利用できる。
現在、フィチン酸由来のリン酸やフィチンとして不溶化されているミネラルの吸収を増す目的で非反芻動物の飼料には、微生物由来のフィターゼを添加することがある。そこで、フィターゼを飼料に添加しなくてもよいように糸状菌や大腸菌のフィターゼの遺伝子をトウモロコシやダイズで発現させてフィチン酸のリン酸の有効利用率を高める試みが行われた。更に、フィターゼ生産トウモロコシをニワトリに給餌してフィチン酸由来のリン酸の有効利用率が上昇していることが確かめられた。
その他、フィチン酸は金属イオンに対するキレート活性が高いためフィチン酸によって鉄の吸収が阻害されるが、鉄貯蔵タンパク質であるフェリチン(ferritin)とフィターゼを共に生産させたトウモロコシでは鉄分の有効利用率が有意に上昇していたという報告もある。
貯蔵デンプンの改質
デンプンは、グルコースのポリマーで、直鎖構造のアミロースと枝分かれ構造をもつアミロペクチンから構成されている。アミロースとアミロペクチンの分子量や含量や枝分かれ頻度によって物性が異なる。デンプンは植物のプラスチドで生合成され、特にデンプン合成が盛んでデンプンを貯蔵しているプラスチドをアミロプラストとよぶ。細胞質からプラスチドに輸送されたグルコース-1-リン酸やグルコース-6-リン酸やADP-グルコースはプラスチド中で最終的にADP-グルコースとなり、ADP-グルコースのグルコース残基はデンプン合成酵素によって伸長中のアミロースやアミロペクチンの非還元末端のグルコース残基の4位の水酸基と脱水縮合して新たなα-1,4グルコシド結合を形成して取り込まれる。プラスチド中のデンプン合成酵素はデンプン粒結合型デンプン合成酵素 (GBSS: granule-bound starch synthase)と可溶性デンプン合成酵素(SSS: soluble starch synthase)に大別される。GBSSはアミロースの生合成に関与している。SSSによって合成途中のα-1,4グルコシド結合のグルコース残基の直鎖が、枝分かれ酵素によって一部切断され、その切断されて生じた還元末端のグルコース残基の1位の水酸基と直鎖部分の中間のグルコース残基の6位の水酸基の間でα-1,6グルコシド結合が生じる。こうして生じた分子中に存在する複数の非還元末端はSSSによって伸長するとともに枝分かれ酵素によって新たに非還元末端の側鎖が次々と形成される。一方、余分なα-1,6グルコシド結合部分は枝切り酵素によって切断され側鎖は整理されて、アミロペクチンは合成される。つまり、アミロースとアミロペクチンの含量はGBSSとSSSの活性によって制御されている。よって、GBSSが欠損していればアミロペクチンのみを含むモチ性となり、SSSの活性が低下していると高アミロース含量となる。そこで遺伝子操作によってGBSSやSSSの生産量を制御して、デンプン組成を改変できるようになった。
GBSS生産量が抑制されてモチ性に変換された"Amflora"と名付けられたジャガイモ品種(EH92-527-1系統)が既にBASFによって開発され、チェコ、スウェーデン、ドイツで商業栽培されている。
キャッサバ中のシアン化合物の削減
キャッサバ (Manihot esculenta) は熱帯における重要な作物である。ただし、タンパク質含量が少なく、かつ、有毒なシアン化合物である青酸配糖体を多く含んでいる。含まれる青酸配糖体のうち、95%はリナマリンで、5%はロトストラリンである。キャッサバを食料や飼料にするためには青酸配糖体や分解産物であるアセトンシアノヒドリンの除去が重要であり、不十分だと健康被害が生じることがある。そこでキャッサバ中のシアン化合物を減少させるための研究が進められている。その一つにはヒドロキシニトリル脱離酵素 をキャッサバの根で生産させるというものがある。ヒドロキシニトリル脱離酵素はアセトンシアノヒドリンを青酸とアセトンに分解する酵素である。ヒドロキシニトリル脱離酵素によって生じた青酸は気化するため、ヒドロキシニトリル脱離酵素活性とキャッサバ中の青酸化合物の濃度との間には負の相関性がある。野生型のキャッサバの根ではほとんど生産されていないヒドロキシニトリル脱離酵素を根で過剰生産させた結果、形質転換体では根でリナマリン含量が80%低下すると共にタンパク質含量が3倍に増加していた。
ワタ子実中のゴシポールの削減
ワタ(Gossypium hirsutum)の種子約1. 65 kg当たり、ワタ繊維1 kgが生産される。ワタの種子は21%の油脂とともに23%の高品質のタンパク質を含んでいる。しかし、ワタの種子自体や脱脂種子は反芻動物の飼料として利用されているが、食料としても単胃動物の飼料としても利用されていない。心機能と肝機能を障害するゴシポールが腺に含まれているからである。ゴシポールはセスキテルペンの一種である。そこで、棉実を食料、飼料として利用するために、腺を持たない変異ワタが発見されたのでそれを用いて腺欠損品種の育種がすすめられ、上市された。しかし、腺欠損品種は害虫抵抗性に関与しているテルペノイドを欠くため、極めて虫害に遭いやすいので農民に拒否された。そこで種子でのみゴシポールが削減された品種の開発を目的として、ゴシポールの前駆体であるδ-カディニンをファルネシルピロリン酸から合成する酵素であるδ-カディニン合成酵素を、ワタの種子特異的α-globulin Bの遺伝子のプロモーターを用い、RNAiで抑制した形質転換ワタが開発された。この形質転換植物の種子と若い芽生えにおいてのみゴシポールや関連物質の含量が低下しており、他の地上部や根では含量の変化はなかった。つまり、害虫抵抗性は大きくは変化せず、また、この形質は多世代にわたり安定に遺伝していた。
アクリルアミド生成量の少ないジャガイモ
デンプンなどの糖類とアスパラギンが共存しているもの、穀類など、を加熱すると様々な毒性を持つアクリルアミドが生成する。特にフライドポテトなどが問題視されている。そこでアクリルアミド生成量を減らすために遊離アスパラギン含量の少ないジャガイモの開発が行われている。 ジャガイモにはアスパラギン合成酵素としてStAst1とStAst2の二種類が知られている。まず初めにStAst1とStAst2の遺伝子StAst1とStAst2の双方を根茎特異的に抑制した形質転換ジャガイモが開発された。温室での形質転換ジャガイモの生育や根茎の収量は野生型のものと遜色がなく、その根茎中の遊離アスパラギン含量は野生型のものの1/20程度であった。ところが、その形質転換体を圃場試験したところ、植物体の生育は悪く、根茎はいびつで収量は低かった。そこで、解析を進めた結果、StAst1は根茎で主に、StAst2は緑色組織で主に発現していることがわかった。そのため、StAst1を根茎特異的に抑制したところ、圃場試験においても生育や収量が正常で、遊離アスパラギン含量が少ない、つまり、加熱してもアクリルアミド生成量の少ない形質転換ジャガイモが得られた。
そしてAsn1 (StAst1と同じ)をRNAiによって抑制して遊離アスパラギンを減少させ、ホスホリラーゼとデンプン関連タンパク質であるR1をRNAiによって抑制してデンプンから還元糖への変換を抑えて、両者の効果によって加熱によるアクリルアミドの生成を減少させたジャガイモがInnateという商標で2015年3月20日にアメリカ食品医薬品局(FDA)によって認可された[24]。なお、Innateにおいては傷や切断による褐変を防ぐために、ポリフェノール・オキシダーゼの遺伝子Ppo5をRNAiによって抑制してされている[25]。
涙の出ないタマネギ
涙の出ないタマネギを参照。
褐変しにくいリンゴ
リンゴの果実を切断すると、果実の切断面が褐変することが知られている。これは果実の細胞の液胞中のクロロゲン酸やエピカテキンなどのポリフェノールがプラスチド中のポリフェノールオキシダーゼ(PPO: polyphenol oxidase)と細胞の損傷によって接触して、酸化重合されて分子中の共役二重結合が伸び、長波長の光まで吸収することが原因である。そこで、リンゴの果実の褐変を押さえるために4種類のPPOの遺伝子 PPO2, GPO3, APO5, pSR7のそれぞれ394, 457, 457, 453 塩基対のDNA断片を利用したRNAiによってPPO活性が抑制されたリンゴが開発された[26]。リンゴの品種Golden DeliciousとGranny Smithにおいて実用化され、Artic appleの商標で2015年3月20日にアメリカのFDAによって認可された[27]。
作製法
概説
遺伝子組換え植物を作製する上で、植物のホスト(宿主)・ベクター系 (host-vector system) が必要とされる。そのホスト・ベクター系を構築する上で以下の4種類の系が必要とされる。
- 植物細胞への遺伝子の導入系(導入系)
- 遺伝子の組換わった細胞(形質転換細胞)だけを選択するための系(選択系)
- 導入した遺伝子を複製させ、細胞分裂後にも伝達させるための系(複製系)
- 単一の細胞から植物個体まで再生させるための系(分化・再生系)
これらについて以下の節で簡単に説明する。
なお、外来遺伝子の導入場所として、細胞の核ゲノムだけではなく、プラスチド・ゲノムもある。プラスチド・ゲノムに導入して形質を変えることをプラスチド形質転換(plastid transformation)という。
また、遺伝子組換え食品反対派からの反対理由の一つであった「医療用、家畜用抗生物質耐性遺伝子の選択マーカー遺伝子としての利用」を回避するために用いられている、「新しい選択マーカー遺伝子と選択マーカー遺伝子の除去系の利用」についても述べる。
さらに、反対理由の一つである「ゲノムの特定の場所を狙って遺伝子を導入できない」という問題を解決するためにジーン・ターゲッティングの技法が導入されていることについても紹介する。また、導入された遺伝子の利用を制限する遺伝的利用制限技術についても解説する。
その他、遺伝子組換え作物の作製法とは直接関係ないが、それが商品化され一般の圃場で栽培されるために要求されている「環境に対する影響」と「食品としての安全性」を評価する安全性審査についても述べる。
導入系
導入系とは、目的とする遺伝子を細胞の遺伝子が発現する場所に導入するための系である。遺伝子を導入・発現させるための植物細胞内の小器官として、現在、核とプラスチド(plastid)が標的となっている。導入系にはいろいろな手法があるが、現在の主要な方法は、パーティクル・ガン法とアグロバクテリウム法であり、それぞれについて簡単に説明する。
その他にも、DNAを含んだ等張液中のプロトプラストに高電圧の電気パルスを与えて細胞膜に短時間だけ穴を開けて等張液中のDNAを細胞内に導入させるエレクトロポレーション法があるが、その操作の煩雑さと効率の低さとイネへのアグロバクテリウム法の適用が可能になったことにより、現在ではほとんど利用されていない。また、最近、使用例が増えてきたウィスカー(whisker)法がある。
パーティクル・ガン法
ウィスカー法
ウィスカーとは、髭状の強度の高い単結晶であり、マイクロ試験管中で植物組織やカルスと滅菌処理されたウィスカーとDNAを含む溶液を激しく攪拌し、ウィスカーによって傷ついた細胞内に溶液中のDNAが侵入し取り込まれるようにする。組織やカルスを洗浄後、固体選択培地にて形質転換体を選択し増殖させる。使用されるウィスカーとしてシリコンカーバイドよりホウ酸アルミニウム(2B2O3・9Al2O3)のものが安全性の面から好まれる。植物の形質転換操作手順は、植物組織とウィスカーをDNAを含む溶液中で激しく撹拌、洗浄し、その後は、後述の「パーティクル・ガン法による手順」の4.以降と同様である。
アグロバクテリウム法
Agrobacterium tumefaciens(正式名称 Rhizobium radiobacter)が主に用いられている。自然界ではA. tumefaciensは、双子葉植物を宿主としてクラウンゴール(crown gallまたはcrowngall)という腫瘍を形成させ、それをA. tumefaciensは資化できるが植物は資化できないオパイン(またはオピン: opine)という特殊なイミノ酸を生産する工場としている。これを生物学的植民地化という。これはA. tumefaciensに含まれるTi (tumor inducing) plasmidのT-DNA (transferred DNA)が植物細胞の核ゲノムに導入されたことによって生じる。そこで、このDNA導入機構を利用して植物への遺伝子導入方法として中間ベクター法とバイナリーベクター法(binary vector)が開発された。そのうち、現在はバイナリー・ベクター法が主流である。これは、Ti plasmidの本来のT-DNAを除去されたvir helper Ti plasmidと、大腸菌とA. tumefaciensの双方で利用できる小型のシャトル・ベクター(shuttle vector)に人工のT-DNAを付与したものとで構築されている。vir helper Ti plasmidには、本来のT-DNAが存在しないため、植物にクラウンゴール(腫瘍)を形成できないが、T-DNAを植物ゲノムに導入するために必要なvir領域が存在しているため、他のプラスミド上に存在する人工T-DNAを植物に導入できる。このように同一のDNA上に存在しなくても、作用しあえる遺伝子間の関係をトランスという。以下に、バイナリー・ベクター法を簡単に説明する。
A. tumefaciensに存在するTi plasmidは巨大プラスミドであり、これをA. tumefaciensから直接単離し試験管内で操作することは困難である。一方、Ti plasmid上にはvir領域という、T-DNAを植物ゲノムに導入するために必要な遺伝子群が存在するので、Ti plasmidは植物への遺伝子導入には必要である。しかし、本来のT-DNAは植物を腫瘍化するので不要である。そこで、本来のT-DNAを欠損したがvir領域を保持したままのvir helper Ti plasmidとそれを保持するA. tumefaciensの菌株が開発された。A. tumefaciensの染色体上にも植物への遺伝子導入に必要とされる遺伝子群(chv genes: chromosomal virulence genes)が存在するために、更にTi plasmidの宿主としてもA. tumefaciensはアグロバクテリウム法において必要とされる。
T-DNAの両末端にはRB(right border:右境界配列)とLB(left border:左境界配列)という短い配列が存在している。RBとLBに挟まれた配列が植物に導入され、その間の配列には特異性がない。つまり、植物に導入したい遺伝子や形質転換植物を選択するための選択マーカー遺伝子をRBとLBに挟みこめば、任意の人工のT-DNAを構築できる。
更に、vir領域とT-DNAとの作用関係はトランスであり、両者が同一のプラスミド上に存在している必要が無い。そこで、操作しやすい小型のシャトル・ベクターに人工のT-DNAを付与したT-DNAプラスミドを試験管内で改変した後に大腸菌を用いて増幅させる。その後、T-DNAプラスミドをA. tumefaciensへ導入して、A. tumefaciens内でvir helper Ti plasmidと共存させて植物に人工のT-DNAを導入させる。この小型のシャトル・ベクターであるT-DNAプラスミドは、大腸菌での複製開始点と広範囲のグラム陰性菌の間での複製可能な複製開始点が存在する広宿主域ベクターであり、また、人工のT-DNA部分内に存在する植物の形質転換の選択に用いられる選択マーカー遺伝子以外にも、大腸菌とA. tumefaciensの形質転換体の選択に必要な選択マーカー遺伝子を別に保持している。
A. tumefaciensの本来の宿主は双子葉植物であるが、vir領域の転写を誘導するフェノール系物質アセトシリンゴン(acetosyringone)の利用やvir領域の転写活性が恒常的に高いhypervirulent helper Ti plasmidの開発により、イネなどの単子葉植物や真菌類などへの応用が可能となってきている。
アグロバクテリウム法は、パーティクル・ガン法に比べ高価な機材は必要なく、また、ランニングコストも低い。T-DNAは植物の核ゲノムに1〜2コピー程度の低コピー数で導入されることが多い。一方、アグロバクテリウムの感染後に抗生物質を用いてアグロバクテリウムを除去するなどの煩雑な操作が必要であり、アグロバクテリウムの感染効率も材料の種類や状態によって様々に変化する。
選択系
多数の細胞を材料として、それらに遺伝子導入を試みても、それらの中から極少数の形質転換体しか得られないことが多い。そのため、形質転換体のみを特異的に選択する選択マーカー遺伝子を目的遺伝子以外に同時に導入する必要がある。選択マーカー遺伝子の性質としては、形質転換細胞のみが生存・増殖できるポジティブ選択可能であり、更に形質転換細胞と非形質転換細胞とが混在しあったキメラ(chimera)を形成しにくいことが望ましい。多くの場合、アミノグリコシド系抗生物質のカナマイシン(kanamycin)やG418やハイグロマイシンB(hygromycin B)などの耐性遺伝子が遺伝子組換え作物にも用いられてきたが、現在では後述の新しい選択マーカー遺伝子やマーカー除去の技術が用いられるようになった。
複製系
導入された遺伝子が植物細胞の細胞分裂にあわせて複製されなくては、一過性の遺伝子発現(transient gene expression)となって、安定した形質転換植物を得ることができない。そこで外来遺伝子の複製系が必要となる。現在、植物の場合は外来遺伝子が植物の核ゲノムに挿入されて、核ゲノムの複製にあわせて一緒に複製される様にすることが主流である。また、プラスチドのDNAに外来遺伝子を相同組換えによって導入する系も存在する。
分化・再生系
外来遺伝子が導入された単一の形質転換細胞より植物個体を分化・再生する系である。上記の三つの系は効率の高低はあるがほぼ共通の手法を用いることができる。しかし、この系は、植物のホスト・ベクター系を構築する上で、この系が確立すればその植物の形質転換植物個体がえられるのとほぼ同じ意味を持つほど重要なものである。多くの場合、オーキシンやサイトカイニンなどの植物ホルモンの濃度比を変えることによって植物個体を再生させている。しかし、材料の状態や培養開始からの時間や材料の成熟度などによって大きく変化する。多くの場合、カルスを経てカルスからシュートが分化してくる。そのシュートを発根培地に植え継いでから馴化して鉢上げする。なお、シロイヌナズナ(アラビドプシス: Arabidopsis thaliana)やその近縁のストレス耐性の強いThellungiella halophila (salt cress)などにおいては、未熟な花蕾をアグロバクテリウム懸濁液につけるフローラル・ディップ(floral dip)法や、花蕾にアグロバクテリウム懸濁液を噴霧したりするフローラル・スプレー(floral spray)法が用いられており、それらの処理後に植物体より得られた種子を選択培地上に置床し発芽させ、その中から形質転換体を選択している。つまり、もともと分化能を持つ種子を発芽させて選択するだけなので人為的な再生系は必要とされない。フローラル・ディップ法やフローラル・スプレー法を適用できる植物はまだ少数ではあるが、適用できれば形質転換植物を得る操作が極めて簡便化される。
その他、カルスなどの未分化な状態での形質転換植物を培養することが目的の場合には、分化・再生系は必要とされない。
植物の形質転換操作手順
パーティクル・ガン法による手順
パーティクル・ガン法による一般的な形質転換植物を得る操作手順の例を簡単に示す。
- 植物に導入したい遺伝子と選択マーカー遺伝子が存在するDNA溶液とよく懸濁した金の微粒子とを混和してエタノール沈殿を行う。
- 遠心分離により回収されたDNAでコートされた金の微粒子を風乾し、パーティクル・ガンにセットする。
- 無菌的植物もしくは滅菌した植物の葉の断片や茎の断片などの組織片をシャーレの中の固体培地上に置床してパーティクル・ガンにセットしてから、金の微粒子を打ち込む。
- 植物組織をカルスを誘導する植物ホルモンも含む選択培地に植え継ぎ、選択培地上で増殖するカルスを選択する。
- 増殖したカルスをシュート分化用の植物ホルモンも含む選択培地に植え継ぎ、シュートを分化させる。
- カルスからシュートを切除して、シュートを発根用の選択培地に植え継ぎ、発根した後に鉢上げして馴化する。
- カルスが形成された後の各段階で遺伝子の導入を確認する。
アグロバクテリウム法による手順
バイナリー・ベクターを用いたアグロバクテリウム法による一般的な形質転換植物を得る操作手順の例を簡単に示す。
- 小型プラスミドのシャトル・ベクター上のT-DNA部分に目的遺伝子を挿入する。T-DNA部分には選択マーカー遺伝子も含まれている。
- 組換わったプラスミドを大腸菌に導入して、大腸菌中で増やしてから回収し、挿入遺伝子を確認する。
- 回収したプラスミドを電気穿孔(エレクトロポレーション: electroporation)法や三親接合伝達法などを利用してvir helper Ti plasmidを含むA. tumefaciensへ導入する。その際、シャトル・ベクター上のバクテリアでの選択マーカー遺伝子を利用してシャトル・ベクターが導入されたA. tumefaciensを選択する。
- 選択したA. tumefaciensを液体培地で増殖させて集菌し、共存培養培地に懸濁する。
- 無菌的植物もしくは滅菌した植物の葉の断片や茎の断片などの組織片をシャーレの中に移し、A. tumefaciensと共存培養する。この際に、アセトシリンゴンなどを添加すると感染効率が上昇する。
- 共存培養が終わった植物組織片をカルスを誘導する植物ホルモンも含む選択培地に植え継ぎ、選択培地上で増殖するカルスを選択する。この培地には、A. tumefaciensを除菌するためのカルベニシリンやセフォタキシムなどの植物には影響が少なく、アグロバクテリウムには強く作用する抗生物質が含まれている。
- 増殖したカルスをシュート分化用の植物ホルモンと除菌用抗生物質も含む選択培地に植え継ぎ、シュートを分化させる。
- シュートを切除して、除菌用抗生物質も含む発根用の選択培地に植え継ぎ、発根した後に鉢上げして馴化する。
- カルスが形成された後の植物体の各段階で遺伝子の導入とA. tumefaciensの除去を確認する。
プラスチド形質転換
プラスチド形質転換(plastid transformation)とは、植物細胞の核ゲノムにではなく、プラスチド・ゲノムに外来DNAを導入して形質を変えることである。プラスチドには、プラスチド・ゲノムが複数個存在し、更に細胞中にプラスチドが多数存在するため、細胞当たり数千コピーのプラスチド・ゲノムが存在することもある。そのため、大規模な遺伝子量効果(gene dosage effect)を期待でき、核ゲノムに外来遺伝子を導入してタンパク質を生産させるよりも遥かに多量の目的タンパク質を生産させることが可能となる場合がある。また、プラスチドの転写・翻訳機構は原核生物型なので、複数の外来遺伝子を単一のポリシストロニック・オペロン(polycistronic operon)として導入可能である。
プラスチド形質転換における遺伝子導入系として、パーティクル・ガン法が用いられている。導入されたDNA断片は相同組換えによるプラスチド・ゲノムとの遺伝子置換によってプラスチド・ゲノムに組み込まれ、プラスチド・ゲノムの複製に合わせて複製される。そのため、プラスチド形質転換には、外来DNAが組み込まれても影響の少ない、プラスチド・ゲノムの一部が、事前に単離されている必要がある。つまり、植物種やプラスチド・ゲノムの種類毎に導入するために必要なベクターが異なることになる。具体的には、単離されたプラスチド・ゲノムの一部の中で外来DNAが挿入されても影響の少ない部位に選択マーカー遺伝子と共に目的遺伝子のカセットが挿入されたDNAを調製する。これがパーティクル・ガン法で植物細胞に導入されるとカセットの両側の配列とプラスチド・ゲノムのそれらとの相同配列間の二カ所で相同組換えが低頻度で生じ、遺伝子置換によって外来DNAがプラスチド・ゲノムに挿入される。この組換え型のプラスチド・ゲノムを選択的に増幅させるための選択系が必要になる。遺伝子置換されたプラスチド・ゲノムはプラスチド中で野生型のプラスチド・ゲノムと混在した状態(ヘテロプラスミー: heteroplasmy)であるが、選択を繰り返していく間にそのプラスチドに含まれるゲノムDNAが全て組換え型になった状態となり、更にその細胞中に含まれるプラスチド全体が組換え型になる(ホモプラスミー: homoplasmy)ことが期待される。プラスチド形質転換において細胞中の全プラスチドを組換え型のホモプラスミーにするためには細胞の選択を長期間続ける必要がある。そのため、プラスチド形質転換植物を得るために必要な時間は、核ゲノムに外来遺伝子を導入して形質転換植物を得るよりも長くなる傾向がある。
プラスチド形質転換の選択系として、スペクチノマイシン(spectinomycin)と、大腸菌のトランスポゾンであるTn7由来のスペクチノマイシン耐性遺伝子aadAが用いられることが多い。
新しい選択マーカー遺伝子と選択マーカー遺伝子の除去系の利用
医療用、畜産用の抗生物質に対する耐性マーカー遺伝子の利用制限
現在の遺伝子組換え手法において、多数の細胞を材料としてその中から極少数の形質転換細胞を選択する操作が用いられることが多い。そのため、形質転換細胞を選択するための選択マーカー遺伝子の発現を指標として形質転換体を選択している。この植物の選択マーカー遺伝子は組換え作物においてもカナマイシン(kanamycin)などのアミノグリコシド(aminoglycoside)系抗生物質に耐性を与える遺伝子が用いられることが多かった。そこに、社会政策的な問題が形質転換植物の選択系にも影響をおよぼした。EUは2004年末をもって医療用、家畜用に用いられる抗生物質に対する耐性遺伝子で形質転換植物細胞の選択を禁止した。そして、今後、EUで販売される遺伝子組換え植物や食品は他の選択マーカー遺伝子が用いられているか、選択マーカー遺伝子が除去されていなくてはならないとした(European Parliament 2001)。形質転換植物の選択マーカー遺伝子は基本的には形質転換体の選択という育種の極初期に用いられるに過ぎない。
しかし、遺伝子組換え食品反対派は、組換え作物が持つカナマイシン耐性遺伝子(NPTII: aminoglycoside (neomycin) phosphotransferase遺伝子) やハイグロマイシンB耐性遺伝子(hpt: hygromycin phosphotransferase遺伝子)などの抗生物質耐性遺伝子が腸内細菌に極低い頻度であっても取り込まれる可能性があるとし、これを批判の根拠の一つとしていた。そこで、除草剤として用いられているビアラホス(bialaphos: phosphinothricinとなって作用)の様な農業用抗生物質や医療用・畜産用にほとんど用いられていない抗生物質を除いて、医療用・畜産用抗生物に対する耐性遺伝子を選択マーカーとして利用することを規制したわけである。その結果、新たな選択マーカー遺伝子を利用した選択系が用いられるようになった。更に、初めの選択では抗生物質耐性遺伝子を選択マーカー遺伝子として利用するが、後にその抗生物質耐性遺伝子を欠失させる手法が開発された。ただし、カナマイシン耐性を付与する遺伝子nptIIは、自然界に広く広がって存在しており、カナマイシン自体が医薬としての使用が極希か、もしくは使用されていないという理由で規制外となっている[28]。
なお、EUの予算によって設立・運営されている独立機関であるEuropean Food Safety Authority (EFSA)は、"EFSA evaluates antibiotic resistance marker genes in GM plants" (News Story 11 June 2009)において、"In their joint opinion, the GMO and BIOHAZ Panels concluded that transfers of ARMG (antibiotic resistance marker genes) from GM plants to bacteria have not been shown to occur either in natural conditions or in the laboratory."とあるように遺伝子組換え植物からバクテリアへの抗生物質耐性マーカー遺伝子の移行を自然条件下でも実験室でも観察できなかったと発表している。
抗生物質耐性以外の新たな選択マーカー遺伝子
新たな選択マーカー遺伝子の中には、植物の利用できない炭素源を資化または解毒できるようにするものがある。
- D-amino acid oxidase (DAAO)
- DAAO(EC 1.4.3.3, 反応)は赤色酵母Rhodotorula gracilis由来のDAO1にコードされているものを利用。多くのD-アミノ酸(D-amino acids)をα-ケト酸(α-keto acids: 2-オキソ酸(2-oxo acids))に変換できる。D-アラニン(D-Ala), D-セリン(D-Ser)は毒性を持ち、DAAOによって解毒されるため、形質転換体をpositive selectionできる。(D-Alaからピルビン酸(pyruvate), D-Serから3-ヒドロキシピルビン酸(3-hydroxy pyruvate)へ解毒、α位の炭素の光学活性が無くなる。)。D-イソロイシン(D-Ile), D-バリン(D-Val)の毒性は低いが、それらのα-ケト酸は毒性を持つ。そのため、部位特異的な組換えによりDAO1が形質転換体から除去された組換え体をnegative selection可能である。また、後述のcotransformationにおいては、この酵素遺伝子だけを選択マーカー遺伝子として用いても培地に加えるD-アミノ酸を変えるだけでpositive selectionもnegative selectionもを行える。
- phosphomannose isomerase (PMI)
- フルクトース-6-リン酸は解糖系の中間代謝物であり、マンノース-6-リン酸をフルクトース-6-リン酸へ変換できれば、唯一の炭素源として資化し生育できることになる。多くの植物はPMI(EC 5.3.1.8, 反応)を所持せず、マンノース-6-リン酸をフルクトース-6-リン酸へ変換できない。そのため、マンノース(mannose)を選択培地中の唯一の炭素源とした場合、植物はマンノースを資化できないが、大腸菌Escherichia coli由来のPMI遺伝子pmiを導入された形質転換体はマンノースを解糖系へ導入できるため、生育可能となる。なお、培地から取り込まれたマンノースは植物のヘキソース・キナーゼ(hexose kinase)(ヘキソキナーゼ: hexokinaseとも記述される: EC 2.7.1.1 (反応), EC 2.7.1.2 (反応))によってマンノース-6-リン酸へ変換される。
- 2-deoxyglucose 6-phosphate phosphatase
- 2-deoxyglucose (2DOG)はグルコースの2位の炭素の水酸基が水素原子に置換されたグルコースのアナログである。2DOGはヘキソース・キナーゼによって6位の炭素の水酸基がリン酸化され、2-deoxyglucose 6-phosphateになるが、それ以上解糖系の酵素の基質とはならない。多くの植物にとって、2DOGは解糖系の阻害剤であり、細胞の成長を阻害する。そこで、2DOG耐性の酵母から2-deoxyglucose 6-phosphate phosphataseの遺伝子を単離し、植物で発現させたところ、2DOG耐性となった。
- D-arabitol 4-dehydrogenase
- D-arabitol 4-dehydrogenase(EC 1.1.1.11, 反応)により植物にアラビトール(D-arabitol)資化能を導入する。
- phosphite oxidoreductase
- phosphite oxidoreductase(EC 1.20.1.1, 反応)は亜リン酸をリン酸へ酸化できる。植物は亜リン酸をリン源として利用できないため、リン源として亜リン酸のみが存在する場合は生育できない。しかし、バクテリア由来のphosphite oxidoreductaseの遺伝子を導入された形質転換細胞や形質転換植物は生育できることを利用した選択系である。亜リン酸は安価であるため、安価に形質転換体を選択できる。更に、リン酸を含まず亜リン酸を含む培養土で、形質転換体と非形質転換体の種子が混在しているものから形質転換植物体だけを選択可能である。
選択マーカー遺伝子の除去系
その他、選択マーカー遺伝子を除去する系を利用するものもある。
- cotransformation
- 抗生物質耐性などの選択マーカー遺伝子と目的遺伝子を別々のDNA断片として導入して、選択マーカー遺伝子で選択した形質転換体の中から目的遺伝子と選択マーカー遺伝子が植物細胞のゲノムの別々の部位に組み込まれたものを選択して、後代をとり目的遺伝子を持つが選択遺伝子を持たないものを選択するというもの。外来遺伝子を取り込む能力を持つコンピテントセル(competent cell)が限られていることを利用する手法である。この手法には、後代をとるという過程が含まれているため、この手法の果樹や林木などのヘテロ接合性の強い植物種に対する適用は限定的になってしまう。つまり、各遺伝子座のヘテロ接合性が強いと、たとえ自家受粉であったとしても親品種とは全く異なった形質が後代に現れてしまうため、親品種の品種改良や遺伝子解析という目的を果たすことが困難になるからである。なお、イネやダイズなど自家受粉を繰り返した結果、ホモ接合性が強い作物であれば、後代をとってもゲノムの遺伝子構成は親品種とほとんど変わらないため、問題は出にくい。
- MAT vector法
- 日本製紙株式会社の開発したMulti-Auto-Transformationの略である。いろいろなタイプがあるが、サイトカイニン(cytokinin)合成遺伝子(iptZ)と耐塩性酵母である醤油酵母Zygosaccharomyces rouxiiの内在性プラスミドpSR1の部位特異的組換え酵素とその標的配列を順方向反復配列(direct repeats)として利用しているものの説明をする。植物ホルモンの一種であるサイトカイニンは頂芽優勢を打破するために、サイトカイニンが多いと側芽が次々伸びて多芽体を植物は形成する。iptZと部位特異的組換え酵素遺伝子を標的配列の順方向反復配列で囲み、その外側に目的遺伝子を配置したDNA(「目的遺伝子+ 反復配列 + iptZ + 部位特異的組換え酵素遺伝子 + 反復配列」カセット)を植物細胞に導入すると、サイトカイニンが過剰生産され、多芽体が形成される。その中から、部位特異的組換え酵素遺伝子が標的配列の順方向反復配列に作用してiptZと部位特異的組換え酵素遺伝子が除去され、目的遺伝子が残ったもの(「目的遺伝子+ 反復配列」カセット)を保持するシュートが正常な頂芽優勢を示す表現型のものとして得られる。それを目的遺伝子のみを所持するものか検定して、確認する。
- Cre-loxP system
- バクテリオファージP1の部位特異的組換え酵素であるCreとその標的配列loxP (5'-ATAACTTCGTATAGCATACATTATACGAAGTTAT-3')を2つ順方向反復配列として用いて、loxP の順方向反復配列間の選択マーカー遺伝子を含む配列を特異的に除去する系を利用したものである。(基本原理等についてはCre-loxP部位特異的組換えを参照すること。)Cre-loxP systemを用いた手法にはいくつかのものがあり、そのうちの2つを紹介する。まず1つめは交配を利用したものである。導入したい目的遺伝子はloxPの順方向反復配列の外側に、選択マーカー遺伝子はloxPの順方向反復配列の内側に配置して、「目的遺伝子+ loxP + 選択マーカー遺伝子 + loxP」カセットを作製し、それを植物に導入して形質転換植物をつくる。次に、それとCreを生産するようにcre遺伝子が導入された形質転換植物と交配して、「目的遺伝子+ loxP + 選択マーカー遺伝子 + loxP」カセットと「cre遺伝子」カセットの双方を持つ後代を得る。その後代の細胞の中には、loxP 間で組換えが生じた結果、選択マーカー遺伝子部分がループアウトして除去され残された「目的遺伝子+ loxP」カセットと「cre遺伝子」カセットの双方を持つようになった細胞が現れる。そこで、その交配株から後代を得て、その中から「cre遺伝子」カセットを持たないが「目的遺伝子+ loxP」カセットのみを持つものを選択すると選択マーカー遺伝子が除去された個体が得られる。2つめは特異的化合物誘導性プロモーターを利用したものである。「目的遺伝子+ loxP + 選択マーカー遺伝子 + 特異的化合物誘導性プロモーター+ cre + loxP」カセットを作製し植物体に導入する。特異的化合物誘導性プロモーターとして植物が通常は接することのないテトラサイクリンやエストラジオールや糖質コルチコイドなどで誘導されるものを利用した場合、それらの化合物で形質転換体を処理するとloxP間で組換えが生じて「目的遺伝子+ loxP」となったものが得られる。
新技術(ジーン・ターゲッティング)の導入
その他、現在、ジーン・ターゲッティング法を用いて遺伝子置換を植物に応用する試みが進んでいる。植物は相同組換え活性が低く、内在性の遺伝子と配列類似性が高いDNA断片を導入しても内在性の遺伝子と殆ど相同組換えを起こさず、非相同組換えによって標的以外に組み込まれるものが大部分である。そこで様々な工夫が必要となる。
ALS遺伝子の特異的置換
ひとつの例が、pyrimidinyl carboxy系除草剤であるbispyribacへの耐性を示すイネの開発である。前記の「除草剤耐性作物」の小節で述べたsulfonylurea系除草剤と同様に、この除草剤は分岐鎖アミノ酸(branched chain amino acids, BCAA)生合成系の酵素の一種であるacetolactate synthase (ALS)の阻害剤である。イネのある変異体は、ALSの2カ所のアミノ酸残基の変異によってbispyribacに対して高度に耐性を示す。そこで、非相同組換えによる耐性形質転換体を除去するためにpromoterとALSのN(アミノ)末端側の配列を欠失したイネ由来の変異型ALSをイネに導入して耐性になった相同組換えによる遺伝子置換体を単離した。そのhomo接合体は著しくbispyribacに対して耐性となっていた。
この過程で変異型ALSのpromoterとALSのN末端側の配列を欠失したものを用いているのは重要である。promoterとALSのN末端側の配列を含む完全な変異型ALSを用いればゲノムの本来のALS以外のところに非相同組換えによって挿入されてもbispyribac耐性になってしまう。また、promoterのみを除去し開始コドンから完全な変異型ALSのタンパク質コード領域(翻訳領域、ORF)を含んでいるものを用いれば、ほとんどの非相同組換えによるbispyribac耐性株を除去できるはずであるが、T-DNA taggingに用いられているようにAgrobacterium(アグロバクテリウム)法ではT-DNAはかなりの高頻度で転写活性の高い領域に挿入されるため、何らかの遺伝子のpromoter下流に挿入され、その転写方向と挿入断片のセンス鎖方向が一致すればbispyribac耐性株が生じる可能性がある。そこで、promoterとN末端側の配列を欠失したものを用いれば、非相同組換えによるbispyribac耐性形質転換体によるバックグラウンドをほぼ排除できるわけである。
この遺伝子置換体は基本的に標的となったALSの配列のみが野生型と一部異なるだけであり、他の選択マーカー遺伝子が存在しないため、突然変異により育種されたものと区別がつかない。このことは遺伝子組換え食品の実質的同等性を確保する上で大きな意味を持つ。
任意の遺伝子の特異的置換や遺伝子破壊
また、変異型ALSのようなそれ自体が選択マーカーとなる遺伝子だけでなく、任意の遺伝子を遺伝子置換により遺伝子破壊する方法が開発された。これらの方法はゲノム編集の手法の一部である。非相同組換えが生じやすい生物種において、相同組換えによる遺伝子置換体を得るための方法は大きく二つに分けられる。一つは、非相同組換え体は死滅するが、相同組換えによる遺伝子置換体は生存できるようにして遺伝子置換体を濃縮する方法である。もう一つの方法は、配列特異的に相同組換え効率を向上させる方法である。
前者の方法として、diphtheria toxinの遺伝子を利用しているものがある。これは、diphtheria toxinが真核生物の細胞質の蛋白質合成を阻害するため、diphtheria toxinを生産する真核細胞が死滅することを利用している。Agrobacterium法による形質転換においてT-DNAのright borderとleft borderの内側近傍にネガティブ選択マーカーとして働くdiphtheria toxin-A(ジフテリア毒A)遺伝子を1個ずつ逆方向反復配列(inverted repeats)として配置し、更にその内側に遺伝子破壊したい配列と相同な配列とポジティブ選択マーカー遺伝子を挿入することによって、相同組換えを起こしたもののみ生存できるようにしたものである。相同組換えによって2個のdiphtheria toxin-A遺伝子が除去されポジティブ選択マーカー遺伝子が導入された細胞は生存可能であるが、非相同組換えによって標的遺伝子以外のところにright borderとleft borderとともにdiphtheria toxin-A遺伝子が導入された細胞は死滅すると考えられる。ただし、この方法によってもイネにおいて選択された形質転換体のうち目的とする遺伝子破壊体の頻度は1.9%であった。更なる効率上昇に関する研究は必要である。
後者の方法として、ジンクフィンガーヌクレアーゼ(ZFNs)やTranscription Activator-Like Effector Nuclease (TALENs)やメガヌクレアーゼ(meganuclease)を利用して、配列特異的に相同組換え頻度を上昇させ、植物における遺伝子置換効率を高める研究がある。DNA二本鎖切断を修復する過程でその切断部近傍のDNAの相同組換え効率は上昇する。ゲノム中の任意の部位だけを特異的に切断しゲノムの他の部位を切断しないような酵素は長い認識配列を必要とするため、通常の制限酵素では対応できない。そこで、認識・切断させたい長いDNA配列を切断できる酵素は人為的に設計できるものでなくてはならない。それらの条件を満たすものとしてZFNsやTALENsが挙げられる。置換したい遺伝子領域内の特異的な配列を認識できる様に設計された人工的なZFNsなどを植物中で誘導性プロモーターなどを利用して生産させるとその特異的配列を含む領域でDNA二本鎖切断が生じる。そのときに置換したい領域と相同性のあるDNA断片が導入されているとそれを鋳型としたDNA修復が生じ、相同組換えによる遺伝子置換が生じることになる。この方法は人為的DNA二本鎖切断を伴わない、前述の方法より遺伝子置換効率を上昇させることができる。しかし、ZFNsの配列認識の甘さによる標的配列以外の切断もあるため、ZFNsの改良がなお必要である。また、ZFNsなどとともにエキソヌクレアーゼやヘリカーゼを発現させることにより相同組換え効率を更に高めることができる。
なお、DNA二本鎖切断が生じた後、相同組換えが生じないとNHEJ(non-homologous end joining: 非相同末端結合)が生じる場合がある。その場合は、遺伝子破壊(ノックアウト)が生じることになる。
ZFNsやTALENs以外にも原核生物の外来DNA排除機構に関わるCRISPR/Cas9を用いた系がゲノム編集に利用され始めている(ゲノム編集コンソーシアム)。CRISPR/Cas9系では、特定DNA配列を認識するガイドRNAに対応する合成DNAをベクターに挿入するだけである。そのため、複数のジンクフィンガー・モチーフを組み合わせて作成されるZFNsを作製するよりも簡便で短時間に人工エンドヌクレアーゼ系を構築可能である。
遺伝子利用制限技術
遺伝子利用制限技術(GURTs: gene use restriction technologies)または遺伝的利用制限技術(GURTs: genetic use restriction technologies)とは、特異的化合物による遺伝子発現誘導系と配列特異的な組換え酵素とその標的配列を利用した遺伝子発現や形質を人為的に制御する技術である。この技術のことを、遺伝子組換え作物反対派は形質(trait)を制御することにかこつけて「裏切り者(traitor)」とよぶことがある。この技術を利用すれば、次世代の種子から導入された遺伝子を除去したり、必要ないときまでは形質が現れないがその形質が必要な場合には特定の化合物で処理すると形質を誘導したりできる。また、いわゆる「ターミネーター技術」もこの応用例である。
特異的化合物による遺伝子発現誘導系
外部から与えた化合物によって遺伝子発現を誘導するために開発された。遺伝子発現を制御にはトランス転写因子とシスエレメントが関与している。トランス転写因子はドメイン(domain)構造をとっており、それらはシスエレメントである特定のDNA配列を認識して結合するDNA結合領域や、転写活性化に関与するトランス活性化領域や、シグナルを検知して転写活性化能を制御するシグナル検知領域などに分けることができる。これらのドメインを別のトランス転写因子のドメインと交換することにより、別のDNA配列と結合させたり、別のシグナルによって転写活性を制御できたりする場合がある。そこで、外部から与える化合物をシグナルとする人工のトランス転写因子とシスエレメントの系が開発された。
人工のトランス転写因子に求められる条件として、
- 人工のトランス転写因子の活性を制御するシグナルとなるインデューサーやアクチベーターとして特異的化合物が必要であり、それらは植物の生活環の中で合成されず、更に接する可能性の低い化合物であること。
- 人工の転写因子が結合して転写を制御する、プロモーターのシスエレメントとなるDNA配列が植物に存在しないもの。植物が元々用いているようなシスエレメントを利用すると、植物に予定外の影響を及ぼす可能性が高くなる。そこで、進化的に離れたバクテリアなどのシスエレメントを利用すると、植物自身が本来持っているトランス転写因子とバクテリア由来のシスエレメントとが相互作用する可能性は低くなる。
が挙げられる。上記の条件を満たすために、バクテリア由来のシスエレメントと結合するDNA結合領域のアミノ酸配列、特異的化合物と結合して転写因子の活性を制御するシグナル検知領域のアミノ酸配列、及び、トランス転写活性化領域のアミノ酸配列との三つの領域を融合した人工のキメラ・トランス転写因子が合成されている。現在では、テトラサイクリンやエストラジオールや糖質コルチコイドなどによる遺伝子発現誘導系が開発されている。
- テトラサイクリン誘導系:大腸菌のトランスポゾンTn10に存在するテトラサイクリン耐性オペロン(tetオペロン)の発現は、リプレッサーであるTetR(アミノ酸配列)とオペレーターであるtetO (5'-TCCCTATCAGTGATAGAGAA-3')によって負に制御されている。テトラサイクリン非存在下ではTetRは活性型でtetOに結合して転写を阻害しているが、テトラサイクリン存在下では不活性型となりtetOから解離する。つまり、テトラサイクリンがtetオペロンのインデューサーである。そこで植物中で構成的に発現する遺伝子のプロモーターの下流にTetRの遺伝子tetRを結合したものと、それとは別の別のプロモーターの下流にtetOを複数個連結するとともに更にその下流に発現を誘導したい遺伝子を結合したものを組み合わせたものから構築されている。tetOを複数個連結している理由はTetRの結合効率を高めて、テトラサイクリン非存在下での遺伝子発現抑制効果を高めるためである。テトラサイクリンをインデューサーとして投与することによってtetO下流の遺伝子は誘導される。なお、インデューサーとしてはテトラサイクリンよりもドキシサイクリンの方が誘導性が高い。なお、この系はキメラ・トランス転写因子を用いたアクチベーター型のものではなく、リプレッサー型である。
- エストラジオール誘導系:DNA結合領域として大腸菌のSOSレギュロン(regulon)のリプレッサーであるLexA(アミノ酸配列)の第1-87アミノ酸残基配列、単純ヘルペスウイルス(HSV: Herpes Simplex Virus)由来のVP16(アミノ酸配列)のトランス転写活性領域(第403-479アミノ酸残基配列)、ヒト・エストロゲン受容体のシグナル検知領域(第282-595アミノ酸残基配列)を融合して作られた合成転写活性化因子XVE(アミノ酸配列)と、本来はLexAが結合するオペレーターであるSOS box (5'-TACTGTATATATATACAGTA-3')をXVEが結合するシスエレメントとし、CaMV 35S最小プロモーターのTATAボックス(TATA box)の上流にSOS boxを複数個配した転写誘導系である。CaMV 35S最小プロモーターにはエストラジオールが存在しないとほとんど転写活性がない。しかし、XVEとエストラジオールが結合するとXVEはSOS boxと結合して下流のCaMV 35S最小プロモーターの転写活性を強力に誘導する。つまり、正の制御系である。
- デキサメタゾン誘導系:DNA結合領域およびシグナル検知領域としてTetR(1-208アミノ酸残基)と、別のシグナル検知領域としてラットの糖質コルチコイド受容体(GR: glucocorticoid receptor)のホルモン結合領域(512-794アミノ酸残基)と、HSVのVP16のトランス転写活性化領域(363-490アミノ酸残基)の融合蛋白質TGVとtetOを利用して、デキサメタゾンで誘導、テトラサイクリンで抑制する系である。TetRが結合するオペレーターであるtetOをTGVが結合するシスエレメントとし、CaMV 35S最小プロモーターのTATAボックスの上流にtetOを複数個配してある。テトラサイクリンもデキサメタゾンも非存在下ではCaMV 35S最小プロモーターの転写活性はほとんどない。テトラサイクリン非存在でかつデキサメタゾン存在下ではTGVにデキサメタゾンが結合したものがtetOに結合して、転写が強力に誘導される。そこにテトラサイクリンが添加されるとTGV-デキサメタゾン-テトラサイクリン複合体となってtetOから遊離するため転写が抑制される。
上記の化学物質による遺伝子発現制御系を用いて、配列特異的組換え酵素の生産を制御してin vivoで形質を改変する技術(遺伝子利用制限技術)が開発された。その配列特異的組換え酵素とその標的配列としてCreとloxP、酵母の2-μm DNAや醤油酵母のpSR1の組換え酵素とそれらの標的配列、他が用いられている。その応用例を挙げる。
いわゆる「ターミネーター技術」
次世代の種子の発芽抑制技術である。自家受粉する作物では、組換え品種からの契約外の自家採種が行われていることがある。その制限のためと交配による遺伝子拡散の防止ために開発された。この技術のためには3つの系が必要である。
- 毒素遺伝子は種子成熟の晩期に発現して種子や胚を殺すが、成長・繁殖時期や他の部位では発現してはならない。そのために、胚発生後期に種子特異的に発現するプロモーターとそれを用いて生産される毒素遺伝子。
- 種子特異的に発現する毒素遺伝子が組み込まれていても、種苗会社が大量に種子生産ができるようにその発現を抑制する系。
- 種子販売に際して、種子特異的発現できるように毒素遺伝子の抑制を解除するための系。
それらを満たすために、ワタにおける例では次のものが用いられている。
- ワタの後期胚形成主要タンパク質(LEA: late embryogenesis abundant protein)遺伝子LEAのプロモーターとサボンソウ(Saponaria officinalis)のリボソーム不活化タンパク質(RIP: ribosome-inactivating protein, EC 3.2.2.22, アミノ酸配列, 塩基配列)かリボヌクレアーゼ(RNase)であるBARNASEを毒素とする。
- LEAプロモーターと毒素遺伝子の間を分断して転写や翻訳を阻害する分断配列。
- 分断する配列を条件的に除去するための系として配列特異的組換え酵素とその標的配列。
例としてRIPとCreとloxPとtetRとtetOの系について説明する。「目的遺伝子 + (LEAプロモーター + loxP + 分断配列 + loxP + RIP) + (構成的プロモーター + tetR) + (構成的プロモーター + 複数のtetO + cre)」というカセットを植物体に導入しておく。構成的プロモーターによりリプレッサーであるTetRが常に生産されているため、オペレーター配列であるtetOにTetRが結合してcreは転写・翻訳されない。その結果、後期胚形成期であっても、分断配列によって毒素RIPが生産されないので正常な胚発生が進行する。そのため、種苗会社はこの植物の種子を増やすことができる。しかし、種子を出荷する前にインデューサーであるドキシサイクリンで処理するとTetRが不活化してtetOから遊離してCreが生産される。その結果、順方向に並んでいる二つのloxPの間でCreにより配列特異的な組換えが生じて「目的遺伝子 + (LEAプロモーター + loxP + RIP) + (構成的プロモーター + tetR) + (構成的プロモーター + 複数のtetO + cre)」という構造に変換する。LEAプロモーター + loxP + RIPの組み合わせは転写と翻訳を阻害されない。この構造を持つ種子は正常に発芽・生育・開花できるが、受精後の種子形成の最終段階である後期胚形成期に胚においてのみ転写活性を持つLEAプロモーターにより、胚においてRIPが生産され胚は死滅する。その結果、次世代の種子は発芽できなくなる。
この技術に関しては反対意見が強いために現時点においては栽培されている遺伝子組換え作物には利用されていない。なお、「ターミネーター技術」とは遺伝子組換え作物反対派から命名された通称である。
遺伝的改変遺伝子除去技術(genetically modified gene deletor)
いわゆる「ターミネーター技術」を利用した場合、次世代の種子が発芽しなくなるため批判が強い。そこで、次世代の種子は発芽できるが導入された遺伝子が次世代には伝わらないように花粉や種子から除去する技術である。その結果、農家が契約に反して自家採種しても、その種子からは組換え品種を得ることができなくなる。生態系に対する遺伝子汚染を減少することもできる。種子や花粉特異的プロモーターを用いて配列特異的な組換え酵素遺伝子を誘導して、標的配列の順方向繰り返し(direct repeats)によって囲まれたDNA領域(導入された形質に係わる遺伝子)を、順方向繰り返し配列間の特異的相同組換えによってループアウトさせて除去して遺伝子拡散を防ぐ系である。
花粉特異的発現する遺伝子としてBGP1(配列)とLAT52(配列)が、花粉と種子特異的発現をする遺伝子としてPAB5(配列)が同定され、それらのプロモーターが単離された。loxPと2-μm DNAの標的配列を連結した配列を順方向繰り返し配列として利用し、それらのプロモーターでCreと2-μm DNAの配列特異的組換え酵素をそれぞれ単独で生産させた場合、導入された遺伝子を得られた種子からほぼ100%除去することができた。
その他、アシネトバクター(Acinetobacter)由来のセリン・リゾルベースCinH組換え酵素(serine resolvase CinH recombinase)(CinH:アミノ酸配列)とその認識配列RS2を用いて、花粉特異的に発現する遺伝子LAT52のプロモーターを用いてCinHを生産させて、順方向繰り返し配列とした二つのRS2に挟まれた領域(導入遺伝子)を除去する系も開発されている。RS2は、119 bpと長いため特異性が高くなるので、CinHとRS2を用いた系ではゲノムにもともと存在する類似の配列と組換える可能性はほとんどない。
なお、上記以外にもストレプトマイセス(Streptomyces)由来のファージphiC31のインテグラーゼ(integrase)と標的配列であるattBとattPを用いて組換えコムギでの導入遺伝子の除去にも成功している。phiC31を生産する組換えコムギと除去される標的配列を持つ組換えコムギを掛け合わせて得られた後代から目的とした導入遺伝子が除去されていることが確認されている。
エピジェネティック効果を用いた形質改変植物の育種
エピジェネティック効果とは「DNAの塩基配列の変化を伴わずにおきるゲノム機能の変化」である。細胞レベルでのエピジェネティック効果は以下のメカニズムに基づく。
- DNAのメチル化または脱メチル化
- non-coding short RNA (ncRNA: miRNA、siRNA、shRNA 等)による遺伝子制御
- クロマチン修飾(ヒストンのアセチル化、メチル化、リン酸化 等)
これらのエピジェネティック効果をもたらす操作を一過的に行っても、それに伴い変化したクロマチン状態は有糸分裂を経ても安定的に伝達され、生物の表現型に影響を与え続けることがある。つまり、初めに導入遺伝子によってエピジェネティック効果をもたらし、その後代からエピジェネティック効果を保持しつつ、かつ、導入された遺伝子配列を保持しない系統を選抜することで、植物のゲノム配列を変化させずに植物の形質を安定に変化させられる。
例えば、「non-coding short RNA (miRNA、siRNA、shRNA 等)による遺伝子制御」に関するRdDM (RNA-directed DNA methylation)を簡単に説明する。これは基本的にRNAiのgene silencing (GS)と同様の手法であり、「植物の発現を抑制したい遺伝子配列と相同性を持つコンストラクト(RdDM誘導コンストラクト)を植物体へ導入して、短鎖二本鎖RNA (dsRNA)を細胞中で作らせ、これにより相同配列部分のDNAのメチル化を誘発し、標的遺伝子の転写を抑制する」ものである。RdDMの植物育種上の重要性は、植物体の特定遺伝子を、遺伝子配列の変異を生じさせることなく、発現抑制できることにある。このDNAのメチル化状態は世代を通じて、維持される場合がある。そこで、後代において、目的の形質を保持し、かつ、導入されたRdDM誘導コンストラクトを保持しない系統を選抜する。この手法の応用により、既に様々な形質の植物体が作り出されている。
この手法には明らかな利点が存在する。DNAのメチル化自体はごく一般的な自然現象であり、真核細胞に広く発生している。RdDMによりメチル化されたDNAと自然にメチル化されたDNAを区別することは困難であり、RdDM誘導コンストラクトが除去された系統と従来の手法で育種された作物とを区別できない。導入された遺伝子が存在しないために、この手法により育種された作物はそもそも遺伝子組換え作物であるのかどうかという、遺伝子組換え作物の定義にも関わる根本的な議論を引き起こしている。
安全性審査
組換え作物に対する安全性審査は、生物多様性の確保に関するカルタヘナ法に基づく「食品としての安全性の評価」と「環境に与える影響の評価」に分けられる。
食品としての安全性の評価
日本においては、遺伝子組換え食用作物(遺伝子組換え食品)の商業的栽培は行われていないが、多量の組換え食品が輸入されている。それらの安全性を確保するため、厚生省は1991年(平成3年)から「安全性評価指針」に基づいて個別に安全性審査を行ってきたが、任意の仕組みであった。安全性審査を法的に義務化することとし、2001年(平成13年)4月1日から、安全性審査を受けていない遺伝子組換え食品の輸入・販売等が禁止された。
また、2003年(平成15年)7月1日に食品安全基本法が施行され、内閣府に食品安全委員会が発足したことに伴い、遺伝子組換え食品の安全性審査は食品安全委員会の意見を聴いて行うこととなった。厚生労働省の「遺伝子組換え食品の安全性審査について」に関連の規則や安全性評価基準についてのリンクがある。詳細はリンク先参照。2019年8月時点で、日本で食品として安全性が確認され使用許可があるGM作物は、8種類320品種である。食品安全委員会の「遺伝子組換え食品(種子植物)の安全性評価基準」によると、食品としての安全性審査における基本的な検討事項は、
- 組み込む前の作物(既存の食品)、組み込む遺伝子、ベクターなどはよく解明されたものか?
- 食経験はあるか?
- 組み込まれた遺伝子はどのように働くか?
- 組換えることで新しくできたタンパク質はヒトに有害でないか?
- アレルギーを起こさないか?
- 組換えによって意図しない変化が起きないか?
- 食品中の栄養素などが大きく変わらないか?
である。 上記のアレルギーの検定については、アレルギーの素となるアレルゲンの評価として、
- 挿入遺伝子の供与体(生物)が、アレルギー(グルテン過敏性腸炎誘発性を含む。以下同じ。)を引き起こすことが知られているか。
- 挿入遺伝子産物(タンパク質)が、アレルギーを引き起こすことが知られているか。
- 挿入遺伝子産物(タンパク質)が、加熱やタンパク質分解酵素処理(人工胃液や人工腸液)に対して、安定であるか。
- 挿入遺伝子産物(タンパク質)に、既知のアレルゲンと共通するアミノ酸配列があるか。
が、初めに調査される。上記4項目で安全性が判断できないときには、
- アレルギー患者の血清に含まれているIgE抗体との反応性がないことを確認する。
- アレルギー患者の血清を用いる試験で、安全性が判断できないときには、ヒトでの皮膚プリックテストや経口負荷試験などの臨床試験を行う。
ことにより、評価されている。
飼料としての安全性審査は、「飼料の安全性の確保及び品質の改善に関する法律(飼料安全法)」によって規定され、その基準は「遺伝子組換え飼料及び飼料添加物の安全性評価の考え方」に基づいている。
環境に与える影響の評価
遺伝子組換え作物を一般圃場で栽培する前に環境への影響は、カルタヘナ法に基づき、競合における優位性があるか有害物質を産生しないか、交雑性の主に3点から科学的に評価されている。
- 競合における優位性
- 野生生物と栄養分、日照、生育場所等の資源を巡って競合しそれらの生育に支障を及ぼす性質
- 有害物質産生性
- 野生動植物又は微生物の生息又は生育に支障を及ぼす物質を産生する性質
- 交雑性
- 近縁の野生植物と交雑し、法が対象とする技術により移入された核酸をそれらに伝達する性質
それぞれ、「競合における優位性による生物多様性影響が生ずるおそれが無い」、「有害物質産生性による生物多様性影響が生ずるおそれが無い」、「交雑性による生物多様性影響が生ずるおそれが無い」と評価されてから、農林水産大臣及び環境大臣より一般圃場での栽培が承認(第1種使用)される。
なお、花卉などの非食用の遺伝子組換え作物に関しては、カルタヘナ法に基づく第1種使用の承認だけが要求されており、食品としての安全性審査は必要とされない。
世界各国での栽培と輸出入の現状
概説
1994年にFlavr Savrが発売された後に、GM作物は、1996年にアメリカで大豆の栽培が始められて以降、着々と普及してきた。
2015年現在、全世界の大豆作付け面積の83%、トウモロコシで29%、綿で75%、カノーラで24%がGM作物である(ISAAA調査)。特に食生活の変化による肉類消費の増加を背景とした飼料用穀物の需要増加は、害虫、除草剤への耐性が高く、生産性も高いGM作物の需要増加に繋がっている。
ダイズの栽培面積の拡大に関しては、BSE問題と関連があるとされている。BSEによって家畜飼料として肉骨粉の使用が敬遠され、それに代わるタンパク質源として、ダイズが使用されているからである。その結果、組換え品種の割合の高いダイズの栽培面積が、組換え作物の栽培面積の増加となった。
その他、トウモロコシの栽培の増加には、バイオエタノール増産と関係があるとされている。アメリカを初め、中華人民共和国やインド、ブラジル、アルゼンチン、カナダなど各国へ普及しており、2006年時点で22カ国で約1億200万 ha栽培され、更に2007年には23カ国で約1億1430万 ha、2008年には25カ国で約1億2500万 ha、2009年には約1億3400万 ha、2010年には1億4800万 ha、2011年には1億6000万 ha、2012年には日本を除く28カ国において1億7030万 haで、2013年には27カ国において1億7520万 haで、2014年には28カ国において1億8150万 haで、2015年には28カ国において1億7970万 haで栽培された(ISAAA調査)。
2015年において、初めてその栽培面積が減少した主な理由は、2015年の農産物価格の低下と考えられた(ISAAA調査)。ちなみに農林水産省大臣官房統計部によると、2009年の日本の全耕地面積は約460万 haである。また、国際連合食糧農業機関(Food and Agriculture Organization: FAO)によると、2006年の全世界の栽培面積は耕地面積の約14億1171.7万 haと永年性作物の栽培面積の1億4197.6万 haの計15億5369.3万 haであった[29]。
つまり、2012年には全世界の耕地面積の約12%、耕地面積+永年性作物の栽培面積の約11%において遺伝子組換え作物が栽培されていたことになる。
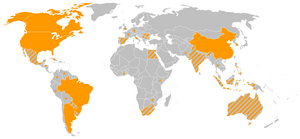
2015年の遺伝子組換え作物生産国は、
- 北米
- アメリカ合衆国、カナダ
- 中南米
- メキシコ、ホンジュラス、コロンビア、チリ、アルゼンチン、ウルグアイ、パラグアイ、ブラジル、ボリビア、コスタリカ
- アジア、オセアニア
- 中華人民共和国、インド、パキスタン、ミャンマー、フィリピン、ベトナム、バングラデシュ、オーストラリア
- アフリカ
- 南アフリカ、ブルキナファソ、スーダン
- ヨーロッパ
- ポルトガル、スペイン、チェコ、スロバキア、ルーマニア
である。なお日本においては、遺伝子組換えバラが商業栽培されている。
近年の特徴として、複数の形質(stacked traits)が導入された品種の栽培面積が増えてきている(ISAAA調査、USDA調査)。複数の形質とは、複数の除草剤に対する抵抗性や、除草剤耐性と害虫抵抗性などを併せ持つものである。多くの場合、異なった遺伝子が導入された複数の組換え作物を交配して作られている。
日本は大量の穀類を輸入しており、その相当量は既に遺伝子組換え品種であると推定されている。
遺伝子組換え作物の主要栽培国と日本での栽培の現状
- アメリカ
- 最初に栽培が始まったアメリカは遺伝子組換え作物の生産が最も盛んな国の一つである。2007年に報道されたところによると米国産作物の半分以上は遺伝子組換え作物であり、大豆はほぼ100%、トウモロコシは約70%を占める。また、加工食品の多くにもGM作物が使用されている。アメリカ食品医薬局によると、遺伝子組み換えトウモロコシのほとんどは、牛などの家畜や鶏肉などの飼料として使用されている。なお、米国農務省のNASS(National Agricultural Statistics Service)によると2008年の組換え作物の作付けの割合は、ダイズで92%(約2770万 ha)、トウモロコシで80%(約2820万 ha)、ワタで86%(約320万 ha)であった。また、2009年の組換え作物の作付けの割合は、ダイズで91%(約2860万 ha)、トウモロコシで85%(約2990万 ha)、ワタで88%(約320万 ha)であった。2010年では、ダイズで93%、トウモロコシで86%、ワタで93%であり、2011年では、ダイズで94%、トウモロコシで88%、ワタで90%であり、2012年では、ダイズで93%、トウモロコシで88%、ワタで94%であり、2013年では、ダイズで93%、トウモロコシで90%、ワタで90%であった。なお、2014年の組換え品種の栽培比率は、ダイズで94%、トウモロコシで93%、ワタで96%である。
- カナダ
- 2007年のダイズの栽培面積の62.5%(約68.8万 ha)は組換え品種であった。2007年のトウモロコシの栽培面積の84%(約117万 ha)は組換え品種であった。カノーラの2007年の栽培面積の87%(約510万 ha)は組換え品種であった。
- ブラジル
- 当所、ブラジル政府はGM作物に対して態度を明確にしていなかった。そのため、隣国であるアメリカでGM作物が問題となっていたことを利用して、2002年大統領選では候補者が「ブラジルではGM作物を作らない」と宣言して自国農作物をアピールする動きも見られた。ところが、そのときにはすでに密輸されたGM作物が国内に流通しており、2005年にブラジル政府はGM作物を認めることになる。2007年と2009年のダイズの栽培面積の64%(約1450万 ha)と71%(約1620万 ha)は組換え品種であった。2009年のトウモロコシの栽培面積の36%(約500万 ha)は組換え品種であり、ワタの栽培面積の18%(約14.5万 ha)は組換え品種であった。
- アルゼンチン
- 組換えダイズの栽培が盛んであり、2008年と2009年のダイズ栽培面積の99%(約1620万 ha)と99%(約1740万 ha)は組換え品種であった。2009年のトウモロコシの栽培面積の85%(約210万 ha)は組換え品種であった。また、2008年のワタの栽培面積の95%(約38万 ha)は組換え品種であった。
- ウルグアイ
- 2007年のダイズの栽培面積の100%(約47万 ha)は組換え品種であった。
- パラグアイ
- 2007年と2009年のダイズの栽培面積の93%(約260万 ha)と85%(約220万 ha)は組換え品種であった。
- インド
- 組換えワタの栽培が盛んであり、ナスなどの組換え品種の育種も進んでいる。2008年のワタの栽培面積の76%(約695万 ha)は組換え品種であった。なお、上記のデータと多少の誤差があるがISAAAの調査によると、インドの各地方に適した様々な品種が開発され2008年には綿花栽培面積の80%が、2009年には87%(約840万ha)がBtワタになっており、2009年には560万人の小農がBtワタを栽培した。さらに、2010年には86%(約940万ha)がBtワタになっており、630万人の小農がBtワタを栽培した。このように遺伝子組換えワタの栽培は急激に増えている。遺伝子組換えワタを導入する以前と比較すると綿花栽培に使用される農薬使用量の大幅な減少と単位面積当たりの収量の大幅な増加(2001-2002年では308 kg/ha、2009-2010年では568 kg/ha)によって、インドの農民に広く受け入れられている。インドにおける遺伝子組換え作物の現状については、ISAAAのIndia Biotech Information Centreによって詳しく解説されている。また、インドにおいて2002-2008年の期間のワタ栽培農家に対して経済学的な解析を行った結果によると、害虫被害の減少によってBtワタは伝統的ワタ品種より24%収量が多く、Btワタ栽培からの収入の50%増加につながり、その結果、Btワタを採用した農家の支出は2006-2008年の間に18%増加するほど生活水準が上がっていた。このことから、Btワタ品種の栽培はインドの経済的、社会的発展に貢献していると結論づけている。
- 中国
- GM作物を積極的に取り入れる動きがある。中国政府が積極的に取り組んでおり、研究は1986年から行われている。2006年時点では、GM作物のほとんどは綿花とタバコだが、基礎食品である米の開発に力を入れており、商業栽培も間近な状況となっている。2007年のワタの栽培面積の68%(380万 ha)は組換え品種であった。
- 日本
- 一部自治体で環境や消費者団体などへの影響への懸念から遺伝子組み換え作物規制条例で栽培を規制している。北海道、新潟県など10都道府県では実質的に栽培が禁止されている。また、購入した種子を撒いたところ混入していた組換え作物の種子に由来する組換え作物を栽培してしまった事例があるが、この場合は意図して栽培しているわけではないので処罰はされない。このように、現実には意図せず日本においても組換え作物を商業栽培している可能性がある。そのほか、スギ花粉症緩和米などは医薬品としての規制を受ける。厚生労働省医薬食品局食品安全部が安全性審査を終えた組換え作物を公表している。青いバラ (サントリーフラワーズ)は国内で商業栽培されているため、2009年には日本も遺伝子組換え作物の商業栽培国となった。
日本の遺伝子組換え作物の輸入量
「農林水産物輸出入概況2008年(平成20年)確定値」による主要穀類の日本の輸入量とその輸入相手国は以下の通りである。
- トウモロコシ:16,460,160トン(内 飼料用 11,877,772トン) 主要輸入相手国(重量比) アメリカ 16,277,542トン(内 飼料用 11,726,815トン)(98.9%)、アルゼンチン 86,724トン(内 飼料用 85,991トン)(0.5%)、インド 72,578トン(内 飼料用 57,868トン)(0.4%)
- ダイズ:3,711,043トン 主要輸入相手国(重量比) アメリカ 176,882,857トン(73.5%)、ブラジル 568,024トン(15.3%)、カナダ 325,010トン(8.8%)、中国 86千トン(2.3%)
- 菜種(採油用):2,312,536トン 主要輸入相手国(重量比) カナダ 2,208,754トン(95.5%)、オーストラリア 103,450トン(4.5%)
これらの作物の主要輸入相手国は、上記のようにそれらの作物の遺伝子組換え品種の栽培の盛んな国である。よって、日本は遺伝子組換え作物を大量に輸入していると推定されている。その推定値の中には日本の輸入穀類の半量は既に遺伝子組換え作物であるというものもある。日本における自給率は、トウモロコシ、ワタおよびナタネでは0%、ダイズでは7%で、国内需要を海外からの輸入に頼っている。日本への主要輸出国では、これらの作物にGM品種が高い割合で使用されており、日本に輸入されるこれらの農産物の9割程度がGM品種であると推測されている。GM作物の安全性や必要性について、日本国内において広く普及していないとみられるが、経済的貢献は大きく、年間1兆8000~4000億円のGDPを生み出している。
遺伝子組換え食品の含有の表示
概説
遺伝子組換え食品が流通している各国や地域において、遺伝子組換え食品含有に関して表示する義務の有無や規則が異なっている。その中には、「非遺伝子組換え」、「遺伝子組換え不使用」等に相当する表示自体が厳しく規制されている、アメリカやEU内のいくつかの国々もある。そのため、輸出に際しては輸入国の法律や規則に従う必要がある。「非遺伝子組換え」等の表示がある場合や無表示の場合でも、意図せざる混入により少量の遺伝子組換え作物が混入していることがあり、その場合の許される混入率も各国や地域で異なっている。
日本における表示
この節は特に記述がない限り、日本国内の法令について解説しています。また最新の法令改正を反映していない場合があります。ご自身が現実に遭遇した事件については法律関連の専門家にご相談ください。免責事項もお読みください。
|
表示の法的根拠
日本農林規格等に関する法律(JAS法)(遺伝子組換え食品に関する表示に係る加工食品品質表示基準第7条第1項及び生鮮食品品質表示基準第7条第1項の規定に基づく農林水産大臣の定める基準)(以下、「基準」)及び食品衛生法(食品衛生法施行規則)、現在は食品表示法に基づき、遺伝子組換え農産物とその加工食品について表示ルールが定められ、平成13年4月から義務化されている。なお、酒類に関しての表示の法的根拠は、酒税の保全及び酒類業組合等に関する法律(昭和28年法律第7号。以下「法」という。)第86条の6第1項の規定に基づく国税庁告示による「酒類における有機等の表示基準を定める件」である。それによると、「農林水産大臣の定める基準」の加工食品の規定を準用して、当該酒類の容器又は包装に遺伝子組換えに関する表示をしなければならないことになっている。
表示義務対象
表示義務の対象となるのは、大豆、とうもろこし、ばれいしょ(ジャガイモ)、菜種、綿実、アルファルファ、てん菜(テンサイ)及びパパイヤの8種類の農産物と、これを原材料とし、加工工程後も組換えられたDNA又はこれによって生じたタンパク質を検出できる加工食品33食品群及び高オレイン酸遺伝子組換え大豆と高リシンとうもろこし及びこれを主な原材料として使用した加工食品(大豆油等)等と規定されている。なお、パパイヤに関しては、2011年(平成23年)12月1日より施行された。
表示禁止対象
安全性審査の手続きを経た上記の8つの遺伝子組換え農産物以外の農産物(例えば、米や小麦など)及びその加工食品については、「遺伝子組換えでない」「非遺伝子組換え」などの表示はできない。上記の7つの遺伝子組換え農産物以外の農産物はもともと非遺伝子組換えであるため、表示することによってそれがあたかも特別に非遺伝子組換えであるかのような誤解を招かないように表示は禁止されている(食品衛生法施行規則 第二十一条 第五項)。ただし、その農産物について、「現在時点で、小麦やピーナッツの遺伝子組換えのものは流通していません。」などのように遺伝子組換えのものが存在していないことを一般論として表示することは可能である。
加工食品における主な原材料とは
遺伝子組換え農産物が主な原材料(原材料の上位3位以内で、かつ、全重量の5%以上を占める)でない場合は表示義務はない。また、加工の際に加える水については計算から除外することとなっている。ただし、原材料の上位4位以下のものや全重量の5%未満であるものに関しても、分別生産流通管理(IPハンドリング:Identity Preserved Handling)が行われていなければ、「遺伝子組換えでない」旨の不使用表示をできない。分別生産流通管理に関わる流通マニュアルは農林水産省や「財団法人 食品産業センター」などから公表されている。
義務表示
従来のものと組成、栄養価等が同等である遺伝子組換え農産物及びこれを原材料とする加工食品であって、加工工程後も組換えられたDNA又はこれに由来するタンパク質を、ひろく認められた最新の検出技術によって5%以上検出可能であるものについては、「遺伝子組換えである」旨又は「遺伝子組換え不分別である」旨の表示が義務付けられている(「基準」第3条第1項及び第2項)。
任意表示
油や醤油などの加工食品に関しては、組換えられたDNA及びこれに由来するタンパク質が加工工程で除去・分解され、ひろく認められた最新の検出技術によっても検出不可能とされている加工食品については、遺伝子組換えに関する表示義務はない。ただし、任意で「遺伝子組換えである」旨、「遺伝子組換え不分別である」旨、または「遺伝子組換えでない」旨を表示することは可能である。ただし、表示する場合は、「基準」及び「食品衛生法施行規則」に従う義務が生じる。
非遺伝子組換え農産物及びこれを原材料とする加工食品
上記の8つの遺伝子組換え農産物においては、分別生産流通管理が行われた非遺伝子組換え農産物及びこれを原材料とする加工食品であれば、遺伝子組換えに関する表示義務はない。ただし、任意で「遺伝子組換えでない」旨の不使用表示をすることができる。ただし、「遺伝子組換えでない」旨の不使用表示場合は、「基準」及び「食品衛生法施行規則」に従う義務が生じる。不使用表示の場合、生産から食品の製造までの全段階で、遺伝子組換え作物が混入しないよう施設の洗浄や機器の専用化など分別生産流通管理を適切に行っていれば、5%以下の遺伝子組換え作物の意図せざる混入が許されている。
分別生産流通管理と意図せざる混入
分別生産流通管理(IPハンドリング)とは、非遺伝子組換え農産物を農場から食品製造業者まで生産、流通及び加工の各段階で混入が起こらないよう管理し、そのことが書類等により証明されていることをいう。農産物及び加工食品の取引の実態として、分別生産流通管理を適切に行うことにより、最大限の努力をもって非遺伝子組換え農産物を分別しようとした場合でも、生産、流通のそれぞれの段階で非遺伝子組換え原料専用の機械、施設を設置することは現実的に不可能であることから、その完全な分別は困難である。そこで、分別生産流通管理が適切に行われていれば、このような一定以下の「意図せざる混入」がある場合でも、「遺伝子組換えでない」旨の表示が認められている。つまり、分別生産流通管理が行われなかった場合や意図的に組換え農産物を加えた場合は、たとえ5%未満の混入であっても不使用表示はできない。
パパイヤに関してはハワイでの出荷段階で個々の果実に表示シールが貼られる予定である。国内での加工がある場合には表示義務に応じた表示がなされる。
高オレイン酸遺伝子組換え大豆等の表示
従来のものと組成、栄養価等が著しく異なる遺伝子組換え農産物(高オレイン酸遺伝子組換え大豆や高リシンとうもろこし等)及びこれを原材料とする加工食品については、JAS法に基づき、組換えられたDNAやタンパク質を検出不可能であっても、「高オレイン酸遺伝子組換え」である旨又は「高オレイン酸遺伝子組換えのものを混合」したものである旨の表示が義務付けられている。
不使用表示食品における遺伝子組換え食品の検出
PCRなどの検出感度の高い検査法では、混入率0.01%程度でも陽性反応が出る。そのため、現在までに行われた多数の調査では、多くの「遺伝子組換え不使用」表示食品からも遺伝子組換え食品の混入が検出されているが、5%を超える混入はなかった。その混入率は、概ね0.1%未満-1.2%程度であった。
各国・地域における表示基準
バイテク情報普及会によると諸国の表示や規則は次のようになる[30]。
- アメリカ
- 従来のものと同等であるという観点から、遺伝子組換え食品に関する表示は義務付けられていない。さらに、「遺伝子組換え作物は含まれていない」、「遺伝子組換え不使用」などに相当する表示は厳しい条件の下でしかできず、実質的には困難である。しかし、高オレイン酸含有大豆の様に従来のものと著しく組成・栄養に変化がある場合には、その成分を表示することとなっている。
- カナダ
- アメリカと同様に栄養組成が従来のものと異なる場合にだけ表示が義務付けられていた。しかし、2004年4月15日、カナダ政府は遺伝子組換え原料を使用の有無の食品表示および広告を自主的に行うことに関する基準を、カナダの国家規格としてカナダ規格審査会が公式採用したことを発表した。
- EU
- 遺伝子組換えに関する表示は、遺伝子組換え作物に由来するDNAやそのDNAに由来するタンパク質の最終製品中での有無にかかわらず、遺伝子組換え作物から生成されたすべての食品に義務付けられている[31]。つまり、油のような加工食品や食品添加物、その他に飼料などについても表示が義務付けられている[32]。ただし、組換え飼料で飼育された家畜由来の肉製品や卵、蜂蜜などの例外規定も存在する[33]。表示方法としては、「この製品は、遺伝子組換え体を含む("genetically modified...")」または「…遺伝子組換え(作物名)から製造("produced from genetically modified...")」に相当することを記すこととなった。ただし、「遺伝子組換え作物は含まれていない」、「遺伝子組換え不使用」などに相当する表示("Without Genetic Engineering"、"without GMOs")が見受けられるが、EUの制度として認められているものではなく、このような表記をEUのいくつかの国ではアメリカと同様に国内的に規制している[34]。なお、表示規制は、最終消費者向けのものだけでなく外食事業者向けのものについても適用される。しかし、外食事業者が調理・加工して顧客に出す場合には義務表示規制が適用されず、そのまま出す場合にだけ適用される。たとえば遺伝子組換えパパイヤをそのまま出す場合は、メニュー等に「遺伝子組換えパパイヤ」と表示しなければならないが、それを使ってフルーツケーキを作って出す場合は表示が不要となる。また、承認されている遺伝子組換え作物については、意図せざる混入であれば0.9%までは「遺伝子組換え作物を含む」旨を表示しなくても良い。また、EUでは承認されていない遺伝子組換え作物であっても、EUの科学的リスク評価で肯定的な決定が出されている作物であれば、意図的でなければ0.5%までの混入を認めている[35]。
- オーストラリア・ニュージーランド
- 2001年12月から、遺伝子組換え体由来の作物および加工食品について表示が義務付けられた。そのうち、組み込まれたDNAや、それに由来するタンパク質が製品中に残らない油や砂糖などの加工食品には表示する必要はない。ただし、高オレイン酸含有大豆の様に組換えによって成分や特性に変化が見られる場合は表示が義務づけられている。なお、分別された非組換え原材料を使用している場合でも、「遺伝子組換え不使用」「非組換え」「GMフリー」「Non-GM」等に相当する表示は、検出される可能性がまったくない場合以外はできない。つまり、分別されていても、意図せざる混入があるため、実質的に「非組換え」等の表示は許されていないということを意味している。
- 韓国
- 対象品目において、遺伝子組換え作物を使っている場合は「遺伝子組換え」または「遺伝子組換え○○を含む」に相当することを表示しなければならない。なお、意図せざる混入の場合、最大3%までは認められており、今後は検査技術の精度や国際動向などを考慮し、順次1%水準にまで引き下げるとしている。また、「遺伝子組換え不使用」に相当することを表示できるのは、遺伝子組換え作物の混入の検出限界以下の場合だけである。
遺伝子組換え作物と有機栽培
概説
組換え作物に由来する資材を有機栽培に利用することは本来はJAS規格で禁止されている。しかし、飼料の多くを組換え作物に依存している現実を無視できず、また産業廃棄物の有効利用という面を重視して現状では許可されている。その他、現在、組換え作物の栽培と慣行農法や有機栽培と共存(co-existence)させるためのルール作りがEUを中心に進められている。
組換え作物由来の堆肥と有機栽培
上記の節のように日本は大量に遺伝子組換え作物を輸入している。その結果、遺伝子組換え作物に由来する家畜の糞尿などの大量の畜産廃棄物が発生している。畜産廃棄物や油粕などの産業廃棄物は有機質肥料の原料として用いられることもある。「有機農産物の日本農林規格」によれば、本来は種苗や防除資材や肥料などに組換えDNA技術を用いたものを利用できない。しかし、特例として遺伝子組換え作物から油を絞った油粕や、飼料として用いた結果生じた糞尿をもとに作った有機質肥料である堆肥を有機栽培に用いることは、現状では許可されている。堆肥に関しては、組換えDNA技術を用いていないものの入手やその確認が困難であることを理由に、「有機農産物の日本農林規格」の「附則(平成18年10月27日農林水産省告示第1463号) 抄」において、
(経過措置) 2 この告示による改正後の有機農産物の日本農林規格(以下「新有機農産物規格」という。)別表1に掲げる肥料及び土壌改良資材のうち、植物及びその残さ由来の資材、発酵、乾燥又は焼成した排せつ物由来の資材、食品工場及び繊維工場からの農畜水産物由来の資材並びに発酵した食品廃棄物由来の資材については、新有機農産物規格第4条の表ほ場における肥培管理の項基準の欄1に規定するその原材料の生産段階において組換えDNA技術が用いられていない資材に該当するものの入手が困難である場合には、当分の間、同項の規定にかかわらず、これらの資材に該当する資材以外のものを使用することができる。
と明記されている。
また、「有機農産物及び有機加工食品のJAS規格のQ&A」の「(問15-4) 遺伝子組換え作物に由来する堆肥の使用は認められますか。」の回答としても、
平成18年度の改正において「肥料等の原材料の生産段階において組換えDNA技術が用いられていないものに限る。」と規定され、堆肥についても組換えDNA技術の使用が明確に排除されることとなりました。 しかしながら、現状では植物及びその残さ由来の資材、発酵、乾燥又は焼成した排せつ物由来の資材、食品及び繊維産業からの農畜水産物由来の資材、発酵した食品廃棄物由来の資材のそれぞれについて、遺伝子組換え作物に由来していないことを確認することが現実的には難しい状況にあります。このため、これらの資材の活用が困難となることを考慮し、附則において、当分の間使用することができるとされています。
と解説されている。
組換え作物と慣行農法や有機栽培との共存
組換え作物の栽培が各国で年々拡大している。そこで、消費者と農家の「選択の自由(Freedom of Choice)」を保障するために、組換え作物の栽培と他の慣行農法や有機栽培との共存のための規制作りがEUを中心に各国で進められている。EUにおける規制の指針は作成されたが、その規制の実施方法に関しては各国で対応が異なっている。
論争
遺伝子組換え作物(GM作物)については、強く推進する者がいる一方、健康や環境に悪影響があるのではと不安を抱く者も多く、イギリスなどの一部の国では、商業目的でのGM作物栽培が行われていない。GM作物を否定する者と肯定する者の間で、その影響について論争が起きている。
生態系などへの影響
概説
遺伝子組換え作物の生態系への影響を含めた評価をする上で重要なことは、何と比較するのかということを明確にすることである。細胞融合や種間交雑、変異体育種、古典的交配を含めた従来の手法によって育種された品種や、慣行農法(慣行栽培)や有機栽培や自然農法との比較を行い、様々な観点からの評価を遺伝子組換え作物に対して総合的に行う必要がある。日本においてはセイヨウアブラナであるカノーラのこぼれ種の発芽や他のアブラナ属植物との交雑、ダイズに関しては自生している野生種(原種)であるツルマメとの交雑の可能性が指摘され、様々な調査がなされている。なお、日本には、トウモロコシと交雑可能な野生植物は存在しないため、組換えトウモロコシを日本で栽培した場合、組換えトウモロコシによる野生種への遺伝子汚染の問題はない。そこで、カノーラとダイズの交雑問題について記述した。
外来遺伝子による遺伝子汚染とその防除法
本来、組換え作物が持っていて野生植物が持っていない形質が、組換え作物の花粉の飛散等によって近縁の植物との間で交雑して、拡散してしまう可能性がある(遺伝子汚染)。そのため、組換え作物においても生態系への影響として、組換え品種と在来種や野生種との交雑の危険性があげられることがある。ただし、在来種や野生種との交雑に関しては、組換え品種のみではなく伝統的手法で育種された品種でも同様の問題を含んでおり、組換え品種にのみ限定された問題ではない。
組換え作物と在来種や野生種との交雑を防ぐ手法の一つとして、花粉を作らない雄性不稔の形質が求められている。その他の解決法として、葉緑体などのプラスチド(plastid)やミトコンドリアのゲノムは基本的に母系遺伝のため、花粉を通して拡散しないという性質を利用することもある。すべての植物の形質転換に利用できるわけではないが、プラスチドのDNAに目的の外来DNAを相同組換えによって導入してプラスチド内で発現させる訳である。これをプラスチド形質転換という。このようなプラスチド形質転換植物の外来DNAは形質転換植物自身に結実した種子を通してのみ後代に伝達されるため、花粉を介した遺伝子拡散を回避できる。その他、自家受粉するイネやダイズなどの作物においては、閉花受粉性を利用する試みが進んでいる。閉花受粉性とは、開花せずに同一の花の雄蕊の花粉によって雌蕊が受粉する性質である。この性質を利用できれば、花粉を介した遺伝子拡散の可能性を低減できる。現在では利用されてはいないが、いわゆる「ターミネーター技術」を利用すれば遺伝子拡散を防ぐことができる。その他にも種子や花粉特異的に発現する遺伝子のプロモーターによって配列特異的な組換え酵素とその標的配列を利用して導入遺伝子を花粉や種子から除去する遺伝的改変遺伝子除去技術(genetically modified gene deletor)などの利用が考えられる。
遺伝子組換え作物と遺伝的多様性
更に、組換え品種を大量に栽培すると遺伝的多様性が失われるのではないかという懸念も、組換え品種特有の問題ではなく、在来品種においても少数の品種の大規模栽培に伴う問題である。農業も産業である以上、経営上有利である高品質で低コストなどの競争力の高い品種が現れれば、遺伝子組換え作物に限らず栽培が広がる。その過程で競争に敗れた品種は淘汰される。しかし、野生種や競争力の低い旧来の品種にも重要な遺伝子やゲノム構造が存在しているため、その維持・保存は重要である。
一方、遺伝的多様性を維持していく上で、遺伝子組換え技術は大いに役立つという意見もある。その意見は、
- 従来の育種法において、多くの品種を育種材料として用いてそれらに新たな形質を導入することは、きわめて多数の試料を扱うことになり困難である。そのため、比較的少数の品種等しか育種の材料になれず、育種材料として選ばれなかったものの遺伝子やゲノム構造の消失する可能性が高くなる。
- 一方、遺伝子組換え技術を利用した場合では、新たな形質を発現させるための遺伝子発現カセットを多数の品種に導入することは比較的容易である。よって、多数の品種を維持・保存する上で有利である。
という考えに基づいている。つまり、在来品種に遺伝子組換え技術によって有用な遺伝子を導入し競争力を高めることにより、在来品種のゲノム構造が残りやすくなるという意味である。
組換えカノーラもしくはその後代の自生
カノーラの輸入港の近辺や菜種油工場の近辺、更にそこに至る沿道では遺伝子組換えカノーラの自生が確認されている。2015年度(平成27年度)の調査では、ナタネ類の日本の輸入港18港のうち、10港の周辺で組換え遺伝子を持つものが、ナタネ類1215個体中から130個体見つかった。その調査においては、カラシナ又は在来ナタネと遺伝子組換えカノーラとの交雑体は発見されなかった。
その他のアブラナ属作物との交配に関しては、栽培されている作物は雑種第一代であり、その他、品種の純粋性を保つために、種子を栽培農家が毎年購入しているので、アブラナ属作物に遺伝子組換え品種の形質が導入される可能性は低い。なお、現在、輸入されているカノーラの種はBrassica napus(セイヨウアブラナ)であり、複二倍体の種であるためそのゲノム構成はAACC (2n = 38)である。日本で栽培されている多くのアブラナ属作物はBrassica rapa(ゲノム構成: AA, 2n = 20)かB. oleracea(ゲノム構成: CC, 2n = 18)かB. juncea(ゲノム構成: AABB, 2n = 4x = 36)であり、カノーラとの交雑も報告されているが、同種間に比べ交雑と発芽の可能性は低く、また交雑したものの稔性も低い。しかし、野生化しているB. rapaと遺伝子組換えカノーラとの交雑した植物体(ゲノム構成: AAC, 2n = 3x = 29)の自生も確認されている。なお、日本で栽培されているB. napusはセイヨウアブラナ、芯摘菜、かぶれ菜、のらぼう菜、三重なばな、などである。
組換えダイズとツルマメの交雑頻度
ダイズ(Glycine max)の原種であるツルマメ(G. soja)は、日本を含む東アジアやシベリアで自生している。ツルマメもダイズも閉花受粉による自家受粉性の強い植物であるが、ツルマメとダイズは交雑可能である。そのため、組換えダイズを東アジアで栽培すると導入遺伝子がツルマメに拡散する可能性が指摘された。そこで、どの程度の交雑頻度であるのかを調べる定量分析が行われた。ダイズとツルマメが絡みつくくらいに混植した混植区と2 m, 4 m, 6 m, 8 m, 10 m離して植えた距離区が設定、供試された。また、花期の異なる組換えダイズ品種を複数種類用いると共に、播種時期をずらして、できるだけツルマメと組換えダイズの花期を合わせるようにした。そしてツルマメに結実した種子のみを回収して解析した。その結果、混植区では、25,741個体中、交雑個体は35個体であり、また、距離区(66,671個体)においても、遺伝子組換えダイズから2 m、4 m、6 mの距離区での交雑個体はそれぞれ1個体、8 m、10 mの距離区では交雑個体は認められないという結果になった。このことから、意図的に交雑頻度を上げるような操作を行っても、組換えダイズとツルマメの交雑は極めて低頻度であることがわかり、通常の栽培条件では更に低頻度になることが予想された[36]。
Btトウモロコシ花粉の生態系に与える影響
生態系に与える他の影響として、Btトウモロコシの花粉がトウモロコシ畑の近傍の有毒雑草であるトウワタにかかり、それを食草とする蝶・オオカバマダラの幼虫の生育を阻害して生存率を下げたという報告が有名である。この論文は、実験室内でトウワタの葉にBtトウモロコシ、トウモロコシ栽培品種の花粉をかけたものとかけなかったものを餌としてオオカバマダラの幼虫を飼育して経時的に体重と生存率を測定したものである。その際に、トウワタに散布した花粉の密度が、"Pollen density was set to visually match densities on milkweed leaves collected from corn fields."と非定量的であるにもかかわらず、体重変化や生存率を定量的に示したという問題点を含んでいる。著者らが、"it is imperative that we gather the data necessary to evaluate the risks associated with this new agrotechnology and to compare these risks with those posed by pesticides and other pest-control tactics."と述べているように、Btトウモロコシの栽培と慣行栽培によるリスク評価の比較を行うことは重要である。すなわち、殺虫剤の散布に伴う生態系への影響や残留農薬、食害に伴う微生物汚染などのリスクとBtトウモロコシのリスクを比較する必要がある。たとえば、慣行農法によって殺虫剤をまくことによって害虫以外への影響とBtトウモロコシの栽培による影響を相互比較した場合、どちらが生態系への影響が大きいかを検定することなどである。なお、Bt toxinを生産させるための発現カセットのプロモーターを花粉で発現しないものにすることにより、花粉に含まれるBt toxinの量は激減させることができる。MON80100[37]やMon809[38]などのように、Btタンパク質が花粉中にはほとんど含まれないが他の組織には含まれるトウモロコシ組換え品種などがその例である。なお、全ての組織で強く発現するとされるCaMV 35sプロモーターやその改変したもの、他のウイルスのプロモーター、ユビキチン、熱ショックタンパク質類似タンパク質の遺伝子のプロモーターなどがBt toxin生産に使用されている組換え品種でも、花粉中にはBt toxinはほとんど含まれていない。また、全組織で強く発現するとされるプロモーターを用いた場合でも、得られた形質転換植物の系統の中からBt toxinを花粉では生産しない系統を選択することでも避けられる。
なお、国内外の大学の生物学の教科書として広く利用されている「キャンベル生物学」において、この論文や論争については以下のように記載されている。
One laboratory study indicated that the larvae (caterpillars) of monarch butterflies responded adversely and even died after eating milkweed leaves (their preffered food) heavily dusted with pollen from transgenic Bt maize. (オオカバマダラというチョウの幼虫(芋虫)は、(この蝶が好む食物である)トウワタの葉に形質転換Btトウモロコシの花粉を大量に降りかけられた後に食べると、有害な反応を示し死ぬことさえあったということを、ある研究室の研究が示した。) This study has since been discredited and affords a good example of the self-correcting nature of science. (この研究は、もとより信用されず、科学の自己の過ちを修正する特性のよい例を提供している。) As it turns out, when the original reserchers shook the male maize inflorescences onto the milkweed leaves in the laboratory, the filaments of stamens, opend microsporangia, and other floral parts also rained onto the leaves. (結局のところ、もともとの(論文の)研究者がトウモロコシの雄花をトウワタの葉に実験室でふりかけたとき、雄蕊の花糸やはじけた花粉嚢と他の花の部分も葉に降り注いでいた。) Subsequent research found that it was these other floral parts, not the pollen, that contained Bt toxin in high consentrations. (引き続き行われた研究は、Bt毒素を高濃度で含んでいたのは、花粉ではなく、これらの他の花の部分であることを明らかにした。) Unlike pollen, these floral parts would not be carried by the wind to neighboring milkweed plants when shed under natural field conditions. (花粉とは異なり、これらの花の部分は自然な圃場の環境下で落下した場合、風により隣接するトウワタの植物体に運ばれない。)
このようにこの論文の評価はほぼ定まっている。
除草剤耐性雑草の増加による環境負荷
除草剤に耐性を持った遺伝子組み換え作物が幅広く普及した要因の一つには、単一の薬剤を一度使用するだけで雑草を一挙に取り除ける事から手間もコストも環境負荷も従来より低減するという利点があると考えられている。しかし、複数の除草剤を使い分けていた従来の手法と違い、単一の除草剤だけに頼った事で雑草の側が容易に除草剤への耐性を獲得してしまい、除草剤が効果を発揮しづらくなる事例が増加している。
雑草の耐性獲得を防ぐ為には、遺伝子組み換え作物とそれに対応した単一の除草剤ばかりを使用せずに、輪作・耕作・耕起・複数の除草剤の使用といった、従来の手法を組み合わせる必要があるが、そのような従来の手法に回帰すればするほど、手間、費用、環境負荷といった、遺伝子組み換え技術の利点が失われると指摘されている。(→ラウンドアップ耐性雑草の世界的な問題)
経済問題
概説
組換え品種を開発した企業が、種子の支配を通じて食料生産をコントロールすることにつながるのではないか、という懸念が出されている。多くの場合、組換え種子の販売会社と生産農家は、収穫した種子の次回作への利用を禁止する契約を結んでいる。更に、組換え種子を毎作毎に農家に購入させるための手法として、一時期、結実はできるが得られた種子から発芽できないようにする、いわゆる「ターミネーター技術」が導入された組換え品種の開発が行われたが、批判も多く、現在、販売されているものの中にはない。
F1品種の多いトウモロコシなどを除き、カノーラやダイズの組換え品種に関しては農家による自家採種によって違法増殖され紛争になることがある。上記のラウンドアップ耐性作物を開発・販売しているモンサント社は農家の農家の自家採種に対して「特許侵害」として数多くの訴訟を起こしており、これに反発する農家も存在する。
その他、農家による自家採種には、経済的な側面以外にも、Bt toxin生産作物などの害虫抵抗性品種に関してはBt toxin抵抗性害虫の出現を助長するという重大な問題を含んでいる。
その他の経済問題として、組換え作物の方が収量が低いという指摘がある(Benbrook reportsなど)一方、逆に組換え作物の方が収量が高く経済的にも有利であるという報告もある。
組換え作物栽培による農民の経済的利益
1995年から2014年3月までの組換え作物の経済問題に関する147報の研究報告を基に組換え作物の経済問題に対する包括的なレビューが報告された。それによると様々な形質を持つ組換え作物(主に害虫抵抗性トウモロコシとワタ、除草剤耐性ダイズとトウモロコシとワタ)の結果を纏めた結果として、収量は21.6%増加、農薬使用量は36.9%減少、農薬費用は39.2%減少、全生産費用は3.3%増加、農民の利益は68.2%増加することが判明した。更に害虫抵抗性と除草剤抵抗性作物に分けて解析すると、害虫抵抗性作物の収量は21.98%増加、農薬使用量は38.97%減少、農薬費用は39.45%減少、全生産費用は3.94%増加、農民の利益は60.01%増加することが、除草剤抵抗性作物の収量は21.98%増加、農薬使用量は6.02%減少、農薬費用は36.21%減少、全生産費用は5.51%減少、農民の利益は56.48%増加することが明らかになった。
種子の支配と種苗会社の寡占化
毎作毎に種子を購入する必要性を通じて、開発した種苗会社による種子の支配が強化されるという批判がある。これは、農民には収穫した種子の一部を次回作に利用する権利があり、それを侵害することになるという意見である。しかし、これは、組換え品種に限定された問題ではない。
現代農業では、交雑による雑種第一代が栽培されている。F1品種に実った種子はF2世代であり、F2世代は遺伝的に不均一であるため、F2世代は栽培可能ではあるが、F2世代を栽培すると様々な表現型の植物の雑多な集団となってしまう。そのため、栽培管理上著しく不利になってしまう。
そこで、F1品種を栽培する場合、安定して同一形質の作物を得るためには、毎作毎に種子を購入しなくてはならない。更に、F1品種でなくても自家採種した種子は、遺伝的な純粋性の問題、病原菌汚染や種子の品質の問題、その品種名を名乗って販売する場合の種苗法の問題があり、多くの農家が種子を種苗会社から購入している現状がある。つまり、特定企業による種子の支配の問題は、遺伝子組換え品種に特有の問題ではない。
一方、この意見に対する反論もある。従来の交配や突然変異による育種において優良な品種を開発するためには、扱う材料が膨大で、人員や時間が大量に必要で費用がかかる一方、優良な品種が得られる確率が低かった。それに対して、遺伝子組換え育種では、アイデアさえよければ比較的短期間・低コストで優良な品種を育種できる確率が高いために、小資本のベンチャー企業や小規模な研究機関でも組換え品種の開発に参入できた。
ただし、組換え品種を開発すること自体は比較的容易であっても、それを商品化して上市するためには安全性審査に合格する必要がある。安全性審査には多額の費用と時間がかかるために、小資本のベンチャー企業や中小資本の種苗会社や中小研究機関にはその余裕がなく、それに耐えられる大資本の種苗会社に企業ごと買収されたり、特許を売却したりすることにつながった。つまり、遺伝子組換え品種に対する規制の強化の結果として、大資本の種苗会社による寡占化が進んだという解釈も成り立つ。
その他、組換え品種の多いトウモロコシ、ダイズ、ワタ以外の果樹や野菜やバイオ燃料用作物においても、様々な形質の組換え品種が開発されているが、それらの多くは商業化されていない。その理由としても、同様のことが指摘されている。
更に、別の問題によって寡占化が進んでいるという指摘もある。日本で組換え食品の安全性審査を多数の申請業務を経験しているのは数社の大手企業だけであり、それらの会社では申請のノウハウが蓄積され、提出文書も改善されている。
しかし、例えば、ウイルス抵抗性パパイヤの安全性審査の申請を行ったハワイパパイヤ産業協会などのように、食品安全委員会に組換え作物・食品の商業利用申請を出すことが今後少ないであろう小企業や大学などは、食品や環境への安全性審査に多大な時間と経費を要し、そこで得たノウハウをさらに活用する機会が少なければ、商業化への意欲も低下し、ひいては研究・開発活動自体が停滞・縮小していくとも考えられる。
多国籍組換え作物開発種苗会社と国際的な知的財産権
農作物の生育には、地域の気候や土壌との適合性が重要である。このため、多国籍種苗会社といえどもすでに実績のある種苗を輸出するためには、その種苗に適した類似の気候や土壌の地域に限られる。既存の品種に適さない気候帯や土壌特性の地域に輸出した場合は期待通りの収穫は得られない。そこで、現地で新たな品種を育種しなければならない。
ところが、進出するに当たり問題になるものは知的財産法制度である。知的財産法制度は各国固有のものであるために、種苗に対する知的財産権保護の制度やその実効性は国や地域によって異なる。例えば、米国では特許を得ている種苗などの知的財産であったとしても、仮に外国で保護の対象とされていなければその国内での増殖は違法ではないし、特許権ではなく種苗育成者権でしか保護されていなければ、その種苗を用いた新品種の育種も違法ではない。
そのため、知的財産法制度やその実効性が乏しい国や地域に、多国籍種苗会社は進出しにくくなるとも考えられる。しかし、知的財産法制度の整備よりも、実際には"進出企業数が可耕面積と公的種苗販売者数に正の相関を持つという結果は,利潤に敏感な多国籍種苗企業の行動を端的に示すものであろう。"という解析が出ている。
更に、作物や品種によって種苗会社の知的財産権保護の実効性が異なる。トウモロコシの雑種第一代のように、毎作毎にF1種子を購入しなくてはならない品種の場合は、種苗会社の知的財産権は比較的守られることになる。一方、コメやコムギやダイズのように、優先的に自家受粉するため遺伝子座のホモ接合性の高い作物の固定された品種では、実った種子が親と同じ遺伝形質を持つので、ジャガイモやイチゴのように、栄養繁殖するものと同様に違法な増殖を防ぐ実効性が乏しくなる。
事実、アルゼンチンで栽培されていたモンサントが育種した遺伝子組換えダイズ(ラウンドアップレディー・ダイズ)のほとんどが、違法に増殖されていたものであること("モンサント・アルゼンチン社の広報担当者によると,同国で撒布された大豆種の18%しか合法な種でないという(La Nacion, 2004年1月20日)。", p.72-73)が報告されている。
このことは、種苗会社の知的財産権が守られやすいF1作物やその組換え品種を好んで育種するというように、種苗会社がどのような作物を選択して育種するのかということにも関係してくると考えられる。また、違法増殖があった場合には、多国籍種苗会社が種子の販売を停止する場合がある。
例えば、前述の違法に組換えダイズを大量に栽培していたアルゼンチンに対して、
モンサントのアルゼンチン法人は、大豆生産第三位国のアルゼンチンにおける大豆種販売を2003年12月に停止し、2004年1月18日にはGM トウモロコシ,GM モロコシ,新品種のひまわりなど、交雑作物に販売の重点を移すことを発表した(Reuters, 2004年1月18日)。翌日,モンサントは状況が好転したら、大豆種販売を再開するとも発表している。2004年2月、違法行為を放置し続けてきたアルゼンチン政府も、ロイヤルティ支払いのために基金を設立することを明らかにし、モンサント社の“脅し”に応えている(St. Louis Business Journal, 2004年2月20日)。
と報道(p. 52, 右 5-14行)された。
このような行為を「企業による種子の支配」ととらえるか、侵害された知的財産権を回復するための「正当な行為」ととらえるか、意見が分かれる。なお、ラウンドアップレディー・ダイズに対する特許料支払いに関しては、アルゼンチン政府とモンサントだけではなく、アメリカ合衆国連邦政府も巻き込んで、2005年以降も交渉がもめており、知的財産権の国際的な紛争解決の困難さを示している。
シュマイザー事件
1998年、カナダモンサント社はカナダ、サスカチェワン(Saskatchewan)州の農民、パーシー・シュマイザー(Percy Schmeiser)の農場でラウンドアップ耐性ナタネ(カノーラ: canola)が無許可で栽培されていることに対し特許権侵害で訴訟を起こした。シュマイザーは種子に特許が存在しないこと、農場のナタネの9割以上がラウンドアップ耐性ナタネになっていたのは意図的に栽培したのではなく周辺で栽培されているラウンドアップ耐性ナタネによる「遺伝子汚染」の結果であると主張した。しかし、交雑等の可能性があっても約400 haに植えられたナタネの95-98%のナタネがラウンドアップ耐性ナタネになることは現実にはあり得ないとしてカナダ最高裁はモンサント社に対する特許侵害を認めた。下級審の判決を妥当としシュマイザーは敗訴した。
まず、カナダ連邦裁判所が2001年3月29日に下した判決では、シュマイザーがラウンドアップを噴霧器で自ら噴霧してラウンドアップ耐性ナタネを意図的に選択して増殖し、栽培したことを認定した。
また、2002年9月4日のカナダ連邦控訴裁判所の判決においても、シュマイザーの控訴事由を三人の判事が全員一致で全て退けた。2004年5月21日にカナダ最高裁判所によって下された判決においても、シュマイザーは敗訴した。
種子に対する特許が認められたことに対しカナダの市民団体と生産者団体は強く反発している。
シュマイザーは自らを遺伝子汚染の被害者として、遺伝子組換え作物反対派と共に日本国内でもたびたび反対活動を行っている。
インドにおけるBtワタ栽培と農民の自殺の関係の有無
イ ンドでは2002年から遺伝子組換えBtワタが導入され、その栽培面積は急激に広がっている。緑の革命に対する批判者としても、遺伝子組換え食品反対派としても国際的に著名なインドの環境活動家であるヴァンダナ・シヴァ(Vandana Shiva)らは、「インドにおいて遺伝子組換 えBtワタの種子の導入はコストを80倍にし、農民を借金漬けにして自殺に追い込んだ。27万人以上のインドの農民が高価な種子と農薬による借金のために 自殺した。そして大部分の自殺はワタ栽培地帯に集中している。」と主張している。しかし、別の調査によれば、遺伝子組換えBtワタがインドに導入される以前の1997年から大幅に栽培面積が増加していった2007年にかけて10年間のインドの農民の自殺数にほとんど変化は認められず、自殺数と遺伝子組換えBtワタの栽培面積の間に相関も見いだせなかった(インドの農民の年間自殺数とBtワタ栽培面積の変化のグラフ)。このことから「ネイチャー」は2013年の5月2日号で、シヴァらの主張は誤りであるとした。
倫理面
宗教上やその他の信念により遺伝子操作自体を忌み嫌う人も存在し、反対活動を行っている。一方、ゴールデンライスのように人道的なものにまで反対することに対しては反発もある。
ゴールデンライスと遺伝子組換え食品反対運動
ビタミンA欠乏症を解消することは世界保健機構(WHO)や国際連合児童基金(UNICEF)においても主要目標である(A Strategy for Acceleration of Progress in CombatingVitamin A Deficiency)。WHOによると、 推定2億 5千万人の未就学児がビタミンA欠乏症であり、ビタミンA欠乏地域では多数の妊婦もビタミンA欠乏症である。そして、推定25万人から50万人の子供たちが毎年、ビタミンA欠乏症で失明し、その半数が一年以内に死亡している。そのような子供たちは南アジアや東南アジアの都市部のスラムに住む貧困家庭に多い。ビタミンA欠乏症を解消するために、主食であるコメにビタミンAの前駆体であるβ-カロテンを含むようにしてビタミンA欠乏症を緩和しようと育種されたものがゴールデンライスである。
このゴールデンライスに対しても反対する遺伝子組換え食品反対派はいる。前述のヴァンダナ・シヴァの主張は、
ビタミン含有率が高い遺伝子組み換えのゴールデンライスの開発に対して、イギリスのビタミン不足の子どもたちのために開発しているのになぜ反対かと、ヴァンダナ・シヴァさんが責められた。答えは、「そんなものはいらない。リンゴひとつ食べればビタミンは補えるもの」。バランス良く食べれば、そんなものはつくる必要がないし、ほんとうに栄養不足の子どもたちの役にたつわけでもない。そして、ゴールデンライスみたいな画一的な圃場(ほじょう)をつくるためになぎ倒された、たくさんの薬草でビタミンを補給していたインドの子どもたちが、年間4000人失明していると反論していました。
と紹介されている。この主張に対しては、リンゴはビタミンAの供給源としては不適切であるという栄養学的な反論と、貧困家庭の人々がバランスが良い食事がとれないためにビタミンA欠乏症に陥っている[39][40]という現実を無視しているという反論がなりたつ。
また、ヴァンダナ・シヴァの主張の中には、色素米や茶米には多量のビタミンA前駆体が含まれているのでゴールデンライスを開発する必要がないというものがある。しかし、玄米には極僅かのβ-カロテンが含まれるために痕跡量のレチノール当量のビタミンA活性があるがビタミンAの供給源としては不適切であり、精米された白米にはないといって良い。赤米の色素はタンニン系であり、黒米の色素はアントシアニン系である。つまり、ビタミンAに変換されるカロテノイド系の色素ではないため、赤米や黒米はたとえ玄米であったとしてもビタミンAの供給源にはならない。
この様なゴールデンライスに対する反対に対して、ゴールデンライスの開発者(Ingo Potrykusら)や推進派の中には、人道に反すると反発する考えもある。また、ゴールデンライス導入の遅れに伴うビタミンA欠乏症に関係する健康被害にゴールデンライスの反対派は責任をとるべきである、という意見もある。
食品としての安全性
概説
- 従来考えられないほどの短い期間で新品種の開発が行われる。
- 従来はありえなかった「種の壁を越えた」品種開発が可能である。
などを根拠に安全性を保障する実績がないとして忌避する意見も根強い。しかし、従来の非GM作物であっても100%の安全性証明がなされているわけではなく、暗黙のうちに「危険性」が許容されている。また、「種の壁」は一般に信じられているほど強固なものではなく、遺伝子の水平伝播や雑種形成も知られていることなどを考えるべきで、一般的に行われている品種改良を無視して、GM作物だけを問題視するのは公正とはいえない。GM作物の安全性については「実質的同等性」の概念に基づいた議論が重要である。ヒトのタンパク質消化において大部分はアミノ酸にまで分解されてから吸収されるため、よほどでない限り遺伝子組換え作物によって変化したアミノ酸配列の僅かな違いが消化・吸収に大きな影響を与えるとは考えにくい。
事実、様々な組換え作物と非組換え作物を飼料として多くの家畜に投与し、様々な生化学的、生理学的、組織学的差異を調べる大規模な研究を行ったが、如何なる有意な差異を見いだせなかったという包括的なレビューを欧州食品安全機関(European Food Safety Authority: EFSA)が発表している。
また、組換え食品は解放系での栽培や上市されるまでにさまざまな安全性審査を受けて、それに合格したものである。一方、組換え作物の比較対象となる在来品種は、組換え作物が受けるような安全性審査を経たものはほとんどなく、その安全性は組換え作物に比べ未知数であるという解釈も成り立つ。
以下の節でいくつかの特記すべき事例について論じる。
害虫抵抗性トウモロコシにおけるカビ毒含有量の低下
ある種の組換え作物の方が食品としての安全性が高いという報告がある。これはBt toxinを発現しているトウモロコシYieldGardの方が野生型の栽培種に比べ含有しているカビ毒(mycotoxin)量が数倍から20倍程度少ないというものである。昆虫などによって摂食された傷口からカビが侵入し繁殖するため、Bt toxinを発現していると摂食されにくくなるためカビ毒が大幅に減少したと考えられている。カビ毒には発ガン性や女性ホルモン活性などを有し、様々な疾患を引き起こすものがあることが知られている。このように現在判明している食品としての安全性検査ではある種の組換え作物の方がむしろ有利であるとの解釈も成り立つ。
ブラジルナッツ 2S アルブミン蓄積ダイズ
ダイズ種子の貯蔵タンパク質のアミノ酸組成では、含硫アミノ酸であるメチオニンやシステインが少ない。そのため、ダイズ・タンパク質の有効利用率を表すプロテインスコアやアミノ酸スコアが低い。そこで、ダイズ種子にメチオニンやシステイン含量の高いタンパク質を蓄積させてタンパク質有効利用率を向上させようという研究が行われた。メチオニン残基が18%、システイン残基が8%と高含量で含まれているため、蓄積させるタンパク質としてブラジルナッツ(Bertholletia excelsa)の2S アルブミン(S: 沈降定数、Svedberg単位)が選ばれた。ただし、既にブラジルナッツなどのナッツ類に対するアレルギーが知られていた。主要なアレルゲンとして分子量9 kDaの2S アルブミンと42 kDa タンパク質、その他の複数のアレルゲンとなるタンパク質があることが判明している。遺伝子組換え作物は、上市される前に安全性審査を経なければならず、その中にはアレルギー試験も含まれている。その審査過程で、ブラジルナッツ 2S アルブミン蓄積ダイズは、一部のブラジルナッツ・アレルギー患者にアレルギーを誘発する可能性があることが判った。一部のブラジルナッツ・アレルギー患者由来の血清中の免疫抗体IgEは、形質転換ダイズ中の9 kDaのブラジルナッツ 2S アルブミンやその前駆体と抗原抗体反応を起こすことが判明した。また、ブラジルナッツ・アレルギー患者に対するアレルギー試験の一種である皮膚プリックテストにおいても同様の結果が得られた。この結果を受けて、この形質転換ダイズの上市は中止された。植物に遺伝子を導入する以前に遺伝子産物に対するアレルギーの確認が可能であったにもかかわらず、商品化の過程の安全性審査で判明したことに問題がある。この件は、導入される遺伝子の産物に対する事前の細心の注意が必要であることと、安全性審査が有効に機能したことを示している。
スターリンク事件
2000年9月以降、アメリカにおいて食品としては未認可であるが飼料としてのみ認可された組換えトウモロコシであるスターリンク(Starlink)(系統名: CBH351)が食品からも検出された事件である。食品としても飼料としても未認可であった日本においても食品から検出された。そのため、大規模な回収騒動が生じた。スターリンクはアグレボ社(事件当時はアベンティス(Aventis)社、現在のバイエルクロップサイエンス社)が開発したものであり、除草剤であるビアラホスに耐性が付与されるとともにBt toxinとしてCry9C(アミノ酸配列)を生産している。Bt toxinには様々な種類があり、そのアミノ酸配列や殺虫スペクトルは異なっている。Bt toxinを生産する組換え作物は様々あるがCry9Cを生産するものが飼料としてのみ認可された理由は、アレルゲンとなる可能性が考慮されたからである[41]。Cry9Cはペプシンやトリプシンに対して安定であり、90℃で10分間安定であった。そこで、調理や消化後も安定であると考えられ、免疫系と反応する可能性が指摘された。一方、既知のアレルゲンとはアミノ酸配列の配列類似性は低かった。タンパク質としての安定性を重視した結果、飼料としてのみスターリンクは認可された。スターリンクのBt toxinのアレルゲン性は低いことがのちに判明した。
この事件の教訓として、隔離栽培の厳守とモニタリングの必要性、飼料としても食料としても利用される作物は厳密に管理されていてもある程度の混入は不可避であるため飼料としてのみではなく食品としても認可されたものを上市する必要性、がある。
ニューリーフ・ポテト
モンサント社のニューリーフ・ポテトはアメリカの環境保護局(U.S. Environmental Protection Agency: EPA)に農薬として登録された。しかし、日本では農薬としては登録されていない。ニューリーフ・ポテトBT-6系統[42]やSPBT02-05系統[43]とはBacillus thuringiensisの結晶性殺虫タンパク質(Bt toxin)の種である一種であるCry3Aを生産してコロラドハムシ(Colorado potato beetle, Leptinotarsa decemlineata)というジャガイモの害虫に抵抗性を持たせたジャガイモのことである。付け加えて、更にある種の植物ウイルスに抵抗性も持たせたニューリーフ・プラス・ポテト[44]やニューリーフY・ポテト[45]の系統も存在する。ニューリーフ・ポテトにおいて生産されているBt toxinであるCry3Aは哺乳類に対する安全性が確認されたタンパク質であり、ニューリーフ・ポテトに関する安全性は様々な安全性試験によって確認されている。農薬を使い害虫駆除をするようなこととは違い、ポテト自体に害虫を殺す作用があるという理由で、ポテト自体が通常の農薬としてEPAに登録された。なお、ニューリーフ・ポテトと同様にBt toxinを生産しているトウモロコシやワタの複数の系統が組換え作物として認可されており、これらにもニューリーフ・ポテトと同様に作物自体に害虫を殺す作用があるが、これらは農薬として登録されたことはない。なお、害虫抵抗性植物に含まれる殺虫活性物質とその生産に必要な遺伝物質(PIPs: Plant-Incorporated Protectants)に対する現在のEPAの方針は、
Plant-incorporated protectants are pesticidal substances produced by plants and the genetic material necessary for the plant to produce the substance. For example, scientists can take the gene for a specific Bt pesticidal protein, and introduce the gene into the plant's genetic material. Then the plant manufactures the pesticidal protein that controls the pest when it feeds on the plant. Both the protein and its genetic material are regulated by EPA; the plant itself is not regulated.
と公表されている[46]ように、EPAは植物の生産する殺虫タンパク質と遺伝物質を規制しているが、それを生産する植物自体を規制してはいない。
ラウンドアップレディー・ダイズを給餌した多世代飼育試験
遺伝子組換え食品の安全性審査においては、急性および亜急性毒性の審査しかしていない、多世代にわたって給餌した際の安全性を調べていない、という批判がある。そこで、ラウンドアップレディー・ダイズの安全性に関しては、多世代の動物飼育における給餌実験によって試験された。例えば、サウスダコタ大学のグループは4世代にわたってマウスにラウンドアップレディー・ダイズを給餌しても、何ら悪影響を見いだすことができなかった、と報告した。また、東京都の健康安全研究センターも2世代にわたるラットへの給餌試験を行ったが何ら有意差を見いだせなかった。同様な研究は多数行われている。2-4世代にわたる多世代飼育実験の世代数が十分かどうかについては異論があるかもしれないが、これらの実験においては少なくともこの世代数では有意な危険性を検出できなかったといえる。
パズタイ事件
一方、健康への影響例としてよく挙げられるものに「遺伝子組換えジャガイモを実験用のラットに食べさせたところ免疫力が低下した。」と世間に大きな衝撃を与えたレポート(パズタイ(Pusztai)事件)がある。1998年8月10日、スコットランドのアバディーン(Aberdeen)のロウェット研究所(Rowett Research Institute)のパズタイ(Arpad Pusztai)が、英国のテレビ番組で、組換えジャガイモにより、ラットに免疫低下などがみられたと公表した。論文は1999年のLancetの10月16日号まで公表されず、主張の妥当性を検証できない状態であったにもかかわらず、一部の間ではさも真実であるかのように受け取られ大騒ぎになった。しかし、公表された論文からは実験そのものがずさんであり、パズタイの主張には無理があることが判明した。使用した遺伝子組換えジャガイモが安全性が確認され商品化されているジャガイモとは全く別なレクチンという哺乳動物に対し有害な作用を持つタンパク質を作る遺伝子を組み込んだ実験用ジャガイモであり、有害な遺伝子を組み込んだ遺伝子組換え作物は有害だったと当たり前の結果が出たに過ぎない。この実験は、マツユキソウの殺虫活性のあるレクチン(GNA)を生産する組換えジャガイモ、親株のジャガイモにレクチンを注入したもの、親株(母本)のジャガイモ、を生のままものと茹でたものに分け、6頭ずつのラットに10日間与えて消化管を調べたところ、炎症や免疫の低下が組換えジャガイモを飼料としたものにみとめられたというものである。なお、レクチン(GNA)を注入されたジャガイモは、遺伝子組換えジャガイモの親株(母本)とは、かなり組成の異なるものであったという報告もある。
この実験には栄養学的な問題や検定数が少ないという問題以前に実験の設計段階での欠陥として、
- レクチンの遺伝子を含まない空のベクターを用いて形質転換した、つまりレクチンを生産しない組換えジャガイモと、更にそれにレクチンを注入した2種類の対照(コントロール)がない。
- 注入したレクチンが複数のレクチンの混合物でないことを証明していない(組換え体は単一の遺伝子に由来するレクチンを生産しているが、実験で用いられたレクチンは単一の遺伝子産物であるという証明がなされていない)。
- 遺伝子組換えと関係がない、組織培養に伴う体細胞変異を考慮していない。(組織培養に伴うトランスポゾンの活性化による変異以外にも、ジャガイモのような栄養繁殖植物の場合、植物体は変異の蓄積した細胞のキメラ集団として存在していることが多い。そのため、何ら変異処理をしなくても単細胞となるプロトプラストにして植物体を再生させると様々な表現型の変異株が得られることがある。)
という点が挙げられる。実験設計の不備のため、この実験によって遺伝子組換え自体によって危険性が増すという結論を導き出すことはできない。この論文に関しても、社会的な問題が大きいから論文の内容にかかわらず掲載することにしたという異例の編集者の意見が明記されて掲載された経緯がある。それには以下のように記されている。
While criticising the researchers' “sweeping conclusions about the unpredictability and safety of GM foods”, he pointed to the frustration that had dogged this entire debate: “Pusztai's work has never been submitted for peer review, much less published, and so the usual evaluation of confusing claim and counter-claim effectively cannot be made”. This problem was underlined by our reviewers, one of whom, while arguing that the data were “flawed”, also noted that, “I would like to see [this work] published in the public domain so that fellow scientists can judge for themselves… if the paper is not published, it will be claimed there is a conspiracy to suppress information”.
この論文に関しては更に著者らとの異例の誌上討論が行われた。そこでは空のベクターを用いていないという指摘に対して、著者らは、
If our experiments are so poor why have they not been repeated in the past 16 months? It was not we who stopped the work on testing GM potatoes expressing GNA or other lectins or even potatoes transformed with the empty vector, which are now available.
と、実験において空のベクターを用いていなかったことを明確に認めている。
背景
上記のような一般消費者の不安の背景として以下のようなことも指摘、主張されている。
- GM作物を推進する側の研究・行政サイドから市民へのGM作物に関する広報活動はこれまで充分であったとは言いがたく、反対派の先行を許してしまったことが今日の混乱を生んだ面がある。
- 一般人の科学知識の欠如により正確にGM作物が理解されていない。
以上2点は、研究開発に関わる側からよくなされる指摘であるが、反対派からは自らの視点が絶対に正しいと決め付けているとの批判もある。
- 遺伝子組換え食品に対して、一般消費者のバージンバイアスがかかっている。経験豊富な事柄に対してはリスクを過小評価するベテランバイアスがかかり、初めてのものに対してはリスクを過大評価するバージンバイアスがかかる傾向がある。
- 先進国の左翼・リベラル派の間で危険論が定着している。
- 「遺伝子組換え作物を人体に危険なものと消費者に訴え、自社商品の売り上げを伸ばそうとする非遺伝子組換え食品商法に走る業者」等[47]のネガティブキャンペーンがある。
- 政府に対する信用が低い。イギリス政府はBSE問題の収拾に失敗し、日本では薬害など厚生労働省の失態や国内でのBSE発生(農林水産省)が報じられ国民の信用が低下していた。どちらの国も遺伝子組換え作物の規制が厳しい。しかし、各国の政府に対する信用と各国の遺伝子組換え作物に対する政策に対する相関性は報告されていない。なお、一般の日本人の遺伝子組換え作物に対する見方は『平成22年度遺伝子組換え農作物等に関する意識調査報告書』において、一般のイギリス人の遺伝子組換え作物に対する態度は"Exploring attitudes to GM food Final Report"において詳しく研究され纏められている。
脚注
注釈
関連項目
外部リンク
- 遺伝子組換え食品 - 厚生労働省
- 生物多様性と遺伝子組換え - 農林水産省
- 遺伝子組換え食品 - 消費者庁
- バイオテクノロジーQ&A - バイオインダストリー協会
- 日本版バイオセーフティクリアリングハウス - 環境省
- バイテク情報普及会
- 遺伝子組み換え情報室
- International Service for the Acquisition of Agri-biotech Applications(英語)