COVID-19の検査
COVID-19の検査(コビッド19のけんさ、英: COVID-19 testing)では、新型コロナウイルス感染症(COVID-19)および新型コロナウイルス(SARS-CoV-2)に関する臨床検査について説明する。COVID-19診断のための臨床検査として、ウイルスの存在を検出する方法(核酸増幅検査, NAAT)、抗体を検出する方法などがある。
米国ガイドラインでは、抗原検査のみを根拠に確定診断することに反対している(エビデンスAIII)。感染が強く疑われる人が抗体陰性であった場合、および無症候の人が抗体陽性であった場合には、追加でNAATを行う事を推奨している。
血液検査
血液検査での確定診断は現時点で困難である。COVID-19患者において約8割にリンパ球減少がみられ、血小板減少、白血球減少がそれぞれ約3割にみられる。CRP上昇、AST上昇、ALT上昇、LDH上昇、D-dimer上昇などもみられることがある。重症例ほど異常値が現れやすい傾向にある。
SARS-CoV-2に対するIgM抗体やIgG抗体を血液から検出するキットが開発され、中国ではCOVID-19の標準診断法としてガイドラインに記載されている。日本でもクラボウより販売されているが、2020年3月17日現在、体外医薬品としての承認を受けていない。
画像診断
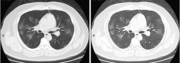
写真付きの論文によれば、CT所見において一般的に両側性のすりガラス陰影と浸潤影を呈することが分かった。また、他の早期診断に有用と思われる特徴として、結節性陰影、網状影、病変の辺縁性分布が挙げられた。一方、空洞、不連続な結節、胸水貯留、リンパ節腫脹は見られなかった。初回CT検査で異常所見がなくても(すなわち陰性でも)、COVID-19の可能性を除外できるとは限らない。
なお、胸部X線撮影からの診断は難しい場合が多いが、人工知能の機械学習によって胸部レントゲン画像から判定を行うアプリケーションソフトウェアが研究開発されており、その中の一つ「COVID-Net」[1] がオープンソースで公開されているものの、まだ未完成となっている。
超音波診断
この節の加筆が望まれています。 |
超音波診断装置による肺エコーをCOVID-19の診断に使える可能性が検討されており、院内感染リスクを減らせる可能性が指摘されている。
ウイルスの存在診断
2021年12月現在、「PCR検査陽性」とは、本項で記述する検査で陽性だったことを指す。
下気道由来検体(喀痰もしくは気管吸引液)または鼻咽頭ぬぐい液を用いてポリメラーゼ連鎖反応(PCR)検査を行うことでウイルスの存在を診断する。検体ごとに陽性率は異なっており、気管支肺胞洗浄液が93%、喀痰が72%、鼻ぬぐい液が63%、咽頭ぬぐい液が32%と報告されている。下気道にウイルス量が多いため、なるべく下気道由来検体を採取する。下気道由来検体を採取する際にはN95 マスク(または DS2 など、それに準ずるマスク)、眼の防護具(ゴーグルまたはフェイスシールド)、長袖ガウン、手袋を装着する。鼻咽頭ぬぐい液を採取する際には、サージカルマスク、眼の防護具(ゴーグルまたはフェイスシールド)、長袖ガウン (不足の場合はエプロン可)、手袋を装着する。検体は三重梱包を行い、公用車・社用車等の自動車または「カテゴリーB」を取り扱う輸送業者を利用して送付する。
検査ツールの開発
この節の加筆が望まれています。 |
- ロシュ
- 2020年1月30日、スイスの製薬会社ロシュは、ウイルスの存在が浮上した時に分子診断医からなる緊急対応チームをスタートさせたと語った。提携先と協力し、スタッフがいれば数時間で診断できる検査ツールを開発した。中国では同ツールの使用に必要なハイテク装置が少なくとも150台必要なことが分かった。この検査ツールの利用に必要なハイテク装置「マグナピュア24」「ライトサイクラー480」などを増産している。
- CDC
- 2020年2月6日、アメリカ疾病予防管理センター(CDC)は、本ウイルスの検査キットを開発し、国内外の検査機関に配布をはじめたと発表した。検査キットは通常のインフルエンザの診断で使用する機器で利用でき、4時間で結果が出る。1キットで700~800の検体を診断できる。それまでは採取した検体を国内の検査機関から受け取ってCDCが診断していたが、各検査機関の中で診断できるようになり迅速化する。
- リアルタイムPCR
- DNAを増幅しながら量も測れるリアルタイムPCRで新型コロナウイルスが検出できるということが報告され、WHOから25,000のキットが159カ国の検査所に送られた。
- 島津製作所
- 2020年3月4日、島津製作所は従来のPCR検査薬に余分な成分の影響を受けないようにする薬品を加えることで前処理を省くことができる検査試薬を開発し、研究用としての供給を行うと発表した。
- 4月10日、試薬キットを20日に発売すると発表した。2時間かかっていたのが1時間になる。月間10万検体分を生産する。5月以降は世界への輸出も考えている。
ウイルス検出手順
国立感染症研究所が2020年2月5日に発表し、その後も改訂を続けている「病原体検出マニュアル 2019-nCoV」によれば、新型コロナウイルスの検出手順の概要は以下のようになる。
検体の取り扱いは、バイオセーフティーレベル(BSL)2+でおこなう。PCR検査法は2019-nCoVの遺伝子領域からオープンリーディングフレーム(ORF)1aとスパイクタンパク質(S)を検出する2-step RT-PCR 法(2ステップ逆転写ポリメラーゼ連鎖反応法)またはリアルタイム one-step RT-PCR 法(TaqMan プローブ法)が使用される。
- RNAの抽出
キアゲン(QIAGEN)社のQIAamp Viral RNA Mini Kit (QIAGEN、Cat.No.52904)を用いるが、他のRNA抽出キットでもよい。
- 2-step RT-PCR 法による定性的検出法
RT-PCRにより目的のサイズのバンドが現れた場合は陰性判定、バンドがあった場合、各施設における1例目についてはシークエンス解析を行ったうえで陽性判定、2例目以降は陽性判定。
- SuperScript IV Reverse Transcriptase (RT) (Thermo:サーモフィッシャーサイエンティフィック)
- Quick Taq HS Dymix (Toyobo:東洋紡)
- PrimeScript RT reagent Kit, Takara RR037A(タカラバイオ)
- PerfectShot Ex Taq, Takara RR005A (タカラバイオ)
- Wizard SV Gel and PCR Clean-Up System, Promega A9281(プロメガ)
それぞれ、類似品を用いることも可能。
- リアルタイム one-step RT-PCR 法(TaqMan プローブ法)による2019-nCoVの検出
リアルタイムPCRでは、反応時間内に増幅曲線の立ちあがりが見られた場合に陽性となる。1つの検体から、プライマー濃度の異なる2サンプル(N、N2)を調整し、各2ウェルで反応させる。N2の一方あるいは両方で陽性の場合、陽性判定。N2が陰性でNのみ陽性だった場合は再試験推奨。N、N2ともに陰性だった場合は陰性判定。
- QuantiTect Probe RT-PCR Kit (QIAGEN Cat#204443)
- AgPath-ID One-step RT-PCR Reagents (Thermo Cat# AM1005)
- TaqMan Fast Virus 1-Step Master Mix (Thermo Cat#4,444,432)
- One Step PrimeScript RT-PCR Kit (Perfect Real Time)(タカラバイオ Cat# RR064A)
- THUNDERBIRD Probe One-step qRT-PCR Kit (東洋紡 Cat# QRZ-101)
- Reliance One-Step Multiplex Supermix(Bio-Rad Cat# 12010220)
2019-nCoV検出に利用できる各反応試薬と機器の組合せが示され、他試薬でも検出感度が担保できれば使用可能。
LAMP法
上述のPCR検査ではないLAMP法でウイルスの遺伝子を増幅する、「Loopamp新型コロナウイルス2019(SARS-CoV-2)検出試薬キット」が、2020年3月31日に承認された。リアルタイム濁度測定装置 LoopampEXIAを使用して増幅から検出までをワンステップで行うことができ、反応は35分で終わる。発売元の栄研化学はLAMP法の特許を持ち、ライセンス契約を結んだキヤノンメディカルシステムズは同年8月3日、反応時間約10分検査ができる「Genelyzer キット」を9月に発売することを発表した。加熱・冷却を繰り返しながら遺伝子を増幅させる必要があるPCR検査にくらべ、一定温度での反応で終わるため安価な装置での検査が可能で、空港など即日検査が必要なケースでの需要も見込む。
簡易検査キット(抗原検査)
抗原抗体反応を利用したイムノクロマト法によりウイルスの抗原を検出できる簡易検査キットの開発が期待されていて、2020年3月8日、台湾で新型コロナウイルス抗原を認識するモノクローナル抗体の作成に成功したことを明らかにした。原理はイムノアッセイで、鼻腔ぬぐい液、鼻腔吸引液、あるいは咽頭ぬぐい液を検体として用い、感染有無を15分から30分程度で判定可能。特殊な機器や技術を必要としないため、健康保険の適用で診療所(クリニック)での迅速検査が可能となる。
既にキット化された抗原は、A型インフルエンザウイルス、B型インフルエンザウイルス、A型β溶連菌、RSウイルス、アデノウイルス、ノロウイルス、ヒトメタニューモウイルス、などがある。
抗原検査
新型コロナウイルスに対する抗体があるかどうかを調べる。陽性であれば、ウイルスに感染したことがあり、その結果、免疫力を獲得したことになると考えられている。
感染に対する免疫反応の一部は、IgMおよびIgGを含む抗体の産生である。これらの抗体は、症状発症後7日程度から始まる個人の感染を検出したり、免疫力を判定したり、集団サーベイランスで使用することができる。
アッセイは中央検査室(CLT)または臨床現場即時検査(PoCT)で実施することができる。多くの臨床検査室で使用されているハイスループット自動化システムは、これらのアッセイを実施することができるが、その利用可能性は各システムの生産速度に依存する。CLTでは末梢血の1検体が一般的に使用されるが、免疫反応を追跡するため、時間経過を追った検体を使用することもできる。PoCTでは、血液の単一検体は通常、皮膚穿刺によって得られる。PCR法とは異なり、アッセイ前の抽出ステップは必要ない。
米国では2020年3月30日までに臨床現場即時検査検査が可能になることが期待されていた。3月9日現在、抗体を検出する血液検査が開発されている。これまでに感染したことがあるかどうかの判定が可能になり、症状が出たかどうかに関係なく機能することが期待されている。IgM抗体とIgG抗体の両方を検出することで、15分で結果が返ってくることが期待されている。
3月下旬、Euroimmun Medical Laboratory Diagnostics社とEpitope Diagnostics社は、血液サンプル中のウイルスに対するIgGおよびIgA抗体を検出できる検査キットの欧州承認を取得した。検査能力は数時間以内に数百サンプルであるため、従来のウイルスRNAのPCRアッセイよりもはるかに高速である。抗体は通常、感染発症から14日後に検出可能である。
各国の検査体制
日本の検査体制
厚生労働省は2020年2月18日、1日に最大3,800人のPCR検査ができる体制を整備したと発表した。しかし、2月18日から2月24日の間に実施された検査件数は約6,300件で、1日平均約900件だったため、各界から実態との乖離があるなどと批判された。
3月1日、国立感染症研究所はPCR検査の拡大を感染研OBが妨害している、検査件数を抑えることで感染者数を少なく見せかけようとしているといった主張は事実と異なり、職員や関係者を不当に扱うもので、対策へ悪影響を及ぼしていると反論した。
3月7日、厚生労働省は、かかりつけ医が必要と考える場合は、すべての患者が検査を受けることができる十分な1日6,000件程度の検査能力を確保しているとし、3月末には8,000件を超えると発表した。
また、PCR検査の医療保険適用によって、帰国者・接触者相談センター(24時間対応)から紹介された帰国者、接触者外来で検査が必要とされたときは、保健所を経由することなく、民間の検査機関に直接、検査依頼を行うことが可能となった。かかりつけの医者が検査が必要と判断した場合には、帰国者・接触者外来を紹介受診し、検査を行う。地域の検査能力に限界があるために断られるということがないようにするとし、同時に、検査時間を大幅に短縮できる新しい簡易検査機器の開発を進めていくと述べた。
また、厚生労働省は疑似症報告制度を採用している。この疑似症報告制度によるPCR検査実施人数には、退院時の確認検査や、疑似症報告に該当しない検査、クルーズ船やチャーター便に関する検査等は含まれておらず、実際の実施総数より少ないことに留意する必要がある。
3月27日現在のPCR検査実施人数の累計は27,005件、確認検査等を含む累計は46,869件(2月18日〜3月25日分)。
また、みなし陽性の制度が2022年より始まった。 更に、2022年より当分の間、東京都が濃厚接触者に抗原検査キットを無償で配布する取り組みを始めている。
中華人民共和国の検査体制
2020年2月14日、中国国家衛生健康委員会副主任・曽益新は、国内の無症状病原体保有者について情報公開の対象外であるとし、保健当局の内部のみで報告すると説明した。PCR検査で陽性であっても発熱や咳のような症状がなければ感染者として発表しないという基準に変更された。2月末時点で中国の無症状感染者4万3000人が統計から除外されており、公式発表の8万人に無症状者を含めると感染者数は12万人を超える。
3月15日に北京大学の姚洋国家発展研究院長は論文で「地方当局者は『新たな感染者を1人でも出せば処分する』という指令を受けている」と異例の指摘をした。湖北省では3月18日-19日に新たな感染者が確認されていないが、中国は感染症鎮圧の目標達成を装うために統計を改ざんしていると指摘された。
韓国の検査体制
2020年3月までに韓国では21万人以上が検査を受け、現在も毎日約2万人を検査している。
イギリスの検査体制
2020年3月までにイギリスでは2万9700人以上が検査を受け、1日の検査人数は1,000人を超える。
アメリカの検査体制
アメリカ合衆国では2020年1月以降、1万1079個の検体が調べられた(CDC発表)。ただ、患者1人が少なくとも2つの検体を提出するのが一般的なため、検査を受けた人数は検体数より少ないとされる。民間の病院での検査はCDCに報告されないケースもあり、当局は全体の把握が難しいとしている。ハーバード大学の医療専門家アシシュ・ジャーは「アメリカは主要国の中で、唯一、感染者がどこで誰と接触したのかを調べるための追跡システムを持っていない」と指摘している。
アメリカは1月、WHOが承認した検査キットの使用を断り、CDCが独自に検査を開発したが、その製造過程において欠陥が見つかり、多くの検査結果が判定不能となった。3月に感染が拡大してからは、検体を取るための綿棒や手袋も不足し、CDCは「十分な器具も人も内部能力もない」「公衆衛生の研究所に対する投資が少な過ぎた」と述べた。
3月12日、アメリカ国立アレルギー感染症研究所のアンソニー・ファウチは、現在の米国の検査体制は必要に即していない、「他の国のように、誰もが簡単に(検査を)受けられるという体制になっていない」と述べた。
また、ワシントン大学病院のアレックス・アダミ博士は、今回の感染症の予防、検査、治療法について「誰も実際に訓練を受けた人はいなかった」と述べ、その結果、院内感染が発生したという。病院は当初、新型ウイルスに対応するスタッフは少ない方が、感染のリスクを限定できると判断していた。アダミ博士は、「他の病院は私たちの例を見て、『どうすれば、もっとうまくいく?』と考えてほしい。国民には私たちの例から、後手後手に回るのではなく早め早めの対応が必要だと学んでほしい」と述べた。
ドイツの検査体制
2020年3月26日時点でドイツにおける検査実施数は週に50万件にのぼる。シャリテ大学病院ウイルス学研究所長クリスチャン・ドロステンは「ドイツで感染者に比して死者がここまで少ないのは、診断検査を非常に大規模に実施している事実によって説明し得る」と述べた。
脚注
注釈
参考文献
臨床ガイドライン
- Coronavirus Disease 2019 (COVID-19) Treatment Guideline (Report). アメリカ国立衛生研究所 (NIH). (2021-01). https://www.covid19treatmentguidelines.nih.gov/.
関連項目
-
2019新型コロナウイルス (SARS-CoV-2)
- 新型コロナウイルス感染症 (COVID-19)
- 新型コロナウイルス感染症の世界的流行
- 抗原検査キット
外部リンク
- 新型コロナウイルス感染症に関する検査について - 厚生労働省
|
新型コロナウイルス感染症 (COVID-19)
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SARSコロナウイルス2 |
|
||||||||||||||||||
| 治療 |
|
||||||||||||||||||
| 感染拡大 | |||||||||||||||||||
| 影響 (コロナ禍) |
|
||||||||||||||||||
| 社会の対応 |
|
||||||||||||||||||
| 組織 |
|
||||||||||||||||||
| その他関連項目 | |||||||||||||||||||