てんかん
| てんかん | |
|---|---|
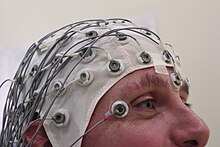
 てんかん患者の脳波。発作が起きた後は特徴的な脳波を示す。
| |
| 分類および外部参照情報 | |
| 診療科・ 学術分野 |
神経学, てんかん学[*] |
| ICD-10 | G40-G41 |
| ICD-9-CM | 345 |
| DiseasesDB | 4366 |
| MedlinePlus | 000694 |
| eMedicine | neuro/415 |
| MeSH | D004827 |
| GeneReviews | |
てんかん(癲癇、Epilepsy)とは、脳内の細胞に発生する異常な神経活動(「てんかん放電」)によっててんかん発作をきたす神経疾患、あるいは症状。神経疾患としてはもっとも一般的なものである。
古くから存在が知られている疾患の一つで、ソクラテスやユリウス・カエサル が発病した記録が残っている。全般発作時の激しい全身の痙攣から、医学的な知識がない時代には、狐憑きに代表される「憑き物」が憑依したと誤認され、「放っておくと舌を噛んで死ぬ」と思われていたり、周囲に混乱を起こすことがあったり、偏見や差別の対象となることもあった。
かつては「子供の病気」とされていた。しかし、近年の調査研究で、老若男女関係なく発症する見解も示され、80歳を過ぎてから発病した報告例もある。一方でエミール・クレペリンは、老年性てんかんに対しては別個のものとして扱っている。
予防や完治は不可能である。しかし、抗てんかん薬を用いることによって、制御可能である。年間の医薬品コストはわずか5ドルにすぎない。しかし、通院、入院、検査には費用がかかり、日本では医療費自己負担額軽減のための制度もある。また、食餌療法によっても発作の軽減や抑制が可能な病気である。

一般人口における有病率は0.4~1.0%ほどで、有病者数は全世界で約5,000万人いると見られており、患者のおよそ80%は発展途上国の国民である。各国の疫学データでは、発症率は人口の1%前後、低中所得国での有病率は0.7~1.4%となっている。
イギリスが発表した資料によれば、年間で「10万人あたり50例」とあり、傷病にかかる費用は「年間20億ポンド」と推定されている。
定義
世界保健機関が発表しているこの病気の定義は、『種種の病因によってもたらされる慢性の脳疾患であり、大脳ニューロンの過剰な放電から由来する反復性の発作(てんかん発作、seizure)を主徴とし、それに変異に富んだ臨床ならびに検査所見の表出が伴う』とされている。これは「大脳皮質の過剰な発射ではない」「反復性でない」「脳疾患ではない」「臨床症状が合わない」「検査所見が合わない」ものは「てんかん」から鑑別するべきだという意味が込められている。日本神経学会のてんかん治療ガイドライン2010では、『てんかんとは慢性の脳の病気で、大脳の神経細胞が過剰に興奮するために、脳の症状(発作)が反復性(2回以上)に起こるものである。発作は突然起こり、普通とは異なる身体症状や意識、運動および感覚の変化が生じる。明らかな痙攣があればてんかんの可能性は高い』と記載されている。
ニューロン(Neurons、脳内に無数にある神経細胞)が興奮することによる不随意運動は、てんかんではない。脊髄性ミオクローヌスや、下位ニューロン障害の線維束攣縮も、てんかんとは異なる。経過が慢性反復性でなければならないことから、薬物中毒の離脱期におこる痙攣はてんかんではない。これらの痙攣に関しては急性症候性発作で述べる。
てんかん発作およびてんかん症候群の分類
てんかんが上記定義された病名である。てんかんの一回ごとの発作をてんかん発作(Epileptic Seizure)という。てんかん発作は痙攣(Convulsion)であることが多い。これは全身または一部の筋肉の不随意かつ発作的収縮を示す症候名である。不随意運動のミオクローヌス、他の症候では、失神との鑑別が必要な症候である。ただ、「痙攣=てんかん」というわけではない。何らかの誘因がある発作、1回だけで反復のない孤立発作、急性の全身疾患や頭部外傷直後に関連して起こった急性症候性発作では、「てんかん」とは診断されない。誘因のある発作の代表例が「ラム発作」で、アルコール依存症の患者が風邪をひいて飲酒をやめると起こる。これらの発作は皮質機能が一過性に障害されたときに起こる正常脳の自然な反応として考えられている。何らかの誘因する原因や機会がないにもかかわらず、反復して2回以上起こったてんかん発作があって、初めて「てんかん」と診断する。
「てんかん症候群」(Epileptic Syndromes)という言葉は、毎回随伴して起こる徴候、症状の組み合わせや病因、誘因因子、発症年齢、重症度および慢性化傾向に特徴づけられる症候群である。脳波・臨床症候群(electroclinical syndrome)とも言われ、若年ミオクロニーてんかん、「West症候群」、「レノックス・ガストー症候群」(Lennox–Gastaut Syndrome)がある。
国際抗てんかん連盟(ILAE)より、1981年度のてんかん発作型分類と1989年度の「てんかん症候群国際分類」が発表されている。てんかん発作型分類は2006年度に改訂され、てんかんおよびてんかん症候群国際分類は、2010年度に改訂されたが新分類普及は遅れている。分類に関しては、てんかん治療ガイドライン2010 の外部リンクを参照されたい。
1981年度ILAEてんかん発作型分類
この発作型分類は、発作症状と脳波所見の忠実な対比から成り立つ。この分類では、発作型および脳波変化が一側半球の部分に局在する「部分発作」(Partial Seizures, 近年は「焦点性発作」〈Focal Seizure〉)と臨床症状が最初から両側半球が巻き込まれたと考えられる「全般発作」(Generalized Sezures)に分類される。部分発作(焦点性発作)はさらに意識が障害されない単純部分発作と意識障害がある複雑部分発作、さらに部分発作から全般性強直間代発作に進展する二次性全般化の3種類に分類される。全般発作は最初から両側半球巻き込まれた症状のみられる発作であり、欠神発作、ミオクロニー発作、間代性発作、強直性発作、強直間代性発作、脱力発作に分けられる。
1989年度ILAEてんかん、てんかん症候群分類
1989年度のILAEのてんかん、てんかん症候群および関連発作性疾患の国際分類は1985年度の分類を改定したものである。発作分類が「現象の記載」であるのに対しててんかん、てんかん症候群分類は「概念の規定」であるという考え方で作成された。四分法分類を特徴としている。てんかん発作が部分発作である局在関連(部分、焦点)てんかん、最初から全般性発作をもつ「全般てんかん」に二分される。もう一つの二分法は、脳腫瘍の病因の明確なてんかんを症候性てんかん、遺伝素因が想定され年齢依存性がみられる以外に病因が見当たらないてんかんを特発性てんかんと区分している。特発性てんかんはおそらくチャネル病ではないかと考えられている。症候性と推定されるものの、現時点では病因が特定できないてんかんを潜因性と区別されることもあるが曖昧な概念であり、用いられない傾向がある。
四分法分類であるため特発性てんかんは全般性てんかんだけではなく部分てんかんもあり、症候性てんかんも部分てんかんと全般性てんかんがある。この4分類では症候性部分てんかん以外は原則的に年齢依存性に発病する。局在関連てんかん(部分てんかん)を示唆する徴候には病因となるような既往歴、前兆、発作起始時、発作中の局所性運動ないし感覚徴候、自動症がある。ただし欠神発作でも自動症が認められることがある。特発性全般てんかんでは25歳以上での発症は稀であり、ほかの神経症状は認められない。これを示唆する徴候は小児期(思春期前まで)の発症、断眠やアルコールでの誘発、起床直後強直間代発作あるいはミオクロニー発作、ほかに神経症候がない発作型である失神発作、脳波で光突発反応、全般性の3Hz棘徐波複合あるいは多棘徐波複合がある。症候性全般性てんかんを示唆する徴候は非常に早い発症、頻回の発作、発症前からの精神遅滞や神経症候、神経症状の進行や退行、広汎性の脳波異常、器質的脳形態異常がある。
局在関連てんかんと全般てんかんという分類はペンフィールドの1954年の著作にさかのぼることができる。ペンフィールドはてんかん発作分類を焦点性大脳発作、中心脳発作、大脳性発作に分類し、これらの発作が症状として起こる疾患をてんかんと定義した。中心脳系とはペンフィールドにより提唱された両側脳半球を対称性に結合し脳機能を統合する構築をいい、高位脳幹で視床、中脳を含む構築とされ、現在の解釈では脳幹賦活網様体から視床に至るヒトの覚醒に関与する部位と考えられている。中心脳発作という用語自体はてんかん発作国際分類には残されていない。てんかん、てんかん症候群分類は抗てんかん薬の第一選択の目安をつけるのに重要である。
てんかん発作の症状
部分発作
部分発作では大脳ニューロンの過剰放電が起こる部位(発作焦点)に応じて大脳皮質機能局在に基づいた症状が起こる。運動発作、感覚発作、自律神経発作や精神発作が知られている。意識障害を伴わない部分発作を単純部分発作、側頭葉に発作焦点をもち意識障害を伴う部分発作を複雑部分発作という。発作焦点が前頭葉皮質の運動領野にあると部分発作として痙攣が生じうる。
単純部分発作
単純部分発作は焦点局在部位によって、「運動徴候を伴うもの」「自律神経症状をともなうもの」「体性感覚症状あるいは特殊感覚症状を伴うもの」「精神症状を伴うもの」に分類される。一次運動野(中心前回)に発作焦点がある場合は対応する片側顔面、上肢、下肢に痙攣が生じる。間代性痙攣は、筋の過剰な収縮と弛緩がある程度規則的に反復されるガクガクとした痙攣である。過剰筋収縮が持続し、肢を伸展、すなわち突っ張るような、あるいは屈曲位を持続するのが強直性痙攣である。強直性痙攣から間代性痙攣に移行するのが強直間代性痙攣である。発作焦点から始まった局所的な大脳ニューロンの過剰放電が一次運動野にそって波及すると、顔の片側に始まった痙攣が同側の手指から前腕、上腕と波及していくことがある(「ジャクソンマーチ」)。痙攣したあとに痙攣した肢が一過性に麻痺することがあり、これを「トッドの麻痺」という。前頭葉眼球運動野に発作焦点がある場合は、眼球と頭部が病巣の対側に回旋するような向回発作が生じる。補足運動野に発作焦点があると、焦点と対側の上枝を伸展挙上し、これを見上げるように眼球と頭部を向ける姿勢発作が起こることがある。
| 運動発作名 | 発作焦点 |
|---|---|
| 焦点性運動発作 | 一次しゅうへn運動野 |
| Jackson型発作 | 一次運動野 |
| 向回発作 | 前頭葉(側頭葉、頭頂葉) |
| 姿勢発作 | 補足運動野 |
| 音声発作 | 補足運動野 |
| 感覚発作名 | 発作焦点 |
|---|---|
| 体性感覚発作 | 一次体性感覚野 |
| 視覚発作 | 後頭葉 |
| 聴覚発作 | 側頭葉聴覚野 |
| 嗅覚発作 | 側頭葉内側 |
| 味覚発作 | 側頭葉内側 |
| 回転性めまい発作 | 頭頂・側頭葉移行部 |
側頭葉内側を発作焦点とする自律神経発作、側頭葉を焦点とする精神発作もある。自律神経発作は上腹部不快感、嘔気、嘔吐、発汗、立毛、頻脈、徐脈といった自律神経症状をきたす発作であり、多くは大脳辺縁系のてんかん焦点に起因する。精神発作は既視感、未視感、恐怖感、離人感といった多彩な症状がある。側頭葉のてんかん活動に起因すると考えられている。精神発作は単純部分発作単独で出現することはむしろ稀であり、大部分は複雑部分発作の最初の症状として出現する。
単純部分発作の発作時、脳波は対応する皮質機能局在領野に始発する局在性反対側性発射であるが、頭皮上から常に記録できるとは限らない。発作発射(seizure discharge)は棘波の律動的発射の場合もあり、それより遅い種々の周波数の突発性律動波であることもありうる。臨床上単純部分発作であっても発作時あるいは発作間欠時に脳波上に焦点性突発波がみられない場合は少なくない。単純部分発作の間欠期の脳波は簡単にいうと局在性反対側発射である。
「正常な脳は何故てんかんを起こさないのか」との問いかけに対して、2007年現在、薬理学では次のような解答が出されている。正常な中枢神経にはニューロンのシグナル活動を微調整する機構が備わっている。それはイオンチャネルの不応期とGABA作用性の介在ニューロンによる周辺抑制という機構である。
部分発作が発生するには「電気活動の亢進による細胞レベルでの発作開始」「周辺ニューロンとの同期」「脳の隣接領域への伝播」の3つの過程がある。発作開始時はある一群のニューロン内部で発作性脱分極性変位(PDS)が起こる。この脱分極は200msに及び、これが発生するとニューロンは活動電位を非常に早く連続的に発生するようになる。局所的な放電の場合、周辺抑制のため焦点に閉じ込められた放電が無症状に終わる。周辺抑制を乗り越えるにはGABA抑制作用の低下、ニューロン発火の増加による細胞外カリウム濃度の上昇、NMDAチャネルの開口が考えられている。周辺抑制を乗り越えると、同期放電が出現して症状が発現する。このときの同期放電が十分に強いと、隣接領域へ同期発火が伝播する。この伝播が前兆として知覚される。そして、皮質領域を結び付ける「U fiber」、脳梁、視床皮質投射線維を介して全体に広がることがある。
周辺抑制が認められる場合、「発作は起こらない」と考えられている。これらの機構が破綻する原因の一つに「癲癇発作がある」と考えられており、一部のてんかんにおいては、ナトリウムチャネルの異常が指摘されている。
複雑部分発作
複雑部分発作は意識障害を伴い、あとで健忘を残す。単純部分発作で始まり、途中から意識障害を起こす場合と最初から意識障害を伴う場合がある。精神運動発作とほぼ同義であるが、一部重ならない点もある。複雑部分発作は、側頭部あるいは前頭、側頭部の皮質、皮質下領域(嗅脳、辺縁系を含む)の一側性または両側性の損傷によって発生する。側頭葉てんかんとも関連する。
発作中に話しかけても、患者は応答できない。発作の持続時間は2~3分程度である。多少なりともまとまっているものの、適切な目的性を欠く一連の動作、表情、行動が不随意的、無意識に生じることがあり、「自動症」と呼ばれる。代表的なものは、舌なめずりや舌打ち、もぐもぐと口を動かす、ごくんと飲み込むといった口部自動症である。そのほか、顔や身体をなでたり、こすったり、衣服をまさぐったり、手をもんだりの身ぶり自動症もある。自動症は、複雑部分発作中あるいは発作後もうろう状態に認められ、患者本人はその記憶がないか、あっても断片的、部分的である。てんかん活動が基底核に伝播することで発作起始側と対側上肢にジストニア肢位をきたす。約80%は発作起始焦点が側頭葉にあるが、隣接部位から側頭葉へのてんかん活動の伝播でも生じる。前頭葉に起始焦点のある複雑部分発作について、側頭葉起始発作と比較すると、発作持続時間が短い、激しい自動症をきたす、発作頻度が多いの特徴がある。
側頭葉てんかんでは、発作発射が側頭葉皮質、島の皮質から辺縁系(海馬、扁桃体)にいたる投射路を限局性に侵襲すると単純部分発作、すなわち精神発作(錯覚、幻覚)が出現する。これを「外側側頭葉発作」という。発射が辺縁系に広がると複雑部分発作とくに自動症を伴うことになる。これを「扁桃体・海馬発作」という。複雑部分発作の発作間欠期の脳波は、一側性、あるいは両側性、大抵は非同期性の焦点があり、焦点は側頭部あるいは前頭部に出現する。発作時脳波は一側性の、あるいは両側性の発射で、広汎性あるいは側頭部、側頭・前頭部に焦点性に出現する。
二次性全般化
部分発作から二次的に全般化した発作であり、主に「強直間代発作」がある。二次性全般化発作は、単純部分発作から強直間代発作、複雑部分発作から強直間代発作、単純部分発作から複雑部分発作を経て強直間代発作の3つが考えられる。単純部分発作か、複雑部分発作か、明確には区別できない場合もある。
全般発作
全般発作は最初の臨床的徴候が、発作開始時に両側の半球が侵襲されていることを示す発作である。意識障害が起こる場合もあり、これが発作開始時の症状である場合もある。運動現象は両側性である。発作時脳波像は発作開始時両側性であり、これはおそらく両側半球に広汎に広がっているニューロン発射を反映している。全般性てんかんはてんかんの国際分類では特発性で発症が年齢依存性のもの、潜在性、症候性、症候性の3つに分かれる。特発性で発症が年齢依存性のものには、欠神てんかん、若年欠神てんかん、ミオクロニーてんかん、大発作てんかんが含まれる。症候性のものには、ウエスト症候群、レノックス・ガストー症候群、ミオクロニー・失立てんかん、ミオクロニー欠神てんかんが含まれる。てんかん発作の国際分類では、全般発作は欠神発作(定型、非定型)、ミオクロニー発作、間代発作、強直発作、強直間代発作、失立発作に分類できる。本稿ではてんかん発作の分類に従い解説する。
欠神発作
欠神発作の純粋な型は突然始まり数秒から30秒ほど持続し、突然終了する。それまで行っていた諸活動の中断、空虚な凝視、場合によっては短時間の眼球上転が認められる。会話中の場合、会話は中断され、歩行中ならばその場に立ちすくみ、食事中ならば食物が口に運ばれる途中で止まる。発作中に話しかけると、場合によってはぶつぶつとつぶやくことはあるが普通は応答できない。欠神発作には6つの亜型があり、意識障害だけを示すもの、意識障害に自動症をしめすもの、ミオクロニー要素を伴うもの、脱力要素をもつもの、強直要素をもつもの、自律神経要素をもつものが知られている。各亜型は単独も複合もある。いずれの発作型でも、普通は発作中は規則正しい左右対称性の3Hz棘徐波複合が出現する。2~4Hz棘徐波のことや多棘徐波複合のこともある。異常悩波は両側性である。発作間欠期では、基礎律動は正常であるが、棘波、棘徐波のような突発波が出現することもある。脳波異常は賦活されやすく、過呼吸で容易に誘発される。睡眠や「Pentetrazol」や「bemegride」でも誘発できる。非定型欠神発作は定型欠神発作よりも顕著な筋緊張変化を伴うことが多く、発作の起始と終了が突然ではないという特徴がある。脳波も定型失神発作よりも多彩である。小学生の場合、「授業中に集中力が低下した」と間違われることもある。
ミオクロニー発作
ミオクロニー発作はミオクロニー痙攣と間代発作に分けられる。
- ミオクロニー痙攣
ミオクロニー痙攣は、突然起こる短時間の衝撃様の筋収縮で全般性のこともあり、顔面、体幹、1つあるいはそれ以上の肢、個々の筋あるいは筋群に限局することもある。この発作は急速に反復したり、比較的孤立して出現することもあり、ときに1~2秒の意識消失を伴うことがある。ミオクロニー痙攣は単独で起こることもあるが、同時に全般強直間代発作を伴う場合もある。ミオクロニー痙攣の発作時脳波としてふつうは多棘徐波あるいは時に棘徐波や鋭徐波が出現する。発作間欠時にも発作時と同様に突発波が認められるため、脳波上突発波が認められても発作が起こっているとは限らない。ミオクロニー痙攣は、外的刺激によって誘発されやすい。突然の音響、睡眠で誘発されるが、光刺激に対してはとくに敏感である。ミオクロニー発作をおこすてんかんには、乳児良性ミオクロニーてんかん、若年ミオクロニーてんかん、ミオクロニー欠神てんかん、ミオクロニー失立てんかん、乳児重症ミオクロニーてんかんが知られている。乳児良性ミオクロニーてんかんは1~2歳に起こり、睡眠初期に全般性棘徐波の短い群発が認められる。若年ミオクロニーてんかん(衝撃小発作)は思春期に起こり、発作間欠期、発作時は周波数の速い全般性棘徐波あるいは多棘徐波である。光過敏性であることが多い。ミオクロニー欠神てんかんでは、小児欠神てんかんと同様な両側同期性、対称性の3Hz棘徐波が出現する。ミオクロニー失立てんかんでは、最初は4~7Hzの律動のほかは正常であるが、不規則性棘徐波あるいは多棘徐波を示す。乳児重症ミオクロニーてんかんでは、全般性あるいは一側性の間代発作、ミオクロニー痙攣を起こし、脳波は全般性棘徐波、多棘徐波、焦点性異常、光過敏性を示し、きわめて難治性である。
- 間代発作
間代発作はミオクロニー痙攣が律動的に反復するものである。発作時脳波は10Hz以上の速波と徐波、場合によっては棘徐波であり、発作間欠期には棘徐波あるいは多棘徐波が出現する。
- ミオクローヌスてんかん
ミオクロニー発作と区別が必要な用語である。初期はミオクロニー発作と区別がつきにくいが、ミオクローヌスてんかんは症候群であり、歯状核赤核淡蒼球ルイ体萎縮症の若年型がこの症候群を呈する。ミオクロニー痙攣、全身性痙攣、認知症を示す。
強直発作
数秒程度の比較的短時間の強直状態が起こる発作であり、意識障害も起こるが、回復は早い。眼球や頭部が一側に偏位し、胸部の強直痙攣で呼吸が停止することがある。乳幼児期てんかんに多く、代表疾患はウエスト症候群とレノックス・ガストー症候群である。ウエスト症候群は発作時は、低振幅速波ないし脳波の脱同期、間欠期はヒプスアリスミアが認められる。レノックスガストー症候群の場合、発作時は20Hz前後の速波性同期波や漸増律動が認められ、間欠期は鋭徐波が多少とも律動的な発射で出現する。
強直間代発作
特発性全般性てんかんによるものと、症候性全般性てんかんによるものとがある。部分発作が発展して二次的に全般化し、強直間代発作を示すこともある。従来は部分発作の二次性全般化による発作も強直間代発作とし、部分発作の症状を前兆として扱っていたが、国際分類では、二次性全般化はあくまで部分発作として扱い、最初から全般性に始まる強直間代発作と区別している。一部の患者は発作に先立って形容しがたい予告を体験するが、大部分の患者では予告症状なしに意識を失う。突然急激な強直性筋収縮が起こり、地上に倒れ、舌を噛んだり、失禁したり、チアノーゼが起こることもある。その後間代痙攣段階に移行する。間代痙攣後、筋弛緩を経て意識障害を起こす。発作時は10Hzあるいはそれ以上の律動波が強直期の間は次第に周波数を減じ、振幅を増やし、間代期になると徐波によって中断されるというパターンをとる。発作間欠期には多棘徐波あるいは棘徐波、鋭徐波発射が認められる。全般強直間代発作だけを持つ患者では、ほかの発作型に比べて突発波の出現率がもっとも低く、1952年のギブスの検討では安静時22%、睡眠時46%にしか突発波は認められなかった。
脱力発作
筋緊張の突然の減弱が起こるものである。部分的で頭部が前にたれ下顎がゆるんだり、四肢の一つがだらりとしたりする場合もある。すべての筋緊張がカタレプシーのように消失して倒れてしまったりする。これらの発作がきわめて短い場合、「転倒発作」という。意識は消失するとしても短時間である。持続が長い脱力発作では、律動的、連続的に弛緩が進行するという形で進行する。欠神発作の症状として起こることもある。発作時脳波は多棘徐波、平坦化あるいは低振幅速波が出現する。発作間欠期は多棘徐波が出現する。
てんかん重積
国際抗てんかん連盟(International League Against Epilepsy, ILAE)では、「発作がある程度の長さ以上に続くか、または短い発作でも反復しその間の意識の回復がないもの」と定義されている。実際には5~10分程度発作が持続するか、2回以上の発作が起こり、その間に意識が完全に回復しない場合は「てんかん重積」と診断している。動物実験では、「発作が5分続けば脳損傷が起こる」とされており、早期治療が重要である。治療抵抗性のものが3~4割あり、1か月以内の死亡率は7~38%である。てんかん重積には、痙攣性発作が持続する「全身性痙攣性てんかん重積」(Generalized Convulsive Status Epilepticus、GCSE)と、「非痙攣性てんかん重積」(Non Convulsive Status Epilepticus、NCSE)が知られている。
てんかん重積の治療では、まずは発作(痙攣、意識障害、行動異常)を止める。発作が治まったあとに維持療法をおこない、治まらなければ次の治療に移行する。「てんかん治療ガイドライン2010」にはフローチャートがある。
全身痙攣性てんかん重積
てんかん治療ガイドライン2010にて、フローチャートにまとまっている。
- 気道確保、酸素吸入
てんかん重積を放置すると低酸素脳症を起こすため、まずは気道確保と酸素投与が必要である。
- 初期薬物投与
末梢静脈確保ができない場合、ジアゼパム10mgの筋注か注腸、ミダゾラム10mgの口腔粘膜投与や点鼻が行われる。血管の確保ができている場合、ビタミンB1(アリナミンF)100mgを投与し、その後に50%ブドウ糖50mlを投与する。そのうえで、成人であればジアゼパム10mgを呼吸抑制に注意しながら2分くらいかけて静注する。小児なら、0.3~0.5mg/Kg投与する。ジアゼパムは生理食塩水やブドウ糖に混ぜると混濁するため、希釈せずそのまま静注する。5~10分で発作が治まらないようなら、ジアゼパム10mgの追加投与またはフェノバルビタールかミダゾラムの静注を行う。ジアゼパム単独の発作抑制時間は20分程度とされているため、フェニトイン(アレビアチン)やホスフェニトイン(ホストイン)を22.5mg/Kgの投与を行う。
- 全身麻酔療法
初期薬物投与を行っても治まる気配がない場合、脳波をモニタリングしながら全身麻酔療法を実施する。バルビツール酸系薬ではチオペンタールやチアミラールが使われる。ベンゾジアセピン系であるミダゾラムのほか、プロポフォールも用いられる。てんかん重積の3~4割は、全身麻酔が必要とされる。
非痙攣性てんかん重積
全身痙攣性てんかん重積と同じく、意識障害や異常行動が一定期間以上続くか、2回以上の発作の間に意識が完全に回復しない場合にそのように診断し、その際に脳波上で発作波が持続しているかどうかを確認する。発作の出方は欠神発作重積、単純あるいは複雑部分発作重積、潜在性てんかん重積である。基礎疾患はてんかん以外に脳炎、血管障害、脳腫瘍、代謝性脳症でも発症する。脳波異常が持続している場合、全身痙攣性てんかん重積の場合と同様の治療を行う。
てんかん発作の誘因
てんかん発作の誘因となるものが以下のように知られている。痙攣については、条件が重なればてんかん患者でなくとも起こりうる。てんかん発作後はこのような誘因をできるだけ除去するのが重要と考えられる。
- 光刺激
1946年、W. Grey Walterによって科学雑誌『Nature』で発表され、1秒間に20~50回程度の光の明滅で発生する。1997年、『ポケットモンスター』の放送中に激しい光の明滅効果により、多くの学童が光過敏性発作を起こし、社会問題に発展したことがある(→ポケモンショック)。
- 飲酒
飲酒をせずとも、酔いから覚める際にてんかん発作は起こりやすくなる。アルコールを常飲していた者が断酒しても、てんかん発作は起こりやすい。当事者が単独で飲酒を発作の原因とするならば、「発作になるかもしれない」とする不安感からくるものが代表的である。抗てんかん薬には プラシーボ効果 はないが、発作予兆の不安感を拭い去ることは可能な場合もある。
- 身体的ストレス
過度の疲労、睡眠不足、感染症のような急性疾患でもてんかん発作は起こりやすくなる。スポーツのあとに起こることもある。首を上に傾けている動作が長く、それの継続が発作につながる要素の一つであるという報告もある。高血圧の患者の対処方法の中には「首の後ろを温めることで貧血を防ぐ」、これの応用で、血流を回復させる方法が提案されている。応急対処には「冷たい物の飲食で心拍数を下げる」、これの応用で焦りからくる精神的不安感に近い傾向を身体的に回復させるという提案がなされている。
- 心理的ストレス
「発作が起こるのではないか」という精神的不安感や、転校やクラス替えによる環境変化、勤務先での異動や仕事の内容の変化、旅行や電車・車移動における環境変化など、他人からすればささいな要素であっても発作を起こすきっかけになりうる。一人の患者に絞る場合、精神的不安感による発作の火種は、一部の状況や状態に特定される場合があり、当事者が回避する必要のある場面に気付くことと、それを生活上の習慣に取り組むことで、発作の頻度は減る場合がある。しかしながら、同時に猶予時間や娯楽範囲も削減するため、それを察知した当事者はリスクを回避するか追及するか、優先順位を決断する。
- 睡眠不足
睡眠不足(ノンレム睡眠の不足)に伴う疲労回復が不十分であったり、服薬効果のバランスが乱れることも発作の原因となる場合がある。
- 薬剤投与
アルコール、バルビツール酸系薬、ベンゾジアセピン系薬物の離脱時、抗うつ薬(イミプラミン、アミトリプチン、軽微ながらSSRI)、抗精神病薬(クロルプロマジン)、気管支拡張薬(アミノフィリン、テオフィリン)、抗菌薬(カルバペネム系抗菌薬、抗菌薬とNSAIDSの併用)、局所麻酔薬(リドカイン)、鎮痛薬(フェンタニル、コカイン)、抗腫瘍薬(ビンクリスチン、メソトレキセート)、筋弛緩薬(バクロフェン)、抗ヒスタミン薬、ステロイド。これらの薬剤が、「てんかん発作の閾値を下げる」とされる。
難治性てんかん
てんかん患者の7割以上は、発作が抑制され、普通の生活を営める可能性はある。抗てんかん薬を2~3種類か、併用しての療法で、かつ十分な量で2年以上治療しても発作が1年以上抑制されず、日常生活に支障をきたす場合、「難治性」(Refractory)とみなされる。Kwanらの報告では、「最初に使用した抗てんかん薬で発作が抑制される患者が47%、2剤目または3剤目になると13%、2剤併用では3%」とされている。
検査
脳波
硬膜外電極記録も用いられることがある。脳波検査のみでてんかんの診断を行ってはならない。通常の脳波検査のみで診断が難しい場合、通常検査を繰り返すよりも、睡眠時脳波検査を行うべきである。発作のパターン、異常のもととなる脳の部位を特定するためには、長期脳波ビデオ同時記録検査が用られる。
脳磁図
画像検査
CT、MRI、拡散テンソル画像、PET、シンチグラフィ、NIRS脳計測装置、SPECT、MEGがおこわなわれる。
血液・尿検査
血液・尿検査も、てんかんの診断に欠かせない。「痙攣発作の血清マーカー」としてはCKの他に乳酸やプロラクチンが知られている。強直間代発作の場合、CK上昇の感度86%、特異度75%であり、プロラクチン上昇の感度47~76%、特異度85~100%と報告されている。プロラクチンは痙攣後15分から60分ほどで上昇が認められ基準値の2倍以上で異常と考えられている。
診断
てんかんの診断は「てんかんか否かの診断」、「てんかん発作型の診断」、「てんかん症候群の診断」の3ステップからなる。
てんかんか否かの診断
てんかんの症状は、痙攣を含めた一過性の神経症状である。「てんかんか否かの診断」では、意識障害をきたす多くの疾患、転倒、外傷、一過性の運動、感覚症状、低血糖、多くの痙攣をきたす疾患の鑑別が必要である。意識消失、痙攣発作として受診する患者の3大疾患がてんかん発作、失神、非てんかん性心因発作でありfits、faint、funnu turnsの頭文字から3Fといわれる。
- 失神
失神では意識消失が短く、通常は1分以上続くことはない。低血圧が原因の場合は目の前がだんだんと暗くなるといった特徴的な前兆が認められる。意識の回復は速やかであり、発作後の朦朧状態、頭痛、筋痛、舌咬、尿失禁はない。不整脈によるアダムス・ストークス症候群を疑った場合、心電図や心臓超音波検査が必要となる。
- 非てんかん性心因性発作
ヒステリー発作、偽痙攣(Pseudoseizure)、心因性の発作という場合もある。心因性発作は、てんかん患者の5~35%に認められるとされる。薬剤無効の発作の35%程度が、心因性発作ともいわれている。痙攣と心因性発作の鑑別点を以下にまとめる。
ある発作が心因性と診断できたとしても、同一個人のすべての発作が心因性と診断することはできないため、注意が必要である。首の規則的な反復的な左右への横ふり、発作の最中に閉眼している、発作中に泣き出す、発作出現に先行して1分以上の閉眼や動作停止を伴う擬似睡眠状態が出現する。これらの場合、心因性発作の可能性が高い。発作後、血中のプロラクチン濃度が上昇している場合は痙攣であった可能性がある。偽痙攣の場合、発作時の脳波は正常である。
| 痙攣 | 心因性発作 | |
|---|---|---|
| 頭部の動き | しばしば肩峰に引っ張られるように動く | しばしば左右にふる(中央を超えて左右にふる) |
| 四肢の動き | 通常は同調率で動く | しばしばバラバラに動く |
| 骨盤の動き | 通常ない | しばしば前後に動く |
| 瞳孔 | 散大、対光反射消失 | 正常 |
| 開眼操作に対して | 通常抵抗なし | しばしば抵抗する |
| 頭位変換眼球逃避 | なし | あり |
| アームドロップテスト | 通常回避なし | 通常回避 |
| 腹筋の緊張 | あり | なし |
| 口 | 開口していることが多い | ぎゅっと閉じている |
| 発作中に話す | 絶対にない | しばしばある |
| 痙攣後もうろう状態 | あり | しばしばなし |
| 痙攣時の記憶 | なし | しばしばあり |
| 舌咬症 | 舌縁でみられることが多い | 舌先で多い |
| 尿失禁 | ありうる | ありうる |
| 便失禁 | ありうる | 通常なし |
- 急性症候性発作
急性症候性発作(Acute Symptomatic Sezure)は、てんかん発作ではあるが慢性疾患のてんかんとは異なる。国際抗てんかん連盟では、「急性症候性発作とは急性全身性疾患、急性代謝性疾患、急性中毒性疾患、急性中枢神経疾患(感染症、脳卒中、頭部外傷、急性アルコール中毒、急性アルコール離脱)と時間的に密接して関連して起こる発作である」と定義されている。急性疾患と同時に痙攣が一回だけ起こるが、急性疾患が再発した場合は痙攣が再発したり重積となったりする。抗てんかん薬の内服が長期に及ぶことは少ない。すなわち、原因となる状態が改善すれば発作は起こらなくなるため、抗てんかん薬は不要となる。脳炎、脳外傷、脳出血のような急性症候性発作および後遺症としてのてんかんを引き起こす可能性がある疾患では、いつまで治療するべきがの判断は難しい。
| 原因 | |
|---|---|
| 脳血管障害 | 脳血管障害から7日以内に起こる発作 |
| 中枢神経系感染症 | 中枢神経系感染症の活動期に起こる発作 |
| 頭部外傷 | 頭部外傷から7日以内に起こる発作 |
| 代謝性 | 電解質異常、低血糖、非ケトン性高血糖、尿毒症、低酸素脳症、子癇、全身性疾患に関連して起こる発作 |
| 中毒 | 麻薬や処方薬、アルコール |
| 離脱 | アルコールや薬物の離脱時 |
| 頭蓋内手術後 | 頭蓋内脳外科手術の直後に起こる発作 |
| 脱髄性 | 急性散在性脳脊髄炎の急性期に起こる発作 |
| 多因性 | 同時に起きたいくつかの状況と関連した発作 |
- 一過性脳虚血発作(TIA)
一過性脳虚血性発作では、局所性の神経脱落症状を伴うのが通常のため、鑑別は容易である。しかし、TIAの運動症状として不随意運動をきたす場合、鑑別が難しい場合がある。トッドの麻痺と脳梗塞の麻痺の鑑別は、脳波とMRIで鑑別する。
- 一過性全健忘
- 過呼吸発作
- 熱性痙攣
通常は生後3か月から5歳までの間に発熱に伴って生じるものであり、中枢神経の感染に基づくものではない。短期間の単発性の熱性痙攣がほとんどであり、医療機関受診時には治っている場合がほとんどである。発熱と痙攣が持続する場合、髄膜炎の可能性もあり、髄液検査が必要となる。
てんかん発作型の診断
発作型の診断は1981年度ILAEてんかん発作型分類で行われる。てんかん発作を医師が診察室で観察できることはきわめて稀である。そのため病歴と脳波を中心に発作型の診断をすることになる。
- 本人からの病歴
単純部分発作や全般発作であっても、ミオクロニー発作の場合は意識が保たれており、患者との会話は可能である。感覚発作、自律神経発作の多くは二次性全般化するため、部分発作の症状を前兆(アウラ)として感じる。前兆に関しては、腹部にこみ上げてくるような感じや、以前見たことのある風景が勝手に頭に浮かぶといった症状を改めて問いただすと明らかになる場合も多い。前兆を「当たり前」と思い述べない患者が一定数存在する。既往歴としては、外傷、脳炎、脳血管障害既往、熱性痙攣の有無が特に重要となる。すでにてんかんと診断されている場合、発症年齢、持続時間、回数、症状、局所徴候(半身痙攣、トッド麻痺)、治療経過を聴取する。家族歴も強調されているが、遺伝歴のあるてんかんは約1割程度である。
- 目撃者からの病歴
どのような発作であったのかを目撃者に尋ねる。強直間代発作は、通常は60~90秒であることが、ビデオ脳波モニター検査で明らかになっている。はじめててんかん発作を目撃した人は、1~2分間の発作に対して5分位に感じていることも珍しくない。可能ならば、患者が発作を起こしているときの状態を録画して医療機関に提出する。
強直間代性痙攣の経過について。まずは意識消失に伴う突然の痙攣が起こる。これは開口、開眼と眼球上転、上枝は外転挙上し、肘は屈曲位で前腕は回内する。次に強直相であり、10~20秒ほど持続する。四肢は伸展し、呼吸筋の強直により、肺からの空気が閉鎖した声帯を通って強く呼出される際に叫び声をあげることがある。呼吸停止とチアノーゼも認められることがある。間代相の持続は、30秒前後が多い。間代性痙攣の感覚は次第に長くなり、終焉する。咬舌はこの時期に起こる。自律神経症状として、頻脈、血圧上昇、瞳孔散大、流涎、発汗過多がみられる。間代相は深い呼気をもって終わり、その後、回復期になる。このとき呼吸は再開し、対光反射も回復するが、痙攣後の意識障害は持続する。
てんかん症候群の診断
年齢、てんかん発作型、検査所見をもとに、てんかん症候群の診断を受ける。ウェスト症候群、レノックス・ガストー症候群、小児良性部分てんかん、小児欠神てんかん、若年性ミオクロニーてんかん、内側側頭葉てんかんが知られている。
管理
てんかんの治療のガイドラインとしては、日本神経学会のてんかん治療ガイドライン2010のほか、日本神経治療学会の高齢発症てんかんのガイドライン、日本てんかん学会のガイドラインが知られている。てんかん治療ガイドラインはてんかんを専門としない一般医を対象としているのに対し、日本てんかん学会のガイドラインはてんかん専門医レベルを対象としている。てんかん治療ガイドライン2010を念頭に記載する。
救急診療
まず、救急患者の前に来たとき、痙攣が持続しているか否かを確認する。痙攣発作はたいていは数分で消失するが、なかには数十分続く「痙攣重積」もある。痙攣中は呼吸が満足にできず、持続すると低酸素脳症を起こす恐れがあるため、痙攣を止める必要がある。痙攣発作中の患者には、まずBLS、ACLSのアルゴリズムに従い、救命を行う。このとき、低血糖、心室細動の診断も同時に行う。低血糖であれば、50%ブドウ糖20mlを2A(40ml)静注し、心室細動であれば電気的除細動を行う。次に考えるのはヒステリーによるもの(偽痙攣という)であるかどうかであるが、これは経験的に診断することが多く、疑わしければアームドロップテストを行う場合もある。偽痙攣が否定されれば、真性痙攣の治療となる。患者の意識がすでに回復している場合や、身元やかかりつけの病院や健康管理が明確になっている場合、体温、血圧、心拍数の検査を行ったのち、隊員の判断により、患者に署名してもらい、自宅への帰宅を優先することもある。
- 酸素投与、あるいはバックバルブ換気を行う
- ジアゼパム(10mg/2ml/A)を1A筋注あるいは0.5A静注する。止まらない場合、3~5分ごとに5mgずつ、最大20mg(2A)まで投与する
- 小児の場合にはミダゾラム口腔用液を年齢に準じて口腔粘膜へ投与する。(1歳未満の患者には 2.5mg、1歳以上5歳未満では 5mg、5歳以上10歳未満では 7.5mg、10歳以上18歳未満では 10mgを頬粘膜投与する。)
- 痙攣が止まったら痙攣再発予防のためアレビアチン(250mg)(抗痙攣薬フェニトイン)を2A(500mg)、生理食塩水100mlに溶解して点滴する
ごくまれに、ジアゼパムを20mg投与しても痙攣が治まらない場合がある。この場合はアレビアチンの点滴を開始する。これでも止まらなければ、テグレトールを50~100mg(1Aに500mg含まれているので注意)静注したり、フェノバルビタール(100mg/A)を1A筋注することもある。それでも治らなければ、気管挿管を行って低酸素を防ぎ、専門医に相談する。アレビアチン(フェニトイン)は2A以上でなければ効果はないと言われる。これはナトリウムチャネルが不活化状態から回復する頻度を減らす作用がある。しばしば用いられる抗てんかん薬であるデパケン(バルプロ酸)もこの作用を有しているが、こちらはカルシウムチャネルにも作用する。
発作が止まったら、原因検索と外傷検索を行う。採血を行い血算(血球算定)、生化学検査を行い、アルコール濃度や抗てんかん薬血中濃度を測定する。動脈血液ガスにて代謝性アシドーシス(筋肉の収縮で嫌気性呼吸が起こるため)の有無も確認する。頭部CTや尿中薬物検査も行う。これらの検査で異常があれば「症候性てんかん」と診断され、異常がなければ真性のてんかんである。
診断ができれば、それに基づいて治療を行う。原則として、初発の痙攣では入院による精査が望ましい。てんかんでもっとも怖いのは痙攣後外傷である。危険だと判断したら、ためらわず入院させるが、患者の希望によっては後日に脳波検査となる。てんかんは発作型によって治療薬が異なるが、この場合は抗てんかん薬の予防投与となる。それ以外の真性てんかんで受診となる事例としては、癲癇発作が制御不能になること。これは非常に危険であり、入院精査が必要になる。怠薬の場合はアレビアチン投与後、服薬を再開する。今までコントロール良好であったのに痙攣した場合は、抗てんかん薬を増量し、かかりつけ医に受診させるという方法もある。症候性てんかんの場合は原因疾患を治療すれば完治できる可能性がある。可能ならば原疾患を治療し、抗てんかん薬を投与し、診断に合わせて専門医を受診させる。
薬物療法
急性の脳損傷、代謝性要因、炎症、中毒、薬剤性による原因、誘因が明らかな急性症候性発作の再発率は3~10%程度と低く、原因、誘因を避けることにより、経過観察が可能な事例も多い。誘因がはっきりしないてんかん発作の再発率は30~50%と高く、各々の症例に応じて治療開始を検討する。初回の発作から5年以内の再発率は35%であるが、2回目の発作から1年以内の再発率は73%と高い。一般に、てんかんは2回以上の発作後に治療を開始する。個発発作でも神経学的異常(トッド麻痺)、脳波異常ないしてんかんの家族歴陽性の場合は再発率が高くなるため、治療開始を考慮する。高齢者の場合、初回発作後の再発率が66~90%と高く、初回発作後に治療を開始することが多い。初回発作、再発1回目、再発5回目で治療を開始し、その後、2年までは発作抑制率に若干の差があるが、長期的には有意差は無い。
抗てんかん薬の選択を左右する因子となるのは、発作型、てんかん症候群、年齢、性別、併存疾患、抗てんかん薬の効果と副作用、ガイドラインでの位置づけ、費用、保険適応によって決定する。
WHOが発表しているガイドラインでは、単剤の抗てんかん薬で治療を開始するとされており、NICEのガイドラインでは、可能な限り単剤処方でなければならない(should)と勧告されている。NICEは、ある薬剤での初期治療が失敗した場合、別の薬剤を単剤処方で試すよう勧告している。
大麻由来の抗てんかん薬である「エピディオレックス」がアメリカ合衆国で承認されたことで、沖縄赤十字病院では治療の選択肢として要望が高まった。しかし、大麻取締法では4条2項2号において大麻から製造された医薬品を施用等を禁止し、同法同項第3号では、大麻から製造された医薬品の施用を受けることを禁止している。大麻取締法では「医薬品」の定義はされていないものの、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律2条1項」において医薬品の定義がなされており、同法同項第3号において「人又は動物の身体の構造又は機能に影響を及ぼすことが目的とされている物であつて、機械器具等でないもの(医薬部外品、化粧品及び再生医療等製品を除く。)」とされていることから、規制薬物である大麻の施用は違法行為となる。
大きな転機となったのは、2019年3月19日の参議院沖縄および北方問題に関する特別委員会にて衆議院議員の秋野公造が、大麻由来てんかん治療薬「エピディオレックス」がアメリカで承認されたことを受けて、「医薬品として用いることがダメなら、治験として用いることは可能か」と質して、厚生労働省は「現行の大麻取締法では患者への施用は禁止されているが、本剤については大麻研究者である医師のもと、厚生労働大臣の許可を受け、治験の対象とされる薬物として国内の患者に用いることは可能であると考える。ただし、施用は適切な治験実施計画に基づいた対象の患者に限る」と、限定的ではあるが初めて前向きな答弁をしている。
この国会質疑を受けて、聖マリアンナ医大においては治験を主体的に行うことを決めた。4月10日、同大学の理事長、明石勝也自ら厚生労働大臣に要望を行い、厚労副大臣は「検討する」と応じており、今後は、聖マリアンナ医大を中心に治験が行われることになると見られている。
2019年5月15日に開かれた参議院沖縄および北方問題に関する特別委員会にて、秋野は大麻由来の薬物についての国内治験について国の見解を質し、厚生労働省は大要「安全性が確認できれば海外で承認前の薬でも医療機関が治験で使うことを認める」と答弁している。
外科治療
この節の加筆が望まれています。 |
てんかんの治療はかつては内科的治療が主体であったが、近年は難治性てんかんに対して外科的治療も積極的に行われるようになった。画像上明らかになるのは、部分切除によって改善が見込める「症候性部分発作」を起こすてんかんである。難治性であっても特発性全般発作を起こすてんかんは、外科的治療の適応とならない場合が多い。てんかんのおよそ3分の1が薬物療法によってコントロールされない難治性てんかんである。特に治療が見込める疾患としては海馬硬化症、脳腫瘍、大脳皮質形成障害、脳血管奇形が原因である場合である。一般的に、てんかん外科には数日間連続して脳波記録を行ったり、頭蓋内脳波を設置して記録できる脳波モニタリングユニットが必要であり、特定の施設で行われており、それらは日本てんかん学会がホームページで公表している。
- 手術方法の分類
-
- 皮質切除術
- てんかん発作を起こしうる大脳皮質を部分的に取り除くことで、てんかん発作を抑制できる。発作を起こす大脳皮質は、頭蓋内脳波モニタリング、MRI画像、脳磁図、PET、SPECT検査により同定する。同定した部位を切除することで発作の抑制または軽減が期待でき、かつ大脳皮質を切除したことによる合併症が、患者にとって容認できうるものと判断された場合に行われる。
- 脳梁離断術
- 大脳の左右の連絡する脳梁を分断することにより、発作を消失または軽減させる。発作を起こす大脳皮質が広範だった場合や複数あった場合は適応になりうる。一般的には、皮質切除よりも発作が消失する可能性は下がるものの、皮質切除が不適応だった場合にも適応しうる。後述する迷走神経刺激療法との選択がされることが多い。
- 詳細は「脳梁離断術」を参照
- 手術療法の対象になりやすいてんかんの原因
-
- 海馬硬化症(内側側頭硬化症)
- 側頭葉てんかんの原因となることが多い。内側側頭葉の神経細胞の脱落とグリオーシスが起こる疾患である。CA1を中心にCA3、CA4が硬化するのが特徴であるが、海馬に限らず扁桃体隣接する領域も硬化するため、海馬硬化よりは内側側頭葉硬化の方が名称としてふさわしい。MRIでは海馬の萎縮、内部構造の破壊、T2延長や側脳室下角の拡大が認められる。進行した場合は病側乳頭体、脳弓、側頭葉の非対称性委縮が認められる。内側側頭葉硬化症の場合、腫瘍、限局性皮質異形成、ほかの症候性てんかんを起こす異常が認められる場合が多く、注意が必要である。正常変異である海馬溝遺残や脈絡裂嚢胞が内側側頭葉硬化と紛らわしい場合がある。側頭葉てんかんでは、典型的には胃部の不快感の前兆のあとに自動症を伴う複雑部分発作が生じるのが特徴である。
- 腫瘍
- 難治性てんかんのおよそ4%が、腫瘍性病変を原因とする。てんかんを合併する腫瘍は側頭葉あるいは皮質、皮髄境界に存在することが多い。胚芽異形成性神経上皮腫(DNT)や神経節膠腫では、とくにてんかんの合併が多く、その他の腫瘍ではそれよりは少ない。
- 神経節膠腫
-
- 毛様細胞性星細胞腫
-
- 大脳皮質形成障害
- 神経細胞、グリア細胞の増殖、神経細胞の移動、皮質の層構造形成の異常によって生じる大脳皮質の形成障害を指す。神経芽細胞移動障害は病理形態の差から、無脳回、厚脳回症、異所性灰白質、多小脳回症、裂脳症と分類されている。
- 限局性皮質異形成
- 多小脳回限局した大脳皮質形成障害とは異なり、独立した病理学的概念である。軽度の皮質の層構造の乱れから、異型細胞が認められるものまで、程度はさまざまである。MRI画像では、脳溝、脳回の形成の異常、皮質/白質境界の不明瞭化、皮質の肥厚、皮質および皮質下のT2延長が特徴とされる。乳児期発症の場合は髄鞘化の進行とともに明らかになる場合があり、繰り返し撮影する必要がある。
- 片側巨脳症
- 乳児期に始まる難治性てんかんである。早期に機能的半球離断術が施行される。片側大脳半球の腫大、皮質の肥厚、脳回の異常が認められる。その他に病側の嗅索、脳幹、小脳の腫大、血管の拡張や患側あるいは両側の小脳foliaの異常が知られている。拡散テンソルトラクトグラフィでは両側側脳室前角間の異常な白質の線維束が認められる。
- 皮質結節
- その本態は過誤腫である。大脳皮質の脳回から皮質直下に位置する。髄鞘化が未発達な新生児や乳児ではいずれの画像でも高信号に認められる。髄鞘化完成後はT1WIではやや低信号から等信号、T2WIではやや高信号の限局性病変として認められる。
- 異所性灰白質
-
- 多小脳回
- 小さい脳回が多数認められる病態である。顆粒状脳回であり、脳表は平滑にみえ、皮質は厚く、皮髄境界面はでこぼこ、または鋸歯状である。
迷走神経刺激療法(VNS)
難治性てんかんの治療法として選択できる。保険も適応された。パルスジェネレータから、首の左側にある迷走神経に電極を巻きつけ、一定の間隔で繰り返し電気刺激を送り、てんかん発作の回数を減らしたり、発作の程度を軽くする。
薬物療法
日本で使われている抗てんかん薬には、以下のものがある。
- カルバマゼピン(CBZ)
- フェニトイン(PHT)
- バルプロ酸ナトリウム(valproic acid;VPA)
- ゾニサミド(ZNS)
- クロナゼパム(CZP)
- ジアゼパム(DZP、DAP)
- フェノバルビタール(PB)
- プリミドン(PRM)
- スルチアム(SL)
- アセタゾラミド(AZA)
- ニトラゼパム(NZP)
- エトスクシミド(ESM)
- クロバザム(CLB)【日本での発売:2000年5月25日より】
- ガバペンチン(GBP)【日本での発売:2006年9月25日より】
- トピラマート(TPM)【日本での発売:2007年9月26日より】
- ラモトリギン(LTG)【日本での発売:2008年12月12日より】
- レベチラセタム(LEV)【日本での最新薬:2010年秋季発売】
これらの薬を用いた治療は、てんかんの根本にある原因を治癒するものではなく、痙攣を抑制したり、発作が出にくくする対症療法であり、服用は長期間にわたる。ただし、長期にわたって発作がない場合は、症状に合わせて徐々に減量し、休薬することもある。
2007年現在、薬物治療においては、発作の臨床型によって薬を使い分けている。用いる薬物は、ナトリウムチャネルを抑制するもの、T型カルシウムチャネルを抑制するもの、GABAの抑制作用を増強させるものの3種類がある。ナトリウムチャネルを抑制するものとしては、カルバマゼピン(CBZ)やフェニトイン(PHT)がよく知られており、T型カルシウムチャネルを抑制するものとしてはバルプロ酸ナトリウム(valproic acid; VPA)、エトスクシミド(ザロンチン?)がよく知られている。GABAの抑制作用を増強させるものとしてはジアゼパム(DZP、DAP)やフェノバルビタール(PB)がよく知られている。基本的に、ナトリウムチャネルを抑制するものは部分発作と二次性全般発作に効果的であるが、欠神発作にはほとんど効かず、T型カルシウムチャネルを抑制するものは欠神発作に効果を発揮する。
このように分類されてはいるが、抗てんかん薬は薬理作用が多彩であるため、ほかの抗てんかん薬で代用可能なことが多く、副作用を制御するために第一選択ではない薬が投与されることが非常に多い。バルプロ酸は「T型カルシウムチャネルを抑制するもの」として分類されているが、ナトリウムチャネルも抑制する作用があり、部分発作の治療にも用いられる。
てんかんの治療目的は、痙攣重積発作の緊急性のてんかんからの回復、慢性てんかんの発作再発の防止である。
- 緊急時の薬物療法
緊急時は呼吸抑制に注意しながらジアゼパムを、血圧の低下に注意しながらフェニトインをゆっくりと静注する。ジアゼパムは、めまいや運動失調をはじめとする副作用が強く、急性期の治療以外では基本的には使わない。
- 慢性期の薬物治療
原則として単剤投与でコントロールする。使用薬剤はてんかんの型によって異なる。傾向としては、バルプロ酸が全般発作向きであり、カルバマゼピンが部分発作向きである。
- 単純部分発作:フェニトイン、カルバマゼピン
- 複雑部分発作:カルバマゼピン、フェニトイン
- 強直間代発作(大発作):バルプロ酸、フェニトイン、フェノバルビタール
- 欠神発作(小発作):バルプロ酸、エトスクシミド
- WEST症候群:ACTH、バルプロ酸、ニトラゼパム
かつては右半球切除、脳梁切断といったロボトミーのような外科的な手法による治療も試みられたが、投薬で症状の抑制が可能な事例も増えており、薬物療法による発作の制御が困難な場合を除き、外科的な処置が行われることはない。また、脳ペースメーカーによる深度てんかんの治療も行われつつある。
代替医療
鍼灸 、総合ビタミン剤、ヨガなどの代替医療にはてんかんの治療に対する信頼性のあるエビデンスは存在しない。メラトニンに関しては2016年時点で不十分だが支持的なエビデンスは存在する。しかしこの研究には方法的な問題点があり結論を出すことはできない。同じくエビデンスレベルが低い報告(動物での実験など)で今までに複数のサプリメント(高容量オメガ-3、ベルベリン, マヌカハニー、霊芝、ヤマブシタケ、クルクミン、ビタミンE、コエンザイムQ10、レスベラトロール)が薬剤耐性のてんかんに有効である可能性が報告されている。これらは(理論上は)てんかんの主要な発症要因のうちの二つである炎症や酸化ストレスを減らすという考えに基づいている。
発作と治療
てんかんは、脳卒中(Stroke)のあとに引き起こされるもっとも一般的な神経障害(Neurological Disorders)の一つであり、世界中で約5,000万人がこれを患っているとみられている。症状の頻発がみられない人が診断される。皮質ニューロン(Cortical Neurons)が過剰に、かつ超同時的に発火し、正常な脳機能を一時的な混乱状態に追いやる。これは筋肉、感覚、意識、もしくは全身に影響を与える。発作は、限局性(脳の一部のみに限定される)であったり、脳全体に広がり、意識の喪失をもたらす場合もある。発作の形態については、「てんかん症候群」(Epileptic Syndromes)という分類があり、てんかん症状の発症は小児期に見られることが多い。抗てんかん薬(Anticonvulsant Drugs)を2つ以上使っても症状が抑制できない場合、「Refractory」(「難治性の病」)とみなされる。てんかん患者の約60%は薬剤で症状を抑制できるが、残りは不可能である。
「薬が効かない」と判断された場合、選択肢として、てんかん手術(Epilepsy Surgery)、迷走神経刺激(Vagus Nerve Stimulation)、ケトン食療法が選ばれる。
断食・絶食療法
古代ギリシアの時代、医師たちが実践していた病気の治療法は、「食事を変えること」であった。『ヒポクラーテス全集』( 『The Hippocratic Corpus』 )に収録されている学術論文『On the Sacred Disease』(『神聖不可侵な病』)では、紀元前5世紀における癲癇治療を取り上げている。ヒポクラーテスはてんかんに対して「食事療法こそが、治療の確たる基礎となる」という姿勢をとっており、「てんかんが発症するのは人知の及ばぬものであり、手に負えない病気である」とする当時の一般的な見解に異を唱えていた。同書に収録されている『Epidemics』(『伝染病』) では、飲食を断つことにより、てんかん発作が発症したときと同じぐらいの早さで治った男性の事例を紹介している。王室専属の医師で解剖学者のエラシストラートゥス(Ἐρασίστρατος)は、「てんかんの症状が現れた場合は何があろうと断食を行い、食事制限をしなさい」と明言した。臨床医のガレノス(Γαληνός)は、「絶食は、軽度のてんかん患者を治癒し、それ以外の病気に対しても有益であるかもしれない」と考えた。
てんかんの治療手段としての絶食・断食についての研究は、1911年にフランスで行われている。あらゆる年齢層のてんかん患者20人に対し、摂取エネルギーを低くした菜食、断食、そして、(下剤による)腸内の異物除去を組み合わせることで「解毒」できたという。被験者のうちの2人には有益な効果がみられたが、課された制限を順守できた者はほとんどいなかった。臭化カリウムは被験者を悄然とさせたのに対し、食事療法は被験者の意思能力を改善させた。
このころ、アメリカ合衆国における身体鍛錬の象徴的存在であったベルナール・マクファデン(Bernarr Macfadden)は、身体の健康のために断食を普及させた。マクファデンの教え子で、ミシガン州バトルクリーク在住のヒュー・ウィリアム・コンクリン(Hugh William Conklin)は、てんかん患者の治療に断食を取り入れ始めた。腸内のパイエル板(Peyer's Patches)から毒素が分泌され、それが血中に放出されたときにてんかんの発作が起こるのではないかとコンクリンは推測した。この毒素を消滅させる目的で、コンクリンは患者に18~25日間の断食の継続を奨めた。コンクリンはかなりの数のてんかん患者を『水断食』(Water Diet)で治療した。子供のてんかん患者の90%はこれで治癒できたが、成人の患者では50%に下がった。その後、コンクリンによる患者の症例記録の分析では、患者の20%は発作から解放され、50%はいくらかの改善がみられた。コンクリンが行っていた絶食療法は、開業した神経内科医に採用された。
1916年、T・E・マクマリー(T. E. McMurray)は、『ニューヨーク・メディカル・ジャーナル』(The New York Medical Journal)に、「1912年以降、断食療法でてんかん治療に成功し、その後はデンプンや砂糖を加えない食事を処方している」と記述している。1921年、内分泌学者のヘンリー・ロウル・ガイエレン(Henry Rawle Geyelin、1883~1942)は、アメリカ医師会(The American Medical Association)が開催した定期学術集会に出席し、自身の経験を報告した。ガイエレンは、コンクリンによるてんかん治療の成功を目の当たりにしたことで、自身の患者36人で試した。短期間ではあったが、同様の結果になったという。1920年代に行われたさらなる研究では、てんかんの発作は断食後に再発することがあるという。
コンクリンによる絶食療法で癲癇治療に成功した患者の1人で、ニューヨークの顧問弁護士、チャールズ・プレンティス・ハウランド(Charles Prentice Howland、1869~1932)は、自身の弟、ジョン・エライアス・ハウランド(John Elias Howland、1873~1926)に、『The Ketosis of Starvation』(『絶食状態におけるケトーシス』)を研究する資金として5,000ドルを贈った。ジョンズ・ホプキンス病院(Johns Hopkins Hospital)の小児科の教授でもあったジョンは、兄から贈られた資金を、神経内科医のスタンリー・カブ(Stanley Cobb、1887~1968)とその助手、ウィリアム・ゴードン・レノックス(William Gordon Lennox、1884~1960)が行っていた研究のために提供した。
ケトン食療法
通常、炭水化物を摂取すると、体内でブドウ糖に合成され、全身の細胞に運ばれて消費される。一方、炭水化物をほとんど含まず、脂肪分が豊富な食事を摂ると、肝臓は脂肪を脂肪酸(Fatty Acids)とケトン体(Ketone Bodies)に分解する。ケトン体は脳に入り、ブドウ糖に代わるエネルギー源として消費される。血中のケトン体濃度の上昇は「ケトーシス」(Ketosis)と呼ばれ、この状態になると、癲癇の発作の頻度を低下させる。なお、この「ケトーシス」と「糖尿病性ケトアシドーシス」(Diabetic Ketoacidosis)は明確に異なる。この食事法の潜在的副作用としては、便秘(Constipation)、成長の遅延、高コレステロール血症(Hypercholesterolemia)、腎臓結石(Kidney Stone)がある。
砂糖、甘い果物全般、デンプンが豊富なもの全般を避け、各種ナッツ、生クリーム、バターの摂取を増やす。食べ物に含まれる脂肪分は、「長鎖中性脂肪」(Long-Chain Triglycerides、LCT)と呼ばれる分子で構成されるが、このLCTよりも短い炭素鎖からなる「中鎖中性脂肪」(Medium-Chain Triglycerides、MCT)は、ケトン体の産生量を増やすため、MCTが豊富なココナッツオイルを摂取する場合もある。脂肪の摂取比率を減らし、タンパク質の摂取を増やすケトン食もある。小児てんかん用のケトン食では、年齢と身長を考慮し、身体の成長と修復に必要な量のタンパク質を摂取する。この食事法を「ケトン食」「ケトン食療法」「ケトジェニック療法」「ケトジェニック・ダイエット」(The Ketogenic Diet)と呼ぶ。
この食事法は、炭水化物の1日の摂取量を10~15g以内に抑え、体内で「ケトン体」が生成される状態(「ケトーシス」と呼ばれる)に誘導する。もともとは、1920年代前半、アメリカ合衆国ミネソタ州ロチェスター市にあるメイヨー・クリニック(Mayo Clinic)の医師、ラッセル・モース・ワイルダー(Russell Morse Wilder、1885~1959)がてんかん患者を治療するために開発した食事法である。
何らかの形でこの食事療法を実践すると、てんかん持ちの子供や若者の約半数は、発作を起こす頻度が半分に減り、この食事法をやめたあとも効果は持続するようになる。子供や成人を問わず、てんかん患者がこの食事療法を実践することで、その恩恵が得られる可能性を秘めており、これと類似する『修正アトキンス・ダイエット』(Modified Atkins Diet、炭水化物の1日の摂取量を10~15g以内に抑えたうえで、タンパク質・脂肪・水・茶・食べる量はいっさい制限しない。アメリカ合衆国の心臓病専門医、ロバート・アトキンス〈Robert Atkins〉が開発した食事法)も同様に身体に有効であることを示す証拠もある。方式がどうであれ、「炭水化物および砂糖の摂取は徹底的に避けたうえで、大量の脂肪分を摂取する」点は共通している。
砂糖を筆頭に、米、麺類、パン、イモ類全般のような炭水化物の塊の摂取は禁止である。糖質を取りすぎると、ケトーシスは解除されてしまい、その効果は失われる。炭水化物の摂取を厳格に制限する代わりに、エネルギーの90%を脂肪から摂取する。ラッセル・ワイルダーが開発したケトン食における栄養素の構成比率は、「脂肪(4):タンパク質と炭水化物(1)」である。脂肪分が90%、タンパク質が6%で、炭水化物の摂取は可能な限り避ける。患者1人1人の年齢、身長、体重に合わせて内容を検討し、調理の際は栄養素を厳格に計算する。
ケトジェニック療法は、空腹中のてんかん患者に対して実施される投薬や手術以外の治療法の一つとして開発された食事療法である。1920年代に開発されて以降、10年間はこれが処方され続けたが、抗てんかん薬が新たに出てくると、徐々に使われなくなった。患者の多くは薬剤の投与で発作を抑制できるが、全患者のうちの20~30%は複数の薬剤を投与しても抑制できない。
2つ以上の薬剤を服用しても症状が抑制できない患者、特に子供のてんかん患者に対してはこのケトジェニック療法が効果を発揮し、てんかん治療の手段としてこの食事法が再評価された。
てんかん以外では、頭痛、身体的苦痛、筋萎縮性側索硬化症(Amyotrophic Lateral Sclerosis)、自閉症(Autism(、各種の癌、パーキンソン病(Parkinson's Disease)、アルツハイマー病(Alzheimer's Disease)、鬱病、神経外傷(Neurotrauma)、睡眠障害(Sleep Disorders)といったさまざまな病気や神経障害(Neurological Disorders)に対して、この食事療法がもたらす作用や効果についての研究が進んでいる。
ケトン食を摂取し続けることで、身体は炭水化物ではなくケトン体を常に燃料にする体質となり、肥満や過体重の場合、体重、中性脂肪、血糖値が有意に低下し、心臓病を起こす確率が低下する。低脂肪食と比較して、ケトン食は肥満患者や糖尿病患者の体重を大幅に減らし、血糖値とインスリン感受性を改善させ、代謝機能障害に関係する死亡率も低下させる可能性があり、肥満と糖尿病に対しても有効である可能性がある。
ケトン食はミトコンドリアの機能と血糖値を改善し、酸化ストレスを減少させ、糖尿病性心筋症(Diabetic Cardiomyopathy)から身体を保護する作用がある。
また、ケトン食は記憶力の改善と死亡率の低下をもたらし、末梢軸索(Peripheral Axons)と感覚機能障害(Sensory Dysfunction)を回復させ、糖尿病の合併症も防げる可能性が出てくる。
炭水化物の少ない食事は、血糖値とその制御の大幅な改善につながり、薬物の服用回数を減らせるだけでなく、服用の必要もなくなる可能性があり、この食事法は2型糖尿病の改善と回復にも効果的である証拠が示された。
ケトン食を含めて、炭水化物を制限する食事法は安全であり、長期にわたって健康を維持し、さまざまな病理学的状態を防止または逆転させる力がある。ケトン食をやめると(炭水化物の摂取を増やし、脂肪の摂取を減らすと)、片頭痛や癲癇発作が再発する。
「炭水化物は肥満およびそれに伴う疾患の主要な推進力であり、精製された炭水化物や糖分の過剰摂取を減らすべきである」と結論づけ、炭水化物を「Carbotoxicity」(「炭水化物には毒性がある」)という造語で表現する研究者もいる。
ケトン食による治療
1921年、医師のローリン・ターナー・ウディヤット(Rollin Turner Woodyatt、1878~1953)は、食事と糖尿病に関する研究を行った。その研究で明らかになったのは、健康体の人間が、
- 絶食状態にある
- 極度の低糖質かつ高脂肪な食事を摂っている
このいずれかの状態にあるとき、肝臓が、「ケトン体」と総称される水溶性化合物(β-ヒドロキシ酪酸〈β-Hydroxybutyrate〉、アセト酢酸〈Acetoacetate〉、アセトン〈Acetone〉)の産生量を増やすということであった。
メイヨー・クリニック(Mayo Clinic)の医師、ラッセル・ワイルダーは、ウディヤットによる研究を参考に、この食事法を「ケトン食療法」「ケトジェニック・ダイエット」(The Ketogenic Diet)と命名した。ワイルダーは、「炭水化物の摂取を抑え、大量の脂肪分を摂取することで血中のケトン体の濃度を上昇させるケトーシス状態に導く食事法だ」と説明した。ワイルダーは、絶食しているときと同じ効果が得られる食事療法がないかどうかを模索していた。1921年、ワイルダーは少数のてんかん患者に対し、てんかんの治療手段としてケトン食を初めて処方した。
ワイルダーの同僚で小児科医のマイニー・グスタフ・ピーターマン(Mynie Gustav Peterman、1896~1971)は、体重1kgにつき、1gのタンパク質、炭水化物の1日の摂取量を10~15gに抑え、残りの栄養素はすべて脂肪から摂取する食事を処方した。1920年代のピーターマンによるケトン食の研究は、この食事法の導入とその維持手段を確立させた。この食事法を実践することによる好ましい効果(注意力・普段の振る舞い・睡眠が改善された)と副作用(吐き気)の両方を記録した。この食事法は、特に子供に対して非常に効果的であることが分かった。1925年、ピーターマンは、「若い患者37人にこの食事を処方したところ、95%の患者は発作の頻度が低下し、60%の患者は発作が見られなくなった」と報告した。
1930年までに、10代の青少年や成人に対するこの食事法の効果についての研究が行われた。メイヨー・クリニックの医師、クリフォード・ジョゼフ・バーボルカ(Clifford Joseph Barborka、1894~1971)は、「高齢の患者の56%が、この食事法で健康状態が改善し、12%は発作が起こらなくなった」と報告した。バーボルカは、「成人はこの食事法で利益を得られる可能性がもっとも低い」と結論づけ、成人患者に対するケトン食の処方の研究は、1999年まで行われなかった。
抗てんかん薬の開発
1920年代から1930年代にかけて処方され続けてきたケトジェニック療法であるが、徐々に処方されなくなっていく。1857年に発見された鎮静性臭化物や、1912年に開発された抗てんかん薬のフェノバルビタール(Phenobarbital)の存在があった。1938年、神経内科医のH・ヒューストン・メリット(H. Houston Merritt、1902~1979)と、トレイスィー・パトナム(Tracy Putnam、1894~1975)の2人がフェニトインを開発すると、てんかん治療の研究の焦点は新薬の開発に移るようになった。1970年代にバルプロ酸ナトリウム(Sodium Valproate)が導入されると、神経内科医は、てんかん症候群および複数のてんかん発作に効果のある薬を利用・入手できるようになった。この時までに、ケトン食の処方は「レノックス・ガストー症候群」(Lennox–Gastaut Syndrome)のような難病の症例のみに限定されており、さらに処方されなくなった。
中鎖中性脂肪
1960年代には、「中鎖中性脂肪」(Medium-Chain Triglyceride、MCT)には、多くの脂肪分に含まれる「長鎖中性脂肪」(Long-Chain Triglycerides、LCT)に比べてケトン体の産生量がエネルギー単位で多いことが判明した。MCTは体内に効率よく吸収され、リンパ系(Lymphatic System)ではなく肝門脈系(Hepatic Portal System)を経由して肝臓に迅速に輸送されていく。1971年、小児神経内科医のピーター・ホトゥンロハー(Peter Huttenlocher、1931~2013)は、エネルギーの60%をMCTから摂取するケトン食を考案した。MCTオイルの2倍の量の脱脂粉乳と混ぜて冷やし、少しずつ飲んだり、食べ物に加える。子供と青少年12人にこのケトン食を試したところ、発作の抑制と注意力の改善の両方がみられ、本来のケトン食を処方したときに近い結果となった。患者の1人が消化管の不調を訴え、途中で食事を止めたが、それ以外の患者には受け入れられた。MCTを組み込んだ食事療法は、多くの病院で本来のケトン食に代わって処方されたが、この2つを組み合わせた食事も考案された。
普及
ハリウッドの映画プロデューサー、ジム・エイブラハムス(Jim Abrahams)は、息子のチャーリーが重度のてんかんを患い、苦しんでいたことに悩んでいた。息子のてんかんは、当時主流とされていた治療法でも代替治療でも治せなかった。てんかんの手引書の中にケトン食療法に関する記述があるのを発見したエイブラハムスは、チャーリーを連れて、ジョンズ・ホプキンス病院のジョン・マーク・フリーマン(John Mark Freeman、1933~2014)のもとを訪れた。ケトン食療法により、チャーリーのてんかん発作は急速に抑制され、身体は再び成長し始めた。1994年、エイブラハムスは、この食事療法の普及と研究資金を集める目的で、『チャーリー基金』(The Charlie Foundation)を設立した。未来を見据えた形でケトジェニック療法の研究が始まり、その研究結果は1996年にアメリカ癲癇学会(The American Epilepsy Society)で発表され、1998年に公表された。
1994年10月、NBCによる番組に出演したジム・エイブラハムスが、息子チャーリーのてんかん発作の事例とケトジェニック療法について公表すると、ケトジェニック療法はアメリカ全土に知れ渡るようになり、この食事療法に対して科学的な関心が劇的に高まるようになった。1997年に制作・放映されたテレビ向け映画『First Do No Harm』(邦題:『誤診』)では、難治性のてんかん発作のある少年がケトジェニック療法で治っていく過程が描かれている。2007年までに、ケトジェニック療法は45か国中75の医療施設で処方されるようになり、年長の子供や成人に対しては、ケトン食に類似する食事法である『修正アトキンス・ダイエット』(Modified Atkins Diet)も処方されるようになった。ケトジェニック療法は、てんかん以外のさまざまな病気に対する作用や可能性についても調査が行われるようになった。
治療の成果
未来を見据える形で行われた治療意図の研究は、1998年にジョンズ・ホプキンス病院の研究チームが発表し、2001年にはその追跡調査の研究結果についてまとめた報告書を公表している。ほかのケトジェニック療法の研究にみられるように、比較対照群(治療を受けなかった患者)は用いなかった。この研究には、子供の患者150人を被験者として登録した。実験開始から3か月後、患者全体の83%はこの食事法を続け、26%は発作の良好な減少が、31%は非常に優れた形での発作の減少が確認され、3%は発作がなくなった。「発作の良好な減少」は、「発作を起こす頻度が50~90%以上に低下する」、「非常に優れた減少」は、「発作の頻度が90~99%以上に低下する」と定義されている。
実験開始から12か月後では、55%がこの食事法を続け、23%は良好な反応を、20%は非常に優れた反応を見せ、7%は発作がなくなった。この段階でこの食事法を中止した患者も出たが、それはこの食事法の効果が出なかったり、病気のためにこの食事法そのものを止めたためである。それ以外の患者の多くは、この食事療法による恩恵を得られた。実験開始から2年、3年、4年と経過した時点でもこの食事法を続けていた患者の割合は、それぞれ39%、20%、12%であった。実験期間中、この食事法の中止に至った理由でもっとも一般的なものは、「発作が治った」「症状が目に見えて改善された」が挙げられる。実験開始から4年目、患者150人のうち、16%は発作の良好な減少が、14%は非常に優れた減少が見られ、13%は発作がなくなった。これらの数字には、この食事療法を続行中の患者も含まれる。この期間を過ぎてもこの食事法を続けている患者の場合、発作がなくなったわけではないが、非常に優れた反応を示した。
複数の小規模な研究の結果を組み合わせることで、個別の研究のみで得られる結果に比べて、より説得力のある証拠を生み出せるようになる。これは「メタ分析」(Meta-Analysis)と呼ばれる統計的手法である。2006年に行われた4つのメタ分析のうちの1つでは、患者数の合計が1,084人にのぼる19の研究について調べたものがある。このうちの3つ目のメタ分析研究では、「患者の発作の頻度は非常に優れた形で減少し、患者の半数は発作の良好な減少が見られた」と結論づけている。
2018年にコクラン共同計画(Cochrane Collaboration)が行った論文研究では、薬剤では発作の抑制には至らなかった癲癇患者に対して処方されたケトジェニック療法のランダム化比較試験(Randomized Controlled Trial)11件について分析している。このうちの6件の試験では、ケトジェニック療法に割り当てられた群とそうでない群とを比較した。ほかの試験では、食事法を導入することでどこまで持ちこたえるかを比較した。対照群を用いないケトン食療法を取り扱った最大規模の試験においては、ケトン食に割り当てられなかった群6%と比べて、ケトン食に割り当てられた群の小児と若者の38%は、発作を起こす確率が半分以下に低下した。ケトン食と比較する目的で行われた修正アトキンス・ダイエットを取り入れた2件の大規模試験でも似たような結果が示され、50%以上の子供が、対照群10%と比べて発作を起こす確率が半分以下に低下した。
2018年に行われた論文研究では、成人に処方したケトン食療法についての16の研究を精査しており、「ケトジェニック療法は、より一般的な治療法になりつつあり、子供にも大人にもほぼ同じ効果を発揮し、その副作用は比較的軽度である」と結論づけている。しかしながら、患者の多くはさまざまな理由でこの食事法を途中で中止し、その医学的根拠および臨床結果の質は、小児研究に比べて低くなっている傾向にある。健康上の問題については、低密度リポタンパク(Low-Density Lipoprotein)の上昇、総コレステロール値の上昇、体重減少がある。
日本での現状
2016年4月、難治性てんかん患者を対象に、糖質摂取を極端に減らした「ケトン食」(「てんかん食」)に保険が適用された。平成28年の診療報酬改定において、入院時食事療養(I)または入院時生活療養(I)の届出を行った保健医療機関が行う特別職のメニューにケトン食が追加された。この食事法は、ブドウ糖ではなくケトン体をエネルギー源にして供給するケトーシス状態に誘導するため、炭水化物の摂取を厳格に制限し、脂肪の摂取を大幅に増やすものである(カロリーの90%を脂肪から摂取する)。
静岡てんかん・神経医療センター(静岡市葵区)の管理栄養士、竹浪千景は「脂っこいため食べにくい。調理をする家族の負担は決して軽くはない」と不満を述べた。小麦粉の代わりに使える特殊粉ミルク「ケトンフォーミュラ」をレシピに採用しているが、製造しているのは「明治」1社だけである。登録した患者に無償で提供しているものの、国からの補助金は限られており、その製造費用はかなり大きい。災害で生産が止まれば、治療はままならなくなる恐れがある。ケトン食は、学校給食にも関わってくる。「ケトン食普及会」の元会長、松戸クリニック(千葉県松戸市)の院長、丸山博は「学校や保育所には弁当を持参する患者が大半。食物アレルギーへの対応は進んだが、てんかんへの配慮も検討してほしい」と述べている。
作用機序
発作の病理学
ヒトの脳は、神経インパルス(Nerve Impulses)は「ほんの短い時間だけ発生する電流」のこと)を伝播する形で脳内に信号を伝達していくニューロン(Neurons、神経組織を構成する1つ1つの細胞)による網状回線網で構成されている。あるニューロンから別のニューロンへ信号が伝播されていくとき、通常は神経伝達物質(Neurotransmitters)がそれを制御する役割を果たすが、一部のニューロン間においては電気経路も存在する。神経伝達物質は、神経インパルスが発火するのを抑制する。γ-アミノ酪酸(Gamma-Aminobutyric Acid、GABAと呼ばれる)がその役目を果たすが、逆に、ニューロンを興奮させ、発火させる作用を持つグルタミン酸(Glutamic Acid)もある。末端から抑制性神経伝達物質を分泌するニューロンは「抑制性ニューロン」(Inhibitory Neuron)と呼ばれ、興奮性神経伝達物質(Excitatory Neurotransmitters)を分泌するニューロンは「興奮性ニューロン」(Excitatory Neuron)と呼ばれる。興奮と抑制のバランスが取れているのなら正常な状態であるが、そのバランスが脳内の一部、もしくは脳内全体で激しく崩れるとき、発作が起こる可能性がある。GABA(γ-アミノ酪酸)の産生量の増加とその分解の抑制、あるいはニューロンに直接与える影響がより強化されるといった要素は、発作の抑制につながり、抗癲癇薬はGABAの組織系統に強く作用する。神経インパルスは、ニューロンの表面を覆う細胞膜(Cell Membrane)の内部にある神経経路を通り抜けていくナトリウムイオン(Sodium Ions)の大量流入、それに続く形でほかの神経経路の内部を通り抜けていくカリウムイオン(Potassium Ions)の流出を特徴とする。
ニューロンは、活性化が起こらない不応期(Refractory Period)が訪れている間は発火できず、これは別にあるカリウム・チャネル(Potassium Channel)が媒介するのが原因である。これらのイオンチャネル(Ion channels、イオンを膜の内外に透過させる際に必要なタンパク質の一種)の流動を制御するのは、電圧の変化や、リガンド(Ligand、神経伝達物質の一種)と呼ばれる化学伝達物質(Chemical Messenger)によって開放される「関門」である。抗癲癇薬は、これらの神経経路にも作用する。
病態生理学(Pathological Physiology)における癲癇発作の発生例としては、以下の症例が挙げられる。
- 脳内の神経細胞において、興奮状態が異常なまでに長時間持続する
- ニューロンの構造が普通ではなくなる→電流の変化をもたらす
- 抑制性神経伝達物質の産生量が減少する
- 抑制性神経伝達物質の受容体が無効になる
- 興奮性神経伝達物質の分解作業が不十分な状態のまま過剰に進行する
- スィナプス(Synapse, 神経細胞同士をつなぎ合わせる部位)の発達が未熟なまま
- イオンチャネルが機能障害を惹き起こしている
発作の抑制
ケトジェニック療法が身体に作用する際の機序について説明している仮説が数多く出ているが、検証されてはおらず、不明な点も多い。全身で起こっているケトアシドーシス、電解質の変化、低血糖症が挙げられるが、これらはいずれも反証されている。ケトン食を摂取しているヒトの脳内では数多くの生化学的な変化が起こっていることが確認されているが、いずれの作用が癲癇発作を抑制しているのかについてまでは分かっていない。抗てんかん薬が脳に及ぼす機序の解明についても類似している。
ケトジェニック療法では炭水化物の摂取を厳格に制限する代わりに脂肪の摂取は制限しないため、身体は脂肪酸を主要な燃料源として消費するようになる。脂肪酸は、細胞のミトコンドリア(Mitochondria)による酸化作用を通して消費される。これをβ酸化(Beta Oxidation)と呼ぶ。人体には糖新生(Gluconeogenesis)と呼ばれる経路があり、炭水化物や砂糖を食べずともブドウ糖を自ら生産する機能が備わっている。アミノ酸も糖新生の材料として使われるが、脂肪酸は材料にできない。
しかし、アミノ酸(Amino Acids)は体の成長と修復に必要な材料となるタンパク質を作る際に欠かせない材料であり、糖新生のためだけに消費されることはない。脂肪酸はそのままの形では血液脳関門(The Blood–Brain Barrier)を通過しない。肝臓は長鎖脂肪酸を材料に、β-ヒドロキシ酪酸(β-Hydroxybutyrate)、アセト酢酸(Acetoacetate)、アセトン(Acetone)、これらのケトン体を合成する。肝臓が合成したこれらのケトン体は脳内に入り、エネルギー源として消費される。ケトン体は抗癲癇薬と同様の作用をもたらす。動物実験においては、アセト酢酸とアセトンが発作を抑制したことが確認されている。ケトジェニック療法は、脳のエネルギー代謝を適応的に変化させ、エネルギーが途切れないよう促進する。ブドウ糖に比べると、ケトン体はエネルギーの浪費が起こりにくい燃料となり、ミトコンドリアの増加を促す。発作が起こっている最中にエネルギーの需要が増加することで、ニューロンが安定した状態を維持するのに役立ち、それに伴ってニューロンの神経保護作用(Neuroprotective Effect)をもたらす可能性がある。
ケトジェニック療法について、げっ歯動物(ネズミ目)14匹を用いた動物実験による研究が行われている。それらの動物実験でも、ケトジェニック療法がてんかんから脳を保護する作用が確認され、従来から使われてきた抗てんかん薬とはまた別の形で癲癇発作を抑制する作用があることが分かった。臨床の現場で抗てんかん薬としては用いられてはいない「フェノフィブラート」(Fenofibrate)と呼ばれる薬剤があるが、成体のラットに対して実験的に投与したところ、ケトン食に匹敵するほどのてんかん発作の抑制効果が見られた。薬剤を半ダース分投与しても発作の抑制が不可能であった患者に対する有効性を示す研究であるとして、ほかに類を見ない作用機序を示している。また、ラットにケトン食を取らせたところ、てんかん発作の抑制が確認された。
しかし、抗てんかん薬は癲癇発作を抑制する代わりに、発作を予防したり治療したりする効果はない。癲癇症状の発症の機序については、まだはっきりとは分かっていない部分も多い。バルプロ酸(Valproate)、レベチラセタム(Levetiracetam)、ベンゾジアゼピン(Benzodiazepine)といった化合物もあり、これらは動物実験にててんかん発作の抑制が確認された。
しかし、ヒトに対する臨床試験でてんかんの抑制に成功した抗てんかん薬は、いまだに出ていない。
歴史上の人物
イギリスのロックバンド、ローリング・ストーンズ(The Rolling Stones)のキース・リチャーズ(Keith Richards)は、2006年に枝から飛び降り、木の幹に頭をぶつけ、血栓が生じた。外傷性のてんかんを発症して以降、抗てんかん薬を服用している。
フョードル・ドストイェーフスキー(Фёдор Достое́вский)、フィンセント・ファン・ゴッホ(Vincent van Gogh)、ギュスターヴ・フローベール(Gustave Flaubert)もてんかんを患っていた。
カール・グスタフ・ユング(精神科医・心理学者)- 幼少時、失神を伴う痙攣発作をたびたび起こしていた。
南方熊楠(博物学者・生物学者・民俗学者)- 14歳のころに精神的な病を発し、18歳のとき、授業中にてんかん発作を起こし、明治22年4月27日、「夜てんかん発症」と、日記に記している。
福祉制度
1995年7月の、精神保健及び精神障害者福祉に関する法律(精神保健福祉法)の改正に伴い、精神障害者保健福祉手帳の取得が可能となった。
障害年金受給もできるようになった。かつては精神科医だけがこれの診断書を書けたが、脳外科医も年金申請の診断書が書けるようになり、制度および診断書の注意文が変更された。
医者の中には、制度の変更を知らない者もおり、自治体の窓口でもてんかんが精神障害に認定される可能性や、障害年金の申請も可能な事例もある(年金の加入状況と受給要件による)ということを把握しておらず、申請に関する書類一式を渡さず、それに伴う問題も起きている。
年金の受給要件は、年金ダイヤル、受給に関する相談は、最寄の年金事務所で問い合わせが可能。
年金事務所は基本的に来所前提の相談なので、介助者がいない者は、申請する書類すら揃えられないこともある。
てんかん患者の自動車運転について
この節は特に記述がない限り、日本国内の法令について解説しています。また最新の法令改正を反映していない場合があります。ご自身が現実に遭遇した事件については法律関連の専門家にご相談ください。免責事項もお読みください。
|
てんかん患者の自動車運転については旧道路交通法(昭和35年6月25日 法律第105号)において「次の各号のいずれかに該当する者に対しては、免許を与えない。(中略)精神病者、精神薄弱者、てんかん病者、目が見えない者、耳がきこえない者又は口がきけない者」と記されていた。しかし、2002年5月13日の道路交通法および同法施行令の改正により、条件つきでてんかん患者が免許取得できる道が開かれた。
てんかん患者が運転免許を取得できる条件は以下の3つである。
- 発作が再発するおそれがないもの
- 発作が再発しても意識障害および運動障害がもたらされないもの
- 発作が睡眠中に限り再発するもの
てんかん患者への運転免許解禁以降、運転者の発作・急病が原因の交通事故も頻発している。2011年には254件発生しており、このうちてんかんによる事故はその28.7%を占める73件である。同年のてんかんによる交通事故のうち、5件は死人が出ている。
上記3条件に合致しない、本来なら不適格とされる者の違法免許取得・更新も相次いでおり、2012年にはてんかん持ちであることを隠して免許を取得・更新したとして逮捕者が出た。
てんかんを原因とした下記のような重大事故の発生を受け、2012年10月に、警察庁に設置された一定の病気等に係る運転免許制度の在り方に関する有識者検討会(座長・藤原静雄)による提言がなされ、これを受け運転に支障のある者が免許取得・更新時に虚偽申告を行った場合に罰則を設ける改正道路交通法が2013年6月14日に公布された(実際の施行はここから1年以内)。てんかんを含む意識障害をもたらす病気に関係する改正の要点は以下の通り。
- 都道府県公安委員会は運転免許を取得・更新する者に対して、運転に支障をきたす恐れのある病気の有無に関する質問票を交付できる。
- この質問票で虚偽申告した場合、1年以下の懲役または30万円以下の罰金を課すことができる。
- 医師は患者が免許停止・取り消しに該当する病状であることを知った場合、公安委員会へ届け出ることができる(守秘義務違反とならないことを保証)。
- 医師から患者が免許を受けているか否かの問い合わせがあった場合、公安委員会はこれに回答することが求められる。
- 病気が疑われた場合、公安委員会は、3か月を限度として、一時的に免許を停止できる。
- 病気を理由に免許が失効した場合でも、病状が改善すれば条件つきで一部試験を免除して再取得できる。
2013年11月27日、従来の危険運転致死傷罪と自動車運転過失致死傷罪の中間的な処罰を定めた「自動車の運転により人を死傷させる行為等の処罰に関する法律」(通称:自動車運転死傷行為処罰法)が成立した(施行は2014年5月20日)。同法第三条2項により、自動車の運転に支障を及ぼすおそれがある病気で人を負傷させた場合は最高12年以下の、死亡させた場合は最高15年以下の懲役に処せられる。てんかんは、政令によりこの「運転に支障を及ぼすおそれがある病気」に該当するとされた。これまでは、てんかん発作を原因とする死亡事故は自動車運転過失致死傷罪でしか裁けなかったが(持病は危険運転致死傷罪の要件とならないため)、同法により、より重い刑罰を科することが可能となった。
てんかん患者のうち、投薬によって発作が制御できるのは7~8割とされ、残りの2~3割は発作の制御はできないという現状が報じられている。
てんかん発作による事故
運転者のてんかん発作による自動車等の暴走が引き起こした交通事故において、裁判所による判断は分かれている。医師の診察により運転を控えるよう指示を受けている場合は、「危険運転幇助容疑」に問われた事例もある。なお、てんかん患者の自動車運転免許取得の条件については、上記を参照。
- 1999年10月26日 - 兵庫県三木市で、てんかん患者の運転手が乗用車を運転中にてんかん発作を起こし、小学校から下校中の児童3人の列に車が突っこんだ。この事故で1人が全身打撲で死亡、2人が重傷を負った。神戸地裁は、心神喪失状態だったという運転手側の主張を受け入れ、無罪を言い渡している。
- 2001年10月10日 - 山形市城南町1丁目付近の県道で、運転手が運転する乗用車が原付バイクに追突、バイクの運転手を25メートル引きずり、そのまま逃走した。バイクの運転手は収容先の病院で死亡。加害者はてんかんの持病を持ち、発作を抑える薬を服用していたが、事故直前に軽いめまいといった発作の前兆を感じていた。2005年9月26日、山形地方裁判所は「事故発生当時、被告は発作によって心神喪失状態であった」として漫然運転やひき逃げの責任を問わない一方、「被告は発作の前兆を自覚することはできた。薬を服用している点からもこれは確認できる。運転を自粛する注意義務は果たせた」として業務上過失致死罪を適用し、被告に禁固1年6月(執行猶予3年)の判決を言い渡した。
- 2002年9月27日 - 滋賀県栗東市で、てんかん患者の運転手が乗用車を運転中にてんかん発作を起こし、対向車線側に逸脱、軽トラックと正面衝突し、軽トラックを運転していた運転手が全身を強く打って死亡した。大津地裁は、運転中止義務違反の過失がないと指摘し、被告に無罪を言い渡している。
- 2004年3月7日午後3時40分 - 長野県長野市川合新田付近の国道18号で、てんかん患者の運転手が乗用車を運転中にてんかん発作を起こし、信号待ちのために停車していた乗用車5台に追突、車数台が関係する多重衝突事故に発展した。この事故で1人が全身を強く打って死亡。6人が重軽傷を負った。長野地方裁判所は、事故を起こした被告に対して懲役4年の実刑判決を言い渡している。
- 2008年3月9日午前 - 神奈川県横浜市鶴見区下末吉3丁目付近の県道で、てんかん患者の運転手がトラックを運転中にてんかん発作を起こし、対向車線に逸脱、そのまま道路右側の歩道に乗り上げ、信号待ちをしていた歩行者2人を次々にはねた。このうち1人が死亡、もう1人も重傷を負った。横浜地裁は、事故を起こした被告に対して禁固2年8か月の実刑を言い渡している。
- 2010年12月30日午後1時半ごろ - 三重県四日市市羽津町の近鉄名古屋線踏切で、てんかん患者の歯科医師が乗用車を運転中に意識を失い自転車3台に追突、踏切内に押し出された3人のうち2人が踏切に入ってきた急行列車にはねられて死亡した。2011年11月30日、津地裁は「発作が起こる持病のため、被告には運転を差し控える義務があったが、これを怠り運転した過失がある」として、被告に禁錮2年10月の実刑判決を言い渡した。2012年5月10日、名古屋高等裁判所は地裁判決を支持し、被告の控訴を棄却した。2012年9月3日、最高裁判所は被告の上告を棄却、被告の実刑判決が確定した。
- 2011年4月18日午前7時45分ごろ - 栃木県鹿沼市内の国道293号で、てんかん患者の運転手が自走式クレーン車を運転中にてんかん発作を起こし、速度を保ったまま斜行するようにして対向車線側へ逸脱、そのまま道路右側の歩道に乗り上げて集団登校を行っていた小学生15人程度の列に突っ込んだ。このうち児童6人が全身強打で死亡した。運転手は以前にも同様の逸脱・衝突事故を起こして小学生に重傷を負わせており、有罪判決を受けて執行猶予中だった(過去10年に12回の事故。てんかん隠し免許取得)。宇都宮地裁は、被告が服薬を怠り、事故当日に発作の予兆を感じていたと認定し、2012年1月5日に懲役7年の実刑判決を言い渡した。
- 2011年4月21日 - 島根県松江市米子町の国道で、てんかんの持病を申告せず運転免許を更新し、意識障害を起こした運転手が、軽自動車で歩道に乗り上げ2人を死傷させた。捜査関係者によると、運転手は2007年3月に免許を取得し、持病を認識していたが、2010年2月に免許を更新した際に必要な申告をしていなかった。また、事故の数日前から薬の服用を怠っていた。2011年11月10日、松江地裁は持病に関して「無自覚で安易な姿勢」として禁錮2年の有罪判決を言い渡した。2012年4月27日、広島高等裁判所松江支部も「事故を起こした被告の落ち度が大きいことは明らか。一審判決の量刑が重すぎるとは認められない」として一審判決を支持し、被告側の控訴を棄却した。
- 2011年5月10日 - 広島県福山市で、軽乗用車が小学生の列に突っ込み4人に重軽傷を負わせた。事故を起こした運転手はてんかんの治療中だったが、免許更新時に申告をしていなかった。2011年8月8日、広島地方裁判所福山支部は、「てんかん発作で事故を起こす可能性を認識しながら運転を継続した」、「事故は偶発的ではなく、無自覚で安易な姿勢は厳しい非難に値する」として、被告に禁錮1年の実刑判決を言い渡した。
- 2011年7月10日 - 愛知県岩倉市大地新町の県道で、当時78歳の男性が運転する乗用車が追突事故を起こしたあと70メートル走行し、さらに赤信号待ちの車列に突っ込み計8台が絡む事故が発生した。この事故により親子2人が死亡、6人が負傷した。男性は自動車運転過失致死傷容疑で検察庁に送検されたが、捜査過程でてんかんを罹患していることが判明した。2012年2月27日、名古屋地方検察庁一宮支部は「症状を認識しておらず、事故の予見可能性があったとはいえない」として、男性を不起訴とした。
- 2011年10月19日 - 鹿児島県姶良市内の国道10号で、運転手の男性が運転するトラックが暴走、1人が死亡、4人が重軽傷を負った。捜査過程で、男性がてんかんの発作を起こし、意識喪失していたことが判明した。検察は男性を自動車運転過失致死傷罪で起訴した。2012年1月6日、鹿児島地方裁判所は「運転中に発作が起きたとしても、うまく対処できると安易に考えていた。薬の服用もしておらず、その過失は相当に大きく、また悪質である」として、禁錮2年4月の実刑判決を言い渡した。
- 2011年12月27日 - 栃木県宇都宮市内で、運転手が運転する車が衝突事故を起こし、5人が重軽傷を負った。運転手はてんかんの持病をもち、医師に運転を控えるよう指導されていた。2012年10月29日、宇都宮地方裁判所は「前兆があったのに、発作が起きないと軽信した身勝手で軽率な判断」として、被告に禁錮2年4月、執行猶予5年の判決を言い渡した。
- 2012年4月12日 - 京都市東山区の祇園で、運転手が運転する軽ワゴン車がタクシーに追突。その後車と道路の隙間を縫うようにして走り、歩行者を次々とはね電柱に激突した。運転手を含む8人が死亡し、11人が重軽傷を負った。運転手はてんかんの持病があったが、運転免許更新時に申告せず運転を続けていた。2012年11月13日、京都府警は事故原因をてんかん発作による意識障害として、運転手を自動車運転過失致死傷の疑いで容疑者死亡のまま書類送検する方針を明らかにした。2013年7月28日、京都地方検察庁は運転手を容疑者死亡により不起訴とした。「京都祇園軽ワゴン車暴走事故」を参照
- 2014年6月7日 - 札幌市東区で、運転手が運転するワゴン車が斜行して対向車線を走行中の乗用車と正面衝突し、対向車の運転手に重傷を負わせた。ワゴン車を運転していた運転手は無免許であり、てんかんの発作を起こしていた。2014年9月2日、札幌地方裁判所はワゴン車を運転していた運転手に対して自動車運転死傷行為処罰法違反(無免許危険運転致傷)で懲役1年10月の実刑判決を言い渡した。判決では「意識を失う持病を有する状態での運転は危険性が高い。また一度も免許を取得しておらず、運転についての技能や知識が不足していることも認識しながら運転していたことは強く非難される」と指摘された。
- 2015年3月5日 - 大阪府東大阪市本庄中の市道交差点で、運転手が運転するワンボックスカーが乗用車と衝突し、その弾みで歩道上の歩行者2人をはねた。はねられた2人は死亡し、衝突された乗用車を運転していた運転手も意識不明の重体となった。大阪府警察は、ワンボックスカーを運転していた運転手について、「持病であるてんかんの発作の可能性を認識しながら運転していた」として、自動車運転処罰法違反(危険運転致死傷)容疑に切り替え捜査。大阪地方検察庁は2015年5月21日に同法違反で大阪地方裁判所に起訴した。
- 2015年3月12日 - 宮崎市高洲町で、てんかん患者の男性が運転する乗用車が、ほかの車両と衝突しながら時速108キロメートルで暴走し、交差点で右折待ちの車両4台を巻き込む事故となり、1人が死亡、4人が負傷した。てんかんが原因とされ、自動車運転処罰法違反で起訴された。
- 2015年8月16日 - 東京都豊島区東池袋で、てんかん患者の運転手が運転する普通乗用車が歩道に乗り上げたあとに衣料品店に突っ込み、1人が死亡、4人が骨盤を骨折するという重軽傷を負った。「池袋駅東口乗用車暴走事故」を参照
- 2015年8月19日、北海道共和町の国道276号線で、てんかん患者の運転手が運転する乗用車が事故を起こし、自転車に乗った9人をはねて重軽傷を負わせた。運転手は、かねてより自動車運転をしないよう医師から指導を受けていた。事件では事故を起こした本人が自動車運転処罰法違反(危険運転致傷)で起訴された。また、てんかんの発作の事実を知りながら運転手に車を貸した父親は、危険運転ほう助容疑で書類送検された。
- 2015年10月28日 - 宮崎県宮崎駅前で、てんかん患者の運転手が運転する軽乗用車が歩道を700メートル暴走して6人の歩行者をはねたあとに横転した。2人が死亡、5人が負傷(1人は運転手)。運転手は認知症で、事故を起こす2日前まで入院していたが、その原因は「てんかん」と判断された。2018年1月19日、宮崎地方裁判所は運転していた男性被告に対し、てんかんによる危険運転を認めず過失運転致死傷罪を適用し、懲役6年の実刑判決を言い渡した。
- 2018年5月10日 - 山梨県笛吹市の県道で、普通乗用車が対向車線の軽四乗用車3台と順次衝突し、1人が死亡、2人が負傷(1人は運転手)。警察は持病を申告せずに乗用車を運転し、持病のてんかんによる発作から事故を起こしたとして危険運転致死傷の疑いで事故を起こしたとして、2019年6月5日までに書類送検した。
患者へのスティグマ
てんかん患者に対しては、2000年代以降も「差別」と受け取られる事例が報告されている。
福岡労働局が2012年7月に福岡県内の各高校に対し、翌年に卒業予定の就職希望者について、てんかん患者は主治医の意見書を公共職業安定所に提出するよう求めていたことが2014年に判明した。また、自立に向けて生活支援センターから事業所に福祉サービスの手続きを行う際にも意見書を提示するよう求める理由を伏せていることに不信感を抱く当事者も多い。前述の京都市祇園での事故以降、雇用側が警戒していることを受けてのものと見られているが、雇用での差別的取扱を禁じた職業安定法に抵触する可能性があるとして、厚生労働省が同労働局に是正指導したうえ、全国の各労働局にも再発防止を指示している。
てんかんを取り扱った作品
- 大江健三郎『静かな生活』 - 作者が、自分の息子(大江光)をモデルとして書いた。伊丹十三により映画化もされている。
- 筒井康隆『無人警察』 - 短編集『にぎやかな未来』(角川文庫)に収録されている「文明批判」がテーマの短編SF小説。自動車を運転しているてんかん患者の脳波を検知する『ロボット警官』が作中に登場する。1993年、この作品が角川書店発行の高校国語の教科書に収録されると、日本てんかん協会は同作品の削除もしくはほかの作品に差し替えるよう抗議した。作者の筒井は日本てんかん協会と数度交渉するも、双方の主張は平行線をたどり、結局筒井は「断筆宣言」を発表し、すべての執筆活動を停止した。その後、1997年に「自主規制撤廃に関する覚書」をいくつかの出版社と取り交わして断筆を解除した。
- ドストエフスキー『白痴』 - 主人公のムイシュキン公爵が重度のてんかん持ちである。
てんかん啓発キャンペーン
- 3月26日、パープルデー(Purple Day)。てんかんへの関心を高め、理解を訴える日として、2008年にカナダ・ノバスコシアのてんかん協会の協力を得て制定された。創始者は当時9歳のキャシディー・メーガン(Cassidy Megan)で、7歳でてんかんと診断され、周囲の偏見や誤解に悩んでいたが、「世界中の人にてんかんについてもっとよく知ってほしい。てんかんであるがために差別や孤独を感じている人に、あなたは一人ではないと伝えたい」という願いから創設されたてんかん啓発イベント。ラベンダーの紫が啓発話動の国際的イメージカラーだったことに由来する。アメリカ国内の支援団体もこれに理解を示し、今では120か国以上で活動が行われている。
- 毎年2月の第2月曜日は「世界てんかんの日」で、日本記念日協会の公式記念日に登録されている。
脚注
注釈
文献
- mhGAP Intervention Guide for mental, neurological and substance use disorders in non-specialized health settings (Report). 世界保健機関. (2010). ISBN 9789241548069. http://www.who.int/mental_health/publications/mhGAP_intervention_guide/en/.
- CG137: Epilepsies: diagnosis and management (Report). 英国国立医療技術評価機構. (2016-02). https://www.nice.org.uk/guidance/cg137.
- 日本神経学会『てんかん治療ガイドライン2010』医学書院、2010年10月。ISBN 978-4-260-01122-8。http://www.neurology-jp.org/guidelinem/tenkan.html。
- 『てんかん学ハンドブック』ISBN 9784260001168
- 『てんかんテキスト』ISBN 9784521734408
- 高齢発症てんかん
- 久保田有一:『知っておきたい「てんかんの発作」』、アーク出版、ISBN 978-4-86059-137-3 (2014年3月)。症状の動作を示すアニメのDVD付き書籍。
関連項目
- 運転免許に関する欠格条項問題
- チェーザレ・ロンブローゾ - ノーベル生理学・医学賞を受賞したカミッロ・ゴルジ(Camillo Golgi)の指導教官。てんかん患者は文明社会に適応することができず犯罪に手を染めやすい、すなわち将来犯罪者となることを先天的に宿命付けられた存在であると結論付けた。
- 点頭てんかん
- 日本てんかん協会
- 小児科学
- 神経学
- 光過敏性発作(光過敏性てんかん)
- ナルコレプシー
- 非定型精神病
- 情報公開法
- 就労移行支援
- 精神保健福祉法 - 精神障害者保健福祉手帳
- 障害者福祉
- 障害者基本法
- 障害者総合支援法
- 障害者虐待防止法
- 障害者差別解消法
- 障害者雇用促進法
- 医療観察法
- 精神病院の用語整理法
- 障害年金
外部リンク
- Epilepsy - NICE Pathways
- てんかん - 厚生労働省
- 一般社団法人日本てんかん学会
- 公益社団法人日本てんかん協会
- Purple Day Japan | てんかん啓発キャンペーン「パープルデー」 - 全国てんかんリハビリテーション研究会、パープルデー企画実行委員会
- Models of epilepsy (英語) - スカラーペディア百科事典「てんかんのモデル」の項目。
- Epilepsy - ウェイバックマシン(2012年10月12日アーカイブ分) (英語) Medpedia「てんかん」の項目。
- 成人のてんかん/神経内科 - ウェイバックマシン(2017年3月27日アーカイブ分)
- てんかん - 脳科学辞典