
パクリタキセル
| |
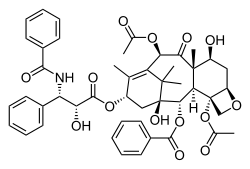
| IUPAC命名法による物質名 | |
|---|---|
| |
| 臨床データ | |
| 胎児危険度分類 |
|
| 法的規制 | |
| 投与方法 | 点滴静注 |
| 薬物動態データ | |
| 生物学的利用能 | - |
| 血漿タンパク結合 | 89〜98% |
| 代謝 | 肝臓 (CYP2C8およびCYP3A4) |
| 半減期 | 5.8時間 |
| 排泄 | 胆汁 |
| 識別 | |
|
CAS番号 |
33069-62-4 |
| ATCコード | L01CD01 (WHO) |
| PubChem | CID: 36314 |
| KEGG | D00491 |
| 化学的データ | |
| 化学式 | C47H51NO14 |
| 分子量 | 853.906 |
パクリタキセル(Paclitaxel、略称: TXL、PTX、PAC)は、がん化学療法において用いられる有糸分裂阻害剤の一つである。タキサン系に属する。タイヘイヨウイチイ(Taxus brevifolia )の樹皮から単離され、「taxol(タキソール)」と命名された。後に、樹皮中の内生菌がパクリタキセルを合成していることが発見された。
ブリストル・マイヤーズ スクイブ(BMS)社によって商業的開発された際、一般名がPaclitaxel(パクリタキセル)へと変更され、BMS社の化合物はTaxol(タキソール)という商標で販売されている。パクリタキセルは水にほとんど溶けないため、この製剤では、ポリオキシエチレンヒマシ油とエタノールに溶解されている。パクリタキセルをアルブミンに結合させたより新しい製剤は「アブラキサン」の商標で販売されている。
パクリタキセルは肺がん、卵巣がん、乳がん、頭頸部がん、進行性カポジ肉腫患者の治療に用いられている。また再狭窄の予防にも用いられている。
パクリタキセルは微小管を安定化させることで微小管のダイナミクスを抑制し、その結果正常な細胞分裂の進行を妨げる。ドセタキセル(商品名タキソテール)と共に医薬品分類のタキサン類を構成する。フロリダ州立大学のロバート・ホルトンによって初めて全合成された。
開発
1966年にタイヘイヨウイチイ(Taxus brevifolia)の樹皮から分離され、1971年に構造決定された。
発見当初はタキソール(Taxol)と呼ばれていたが、1990年にブリストル・マイヤーズ スクイブ社がこの名を商標として登録し、「タキソール(TAXOL)」として使用するようになった。そのため、特定の企業商品を連想させないように、薬学系の研究者を中心に一般名であるパクリタキセルが物質名としても使用されている。
歴史
植物成分スクリーニングプログラム
1955年、米国国立がん研究所(NCI)は国立がん化学療養サービスセンター(Cancer Chemotherapy National Service Center、CCNSC)を設立し、外部機関や企業が提供した化合物の抗腫瘍活性の公共スクリーニングセンターとした。多くの化合物が合成品であったが、天然物由来品のスクリーニングも実施された。1960年7月、NCIは農務省の植物学者に1年辺り1,000種の植物サンプルを収集するように命じた。1962年8月、ワシントン州パックウッドの北方の森に生えていたタイヘイヨウイチイの樹皮が収集され、1964年5月に樹皮が細胞毒性を持つことが明らかとなった。
1964年後半から1965年前半には、ノースカロライナ州のリサーチ・トライアングル・パークでイチイ樹皮の分析が実施され、活性物質が1966年9月に単離され、1967年に開かれたアメリカ化学会で報告された。1967年6月にこの有効成分はタキソールと命名された。1971年には、化学構造が決定され報告された。
NCIはより多くのイチイ樹皮を収集し、より多くのタキソールを入手した。1969年までに、約1,200kg の樹皮から28 kgの粗抽出物が得られたが、タキソールは10gしか得られなかった。NCIは数年間はタキソールを一切使用しなかったが、1975年に異なるin vitro系で抗腫瘍活性が再確認され、その2年後、タキソールを臨床開発の次の段階に進めることが決定された。精製したタキソール600 gが必要とされ、1977年には3 tを超す樹皮が消費された。
1978年に、NCIはタキソールが白血病マウスに対して穏やかな有効性を示すことを公表した。1978年11月には、異種移植研究についてのタキソールの有効性が示された。同時に、細胞生物学の分野ではタキソールは微小管の安定化を含む未知の機序で奏効することが1979年前半に報告された。製剤化上の課題と共に、この報告は研究者の興味を引き、NCIは1980年には9tのイチイ樹皮を収集する必要があると考えられた。動物を用いた毒性学的研究は1980年6月までに完了し、11月にはNCIはヒトへの投与に必要なIND(治験薬)登録を終えた。
臨床試験
第I相臨床試験は1984年4月に開始され、1年後には第II相臨床試験の開始が決定された。この規模の臨床試験の実施には、5.5tのイチイ樹皮が必要とされ、試験が始まったのは1986年末であった。その時までにタキソールの需要が極めて大きなものであると認識され、樹皮27tが必要であると計算されるに至り、イチイの種への影響が懸念され始めた。
最初の第II相臨床試験の結果は1988年5月に報告され、悪性黒色腫患者への有効性と難治性卵巣がん患者への著効性(奏効率:30%)が明らかにされた。この時点で、全米の卵巣癌および悪性黒色腫の患者を治療するために年間36万本のイチイが切り倒される必要があると試算された。当初は、供給の問題は深刻に受け止められた。実施上の問題と、特に財政規模の問題により、NCIは製薬企業と共同開発することを決定し、1989年8月、その後の臨床試験の継続に向けて引き続き原料を収集しタキソールを精製する会社に対して現状で保有している樹皮のストックと収集されたデータへの独占アクセス権を与え、資金も提供するとの共同研究開発契約(CRADA)提案を公表した。実質的なタキソールの学術書と言える本の著者は「この時NCIは協業は考えておらず、タキソール(とそれが抱える問題)を相手に引き渡すことを考えていた」と記述している。
この提案は広く広告されたにもかかわらず、CRADAに反応したのは4社のみであり、1989年12月にブリストル・マイヤーズ スクイブ(BMS)がパートナーに選ばれた。BMSのこの選択は後に物議を醸すこととなり、1991年と1992年の議会聴聞会の対象となった。NCIにはほとんど選択の余地がなかったことは明らかに思える一方、企業のパートナーを迎えたことは契約条件に関する議論を巻き起こし、最終的に2003年の会計検査院の報告でNCIは費した金銭に価する価値の確保に失敗したと結論付けられた。
米国農務省と米国内務省が参加している関連契約では、ブリストル・マイヤーズ スクイブは米国中のタイヘイヨウイチイの供給に関する排他的優先権を手に入れた。この排他契約はBMSに「癌治療薬の独占」を許すものだとして批判された。この契約の18か月後、BMSは新薬承認申請(NDA)資料を提出し、1992年末に承認された。化合物には特許は取得されていなかったが、ハッチ・ワックスマン法の規定により、BMSに5年間の独占販売権が与えられた。
1990年、BMSはタキソールの名称をタキソールとして登録申請した。これは論争を起こしながらも1992年に認可された。同時に、国際一般名 (INN) としてはパクリタキセルと命名され直した。Nature誌などの批評家は、タキソールという名称は20年以上も600以上の科学論文で使用され続けて来ており、商標登録すべきでないと提案し、BMSはその権利を放棄すべきであると述べた。BMSは、名称を変更すると医師の間に混乱をもたらし、患者の健康状態を危険に晒す可能性があると主張した。BMSは裁判所でその名称の権利を護り続けている。
製造方法
1993年にロバート・ホルトンらのグループにより初めて全合成された(発表は翌年。ホルトンのタキソール全合成を参照)。しかし、全合成はコストが高い。現在、医薬品としてのパクリタキセルはヨーロッパイチイの葉よりバッカチンIIIという原料を取り出して、これを元にパクリタキセルを合成(半合成)している。また、細胞培養法(PCF法:Plant cell fermentation法)により安価で大量に供給する技術も確立されている。
作用機序
微小管に結合して安定化させ脱重合を阻害することで、腫瘍細胞の分裂を阻害する。パクリタキセルはチューブリンの2つのサブユニット(αとβ)のうちβサブユニットに結合する。
効能・効果
卵巣癌、非小細胞肺癌、乳癌、胃癌、子宮体癌、再発または遠隔転移を有する頭頸部癌、再発または遠隔転移を有する食道癌、血管肉腫、進行または再発の子宮頸癌、再発または難治性の胚細胞腫瘍(精巣腫瘍、卵巣腫瘍、性腺外腫瘍)、治癒切除不能な膵癌(nab-パクリタキセルのみ)。
子宮体癌での本剤の術後補助化学療法における有効性および安全性は確立していない。
組成
内容に無水エタノールを含有しているのでエタノールによる中枢神経症状(酔払う)が出やすい。またポリオキシエチレンヒマシ油を含むため、アレルギー症状を予防する薬剤投与が不可欠である。
副作用
重篤な副作用には、次のものがある。頻度未記載は頻度不明である。
- ショック(0.2%)、アナフィラキシー様症状(0.3%)、
- 骨髄抑制(白血球減少(61.4%)、好中球減少(55.5%)、貧血(ヘモグロビン減少(30.7%)、ヘマトクリット値減少(5.0%)、赤血球減少(11.2%)など)、血小板減少(11.7%)、汎血球減少など)、感染症(尿路感染(2.3%)、上気道感染(4.8%)、敗血症(0.9%)、帯状疱疹(1.0%)、肺炎(1.1%)など)
- 末梢神経障害(43.8%)、麻痺(0.1%)、片麻痺(0.1%未満)、不全麻痺、間質性肺炎(0.5%)、肺線維症、急性呼吸窮迫症候群(0.1%未満)、
- 心筋梗塞(0.1%未満)、鬱血性心不全(0.1%未満)、心伝導障害、肺塞栓(0.1%)、血栓性静脈炎(0.4%)、脳卒中(0.1%未満)、肺水腫(0.1%未満)、
- 難聴(0.2%)、耳鳴(0.4%)、消化管壊死、消化管穿孔(0.1%未満)、消化管出血(0.1%未満)、消化管潰瘍(0.1%)、出血性大腸炎(0.1%未満)、偽膜性大腸炎、虚血性大腸炎、腸管閉塞(1.6%)、腸管麻痺(食欲不振、悪心・嘔吐、著しい便秘、腹痛、腹部膨満あるいは腹部弛緩および腸内容物の鬱滞など)(0.1%)、
- 肝機能障害(4.0%)、黄疸、膵炎(0.1%未満)、急性腎不全(0.2%)、皮膚粘膜眼症候群、中毒性表皮壊死症、播種性血管内凝固症候群(DIC)(0.1%)、腫瘍崩壊症候群、白質脳症(可逆性後白質脳症症候群を含む)
類似名称による問題
タキサン系抗がん剤には「タキソール(パクリタキセル)」とは別に「タキソテール(ドセタキセル)」という名称が類似する薬剤がある。日本では発売開始がどちらも1997年でパッケージデザインが類似していること(毒薬指定のため販売名が黒地に白文字で記載)から、医師の処方箋のオーダー間違いやパッケージの誤認識による取り違えにより、重篤な症状や死亡に至る医療過誤が生じた。
このため医療機関では取り違え防止のために自主的に商品名ではなく一般名の「パクリタキセル」「ドセタキセル」を用いる対処をしたが、2008年12月8日に厚生労働省が『医薬品の販売名の類似性等による医療事故防止対策の強化・徹底について(注意喚起)』を発令し、以後承認される医薬品に販売名称が類似する製品がないかチェックするようになった。これを受けて先発メーカーのブリストル製薬とサノフィの日本法人が正式に協議し、それぞれ外箱やバイアルのラベルに販売名より一般名を大きな色文字で強調表示する対応をようやく実施した。その後発売された同系統の後発医薬品では販売名そのものに一般名を含めるといった対応をしている。
誘導体
近年、主にパクリタキセルの副作用の緩和を目的としてパクリタキセルの誘導体や薬物送達システム(DDS)製剤の抗がん剤の開発が進んでいる。
- アルブミン結合パクリタキセル
- nab-パクリタキセル(アブラキサン ABRAXANE)
- パクリタキセルをアルブミンで封入したナノ粒子製剤のアルブミン結合パクリタキセル注射用懸濁液。パクリタキセル誘導体のDDS製剤である。水に難溶性のパクリタキセルを溶解するために通常の製剤で使用されている溶媒ポリオキシエチレンヒマシ油(クレモホールEL)を含有しないため、投与時の副作用予防目的のステロイド剤などの前投薬を必要としない。
- アメリカアブラキシス・バイオサイエンス(Abraxis BioSciences)社で開発され、2005年1月に化学療法不応の転移性乳癌あるいは術後補助化学療法6ヶ月以内の再発乳癌を適応としてFDAにより承認された。日本では大鵬薬品工業が開発・販売権を取得し、現在乳癌・胃癌・非小細胞肺癌に保険適応されている。
- DHAパクリタキセル(タクサオプレキシン Taxoprexin)
- 腫瘍細胞に集積しやすい脂肪酸のドコサヘキサエン酸(DHA)をパクリタキセルと結合させたプロドラッグ。パクリタキセルの抗腫瘍効果は、腫瘍内でパクリタキセルがDHAから切り離されたときに発現する。
- ポリグルタメート化パクリタキセル(OPAXIO)
- 血中から腫瘍に移行しやすいポリグルタミン酸をパクリタキセルと結合させたプロドラッグ。パクリタキセルの抗腫瘍効果は、腫瘍内でグルタミン酸のポリマーが分解されたときに発現する。パクリタキセルよりも副作用が軽減され、毒性が低いとされる。商品名がジオタックス(XYOTAX)からOPAXIOに変更された。
- 腫瘍で活性化されるパクリタキセル(tumor-activated Taxol)
- 腫瘍細胞を標的とするモノクローナル抗体をパクリタキセルと結合させたプロドラッグ。血液中を循環している間は抗体とパクリタキセルの結合は安定しているが、標的の腫瘍細胞に到達すると抗体からパクリタキセルが切り離されて抗腫瘍効果を発現する。
- パクリタキセルミセル
- 直径20〜100nmの微小ミセル中にパクリタキセルを封入した製剤。腫瘍組織の血管壁を透過し組織内に集積し、パクリタキセルを放出する。
- 7α‐グルコシルオキシアセチルパクリタキセル
- 水溶性化したパクリタキセル誘導体。表面にトラスツズマブを固定したリポソームに封入して腫瘍組織に送達する。
脚注
- Goodman, Jordan; Walsh, Vivien (5 March 2001). The Story of Taxol: Nature and Politics in the Pursuit of an Anti-Cancer Drug. Cambridge University Press. ISBN 978-0-521-56123-5. https://books.google.com/books?id=vHOOcw4buKoC
関連項目
|
紡錘体毒/ 分裂抑制剤(M期) |
|
||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| DNA複製阻害剤 |
|
||||||||||||||||||||||||||||
| 光増感剤/PDT | |||||||||||||||||||||||||||||
| その他 |
|
||||||||||||||||||||||||||||
| #WHO必須医薬品モデル・リスト ‡市場から撤退した医薬品一覧 治験: †第III相 §第II相以下 | |||||||||||||||||||||||||||||
