モルヌピラビル

| |
| IUPAC命名法による物質名 | |
|---|---|
| |
| 識別 | |
|
CAS番号 |
2349386-89-4 |
| ATCコード | None |
| PubChem | CID: 145996610 |
| DrugBank | DB15661 |
| ChemSpider |
84400552 |
| UNII | YA84KI1VEW |
| KEGG | D11943 |
| ChEBI | CHEBI:180653 |
| ChEMBL | CHEMBL4650320 |
| 別名 | MK-4482, EIDD-2801 |
| 化学的データ | |
| 化学式 | C13H19N3O7 |
| 分子量 | 329.31 g·mol−1 |
| |
モルヌピラビル(英: Molnupiravir)は、COVID-19治療薬として開発された経口活性がある抗ウイルス薬である。商品名はラゲブリオ(LAGEVRIO)。合成ヌクレオシド誘導体N4-ヒドロキシシチジン(EIDD-1931とも呼ばれる)のプロドラッグであり、ウイルスのRNA複製時に複製障害を生じさせることで、抗ウイルス作用を発揮する。
この薬剤は、エモリー大学のドラッグイノベーション企業である Drug Innovation Ventures at Emory(DRIVE)によって開発された。その後、この薬は、マイアミに拠点を置くリッジバック・バイオセラピューティクスに買収され、後にメルク&カンパニーと提携してさらに開発が進められた。
効能・効果
作用機序
モルヌピラビルは、ウイルスのRNA依存性RNAポリメラーゼ酵素を阻害し、より正確には、その酵素の作用の変異を促進する。この薬剤は、シチジンに類似したリボヌクレオシドアナログであるβ-D-N 4-Hydroxycytidine 5′-triphosphate(EIDD-1931 5′-triphosphate、またはNHC-TPとも呼ばれる)に代謝される。RNA複製の際、ウイルスの酵素は、新しく作られたRNAに、本物のシチジンを使う代わりに、NHC-TPを組み込む。
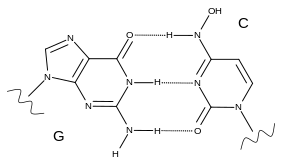
モルヌピラビルは、2つの形態(互変異性体)を変換することができる。1つはシチジン(C)を模倣し、もう1つはウリジン(U)を模倣する。NHC-TPは、ウイルスの酵素である校正エキソヌクレアーゼ(これは、変異したヌクレアーゼを修正版で置き換えることができる)によってエラーとして認識されない。ウイルスのRNAポリメラーゼがモルヌピラビルを含むRNAをコピーしようとすると、時にはCとして解釈したり、Uとして解釈する場合がある。これにより、すべてのダウンストリーム・コピーで、ウイルスが生き残ることができるよりも多くの突然変異が発生する。これは、ウイルスのエラーカタストロフィーまたは致死的突然変異生成と呼ばれる効果である。
化学
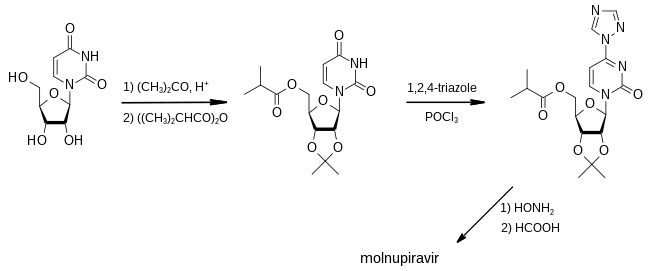
モルヌピラビルの最初の合成法は、2018年にエモリー大学が出願した特許に開示された。
第一段階では、アセトンを保護基として使用し、ウリジンの3つのヒドロキシ基のうち2つをイソ酪酸の酸無水物での処理に対して非反応性にし、3つ目のヒドロキシ基をそのエステルに変換する。1,2,4-トリアゾールと塩化ホスホリルで処理すると、トリアゾール部分をヒドロキシルアミンで置換できる反応性中間体を生成する。最後に、ギ酸を使用して保護基を除去すると、その物質はモルヌピラビルに変換される。
開発の歴史
モルヌピラビルは、エモリー大学のドラッグイノベーション企業であるDrug Innovation Ventures at Emory(DRIVE)によって開発された。2014年、DRIVEは、米国国防脅威削減局から資金提供を受け、ベネズエラ馬脳炎ウイルス(VEEV)を標的とする抗ウイルス剤を見つけるためのスクリーニングプロジェクトを開始し、EIDD-1931の発見につながった。この化合物は、プロドラッグ EIDD-2801(モルヌピラビル)に変化すると、インフルエンザ、エボラ出血熱、チクングニア熱、およびさまざまなコロナウイルスなど、他のRNAウイルスに対しても活性を示した。
一般名『モルヌピラビル(Molnupiravir) 』には、北欧神話の神、トールのハンマーであるミョルニル(Mjölnir)に由来しており、雷神の強烈な打撃のように、薬がウイルスを打ち倒すという意味が込められている。
ジョージア州立大学の教授Richard Plemperは、インフルエンザに対するモルヌピラビルの使用を検討するための米国国立衛生研究所からの助成金の研究責任者であった。2019年末、米国国立アレルギー・感染症研究所は、モルヌピラビルをインフルエンザに対する第I相臨床試験に移行することを承認した。
2020年3月、研究チームはSARS-CoV-2の研究に軸足を移し、新型コロナウイルスに感染したヒト細胞の治療でこの薬剤を使用することに成功した。Plemperのグループは、Nature Microbiology 誌に、モルヌピラビルが動物モデルでSARS-CoV-2に対して経口的に有効であるという最初の実証を発表し、治療を受けていない接触者へのウイルス感染を24時間以内に完全に抑制するという概念実証を確立した。
その後、DRIVEは、リッジバック・バイオセラピューティクスに対し、モルヌピラビルのヒト臨床試験用のライセンスを供与し、同社は後にメルクと提携して薬剤のさらなる開発を進めた。
安全性への懸念の疑義
2020年5月、リック・ブライトは内部告発の苦情を申し立て、トランプ政権がCOVID-19パンデミックに関する彼の初期の警告を無視し、証明されていない薬を不適切に早めるよう圧力をかけ、2020年4月に米国生物医学先端研究開発局(BARDA)の責任者から彼を解任して違法な報復を行ったと主張した。
これらの苦情の中で、ブライトは、COVID-19の治療薬としてモルヌピラビルを開発するためにリッジバック・バイオセラピューティクスに連邦政府からの追加資金を提供することに反対した。彼は、この薬剤はSARS-CoV-2を含むコロナウイルスに対しても可能性を示したが、すでに政府から多額の支援を受けていたと主張した。ブライトはまた、他のヌクレオシドアナログ製剤の中には動物実験で先天性欠損症を引き起こしたという事実があることから、最終承認の前に、モルヌピラビルの安全性データを確認したいと考えていた。
COVID-19臨床試験
2020年7月下旬、リッジバック・バイオセラピューティクスと提携して薬剤を開発していたメルクは、2020年9月からモルヌピラビルを後期試験に移行する意向を発表した。2020年10月19日、メルクは、入院患者に焦点を当てた1年間の第II/III相試験を開始した。
2021年10月、臨床試験の予備的な結果として、モルヌピラビルによる治療が、新たに診断された高リスク患者のCOVID-19による入院および死亡のリスクを約50%低減させることが報告された。この薬剤は、デルタ、ガンマ、ミューなど、さまざまなSARS-CoV-2変異株に対しても同様に働くことが報告されている。メルクの第III相試験委員会の1つは、本薬剤の有効性を評価し、試験が所定のエンドポイントを達成し、本薬剤が患者に価値のある利益をもたらしたことに照らして、プラセボ投与はもはや倫理的ではないと、試験の早期中止を勧告した。米国食品医薬品局(FDA)のモニタリング委員会も同意した。
承認状況と入手性
2021年6月、アメリカ保健社会福祉省は、モルヌピラビルがFDAから緊急使用許可(EUA)または承認を受けた場合、12億米ドル相当(約170万回コース)をメルクから購入することを約束した。
2021年10月1日、メルクは、COVID-19臨床試験の監視をしていた独立諮問委員会が、被験者の募集を早期に停止するように勧告したと発表した。その理由は、モルヌピラビルが入院や死亡のリスクを48%低下させたという、有益性についての確信的な証拠が得られたためである。メルクは、FDAから緊急使用許可を得る計画と、他国の医薬品規制当局へ上市へ向けた申請を行う計画を発表した。さらに、入手性を高めるために、後発医薬品の製造会社へライセンスを与える計画を発表した。
2021年11月4日、イギリスで世界で初めて本薬品の使用が正式に承認された。
2021年12月24日、日本で医薬品医療機器等法14条の3第1項に基づきモルヌピラビル(商品名:ラゲブリオ)が特例承認された。承認条件として、医師に対して「適切な症例のみに対して予め有効性・安全性に関する情報を文書において説明し、文書による同意を得てから投与」するよう要請された。当初は日本国内での流通量に限りがあることから当面の間「厚生労働省が製薬メーカーから買い上げ、厚生労働省から登録・申請のあった医療機関等へ配分する形」を取っている。その後、メーカーの製造・流通体制が充実し日本国内での市場流通も目途が立ったことから、2022年8月18日にラゲブリオが保険適用となり、薬価収載されることとなった。ただし上市から当面の間は国が購入した在庫品が医療機関で処方されることになる。
脚注
外部リンク
- 抗ウイルス薬 ラゲブリオ - MSD(日本語)
|
新型コロナウイルス感染症 (COVID-19)
| |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| SARSコロナウイルス2 |
|
||||||||||||||||||
| 治療 |
|
||||||||||||||||||
| 感染拡大 | |||||||||||||||||||
| 影響 (コロナ禍) |
|
||||||||||||||||||
| 社会の対応 |
|
||||||||||||||||||
| 組織 |
|
||||||||||||||||||
| その他関連項目 | |||||||||||||||||||